花色苷分子結構修飾及其生理活性研究進展
由 璐,隋茜茜,趙艷雪,劉素穩*
(河北科技師范學院食品科技學院,河北 秦皇島 066604)
花色苷是植物的主要呈色物質,是植物世界分布最廣的一類色素,它能使植物呈現紅、藍等色澤,并具有獨特的生理活性功能。研究表明,花色苷具有抗氧化[1-2]、抗衰老[3]、調節血糖[4]、抑制腫瘤[5-6]、修復和保護肝損傷[7]、修復輻射損傷、保護心血管和降血脂等多種生理功效[8-10],應用前景廣闊。但由于花色苷本身的活性,在食品加工中穩定性較差[11],易受pH值、溫度、光、O2、花色苷種類、金屬離子和酶等因素的影響[12-13],限制了花色苷在食品及其加工領域中的應用。因此,擴大天然色素資源花色苷的應用需解決兩方面的問題:一是尋找和開發花色苷含量豐富的植物資源;二是研發合適的花色苷結構修飾技術,以提高花色苷的穩定性并保持其生物活性。分子結構修飾可以提高花色苷在外界環境、食品添加劑和食品加工中的穩定性,使其在較大pH值范圍內表現出良好的色澤,對于拓展花色苷在食品加工、營養和保健品行業中的應用具有重要的現實意義。然而,對花色苷結構修飾改性方面目前研究報道較少,國外學者對葡萄酒中的吡喃花色苷研究較多,而國內學者則偏向于花色苷的酯基化和酰基化,但研究也處于起步階段,效果不是很理想。本文就不同類型(酰基修飾、酯基修飾、形成吡喃類衍生物)花色苷結構修飾的原料來源、結構特征及其生理活性進行了綜述,為進一步研究花色苷的結構穩定性、生理活性及其在食品加工、食品營養和保健品工業的應用提供借鑒。
1 花色苷概述
花色苷是自然界最重要的水溶性色素之一,廣泛存在于27 個科、73 個屬的數萬種植物中,因其具有典型的C6-C3-C6骨架結構,所以,一般把花色苷歸為黃酮類化合物。花色苷具有多種生理活性,因而國內外公認花色苷是資源最為豐富的替代苯胺類煤焦合成色素的優良天然色素[14]。目前,從植物中分離得到的花色苷種類超過500 種[15]。花色苷是花青素以糖苷鍵與糖基結合形成的化合物,花青素又稱糖苷配基,基本結構為2-苯基-苯并吡喃,自然條件下游離狀態的花青素極少見,一般與各種糖基結合以花色苷的形式存在。由于A環和B環各碳位上取代基(羥基或甲氧基)的不同而導致花色苷結構千差萬別[16-17],如圖1和表1所示。
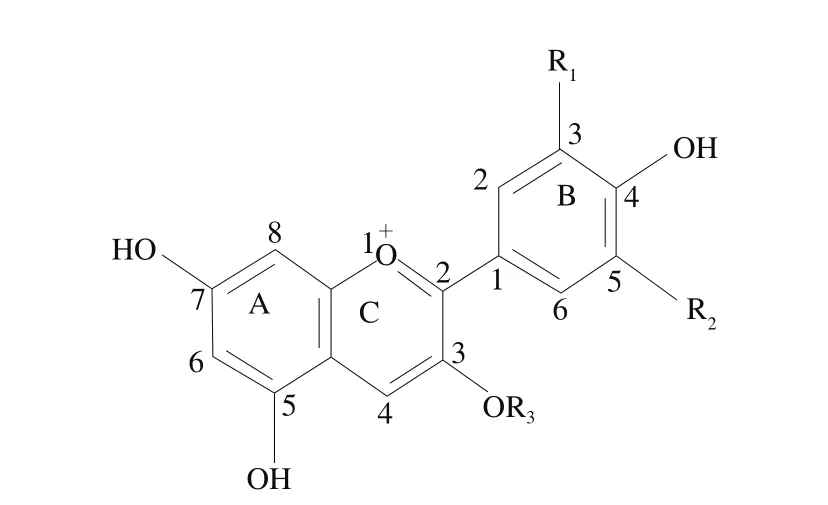
圖1 食品中花色苷元的基本結構[13]Fig. 1 Structure of anthocyanidins most commonly found in foods[13]
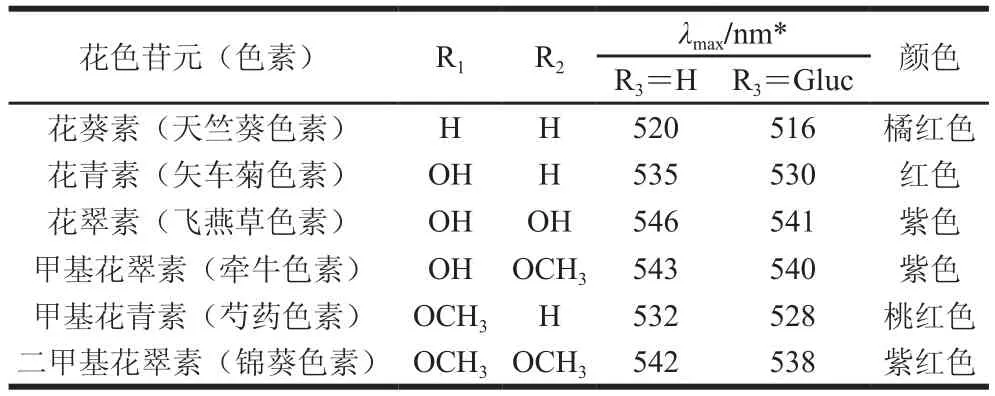
表1 天然花青素糖苷配基的結構及呈色特征[18]Table 1 Structures and chromatic features of natural anthocyanin aglycones[18]
2 花色苷結構修飾的類型
色素在食品工業中一直有著廣泛的應用,但由于合成色素對人體健康存在威脅,因此天然色素越來越受到人們的重視。其中,花色苷作為一種天然可溶性色素,由植物的花瓣和果實中提取,可以滿足食品工業的需求。但其色澤不穩定,在受到諸如溫度、pH值、光照、金屬離子、氧化還原劑等因素影響后,容易產生顏色的變化。且花色苷脂溶性低,不易透過磷脂雙分子層生物膜,從而導致利用率不高[19-20];因此通過修飾改性的方式優化花色苷的結構,可以增加脂溶性,提高其穩定性,是促進花色苷發展和應用的關鍵。目前,部分學者對花色苷的結構修飾研究主要集中于母環結構的羥基化、甲氧基化、酰基化和酯基化。羥基化使花色苷活性更強,但會降低其穩定性。其中花色苷穩定性的降低與羥基化的位置有關,C3或C5位置可增強花色苷的穩定性;甲氧基化、酯基化和酰基化也能增強其穩定性。在溶液介質中,花色苷會隨pH值的變化進行結構轉變,從紫紅色到無色。有研究表明兩個以上酰基可使花色苷在較大pH值范圍內呈現良好的色澤穩定性[21]。
2.1 酰基修飾
經過酰基化后的花色苷結構如圖2所示。Clydesdale等[22]報道苯乙稀酸殘基可與花青素在結構上具有核平行堆積的效果,因此能夠保護發色團,阻礙水的攻擊。對蘿卜色素進行二維核磁共振(nuclear magnetic resonance,NMR)分析發現,花色苷母環與酰基氧原子空間折疊成“三明治”結構[23]。當花色苷中存在酰基時,酰基可阻止花色苷遭受水的親核攻擊,使其不能轉變為無色的查耳酮或藍色的醌酮,因此能保持溶液原有的顏色。Dangles等[24]發現錦葵色素-3-槐糖苷-5-糖苷與咖啡酸酰基化后,穩定性增強,且具有量效關系。張曉圓等[25]也證實了花色苷酰基化使其結構更加穩定,顏色也更深。Odake等[26]發現紫薯色素比紅甘藍、紫蘇等提取的色素在熱加工和紫外線照射方面能更好地保持本身的顏色,原因是紫薯色素中大部分是酰基化的花色苷,穩定性與酰基化程度有關。以上研究表明花色苷酰基化后在對pH值、溫度、光照及添加劑等的穩定性方面優于未酰基化的花色苷。目前酰基化的方法主要有化學酰基化、酶促酰基化和植物組織培養3 種。
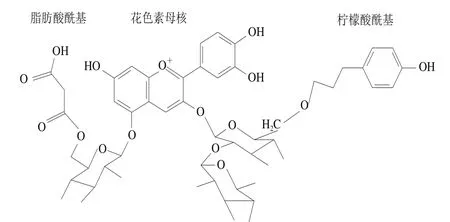
圖2 酰基化花青素結構[27]Fig. 2 Structure of acylated anthocyanins[27]
2.1.1 化學酰基化
化學修飾主要是基于有機合成,選擇適當的酰化劑和催化劑是化學修飾研究的重點。李穎暢等[28]將花青素和乙酸進行酰基化反應,并釆用紫外和紅外光譜對酰基化產物進行測定,結果表明,酰基化后的花青素穩定性明顯提高。Giusti等[29]用月桂酸和丙二酸對花青素進行酰基化修飾,以溫度、pH值和光照作為實驗變量探索了酰基化修飾對花青素穩定性的影響,結果表明,酰基化后的花青素穩定性較高。陳學紅等[30]將純化后的紫甘藍色素溶液與等濃度的阿魏酸、水楊酸混合,反應時間2 h,發現在510 nm波長處除了初始峰外,還產生了新的峰。推測紫甘藍色素與阿魏酸或水楊酸反應后形成了新的花色苷酰化物。趙立儀等[31]用月桂酸酰氯酰基化藍莓花青素后,其對抗光、熱和強氧化劑的穩定性顯著提高。傳統化學酰基化方法在處理花色苷的過程中存在反應激烈、選擇性低,且不能確定酰基化產物結構等一系列問題。而釆用月桂酸為酰化劑的方法反應溫和、選擇性高。以N,N-二甲基甲酰胺作為溶劑、1-羥基苯并三唑和1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽反應生成縮合劑后,先生成月桂酸活化酯(月桂酸為酰化供體),對矢車菊素-3-O-葡萄糖苷酰基化修飾,得到月桂酸酰基化矢車菊素-3-O-葡萄糖苷的轉化率為30.78%,是目前所報道文獻中化學酰基化花色苷轉化率最高的方法。結合傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)和液相色譜-質譜(liquid chromatograph-mass spectrometer,LC-MS)分析,確定酰基化產物相對分子質量為631,為單酰化合物,酰基化位點為糖苷鍵的伯醇羥基,研究表明酰基化后的矢車菊素-3-O-葡萄糖苷在溫度、光照和氧化還原劑等條件下穩定性更好。且酰基化后矢車菊素-3-O-葡萄糖苷的油、水分配系數為7.98,明顯高于酰基化前的0.24[32]。吳浩亮等[33]通過酰基化反應對十大功勞果花色苷進行分子修飾,發現酰基化后的花色苷的光熱降解動力學符合一級動力學反應規律,酰基化修飾后對光、熱的穩定性明顯提高,尤其以丁二酸為酰化供體的酰基化效果極顯著。
另外,也有學者發現高壓處理能使果汁中的花色苷酰基化,Engmann[34]以桑葚果汁為實驗對象,通過施加200 MPa的高壓處理后,桑葚果汁內的花色苷發生了酰基化的現象,生成了天竺葵素-3-O-香豆酸酰葡萄糖苷和飛燕草素-3-O-香豆酸酰葡萄糖苷兩種新的花色苷,含量分別為0.46%和5.8%;當施加的壓力增大到400 MPa時,生成一種新的花色苷,飛燕草素-3-O-香豆酸酰葡萄糖苷含量為5.38%,可見高壓也會使果汁中發生酰基化反應。
2.1.2 酶法酰基化
酰基化反應可以提升花色苷的穩定性,但由于酰基化的過程不具有良好的方向性和選擇性,無法對特定位置的羥基進行酰基化反應,容易結合或者屏蔽一些花色苷的主要活性酚羥基,降低其氧化能力[35]。酶法酰基化因酶對底物有良好的專一性和選擇性,且反應條件溫和,可以針對花色苷中某些部位的羥基進行酰基化反應,因此酶法酰基化應用發展較快。目前,主要有植物體內原有的酰基轉移酶和novozyme 435脂肪酶兩類酶應用到花色苷酰基化反應中,有學者研究證明,這兩種酶對酰基供體具有選擇性[36]。其中,植物體內原有的酰基轉移酶在對羥基進行酰基化反應的過程中需要使用激活的酰基供體,并且對可能產生的衍生物提供適宜的環境,如ATP、pH值等。而435脂肪酶是固定化的南極假絲酵母酶B,反應所需的酰基供體主要有脂肪酸、芳香酸及其相應的酯,可在非水環境的有機溶劑中進行。
趙立儀[27]采用435脂肪酶促酰基化矢車菊素-3-O-葡萄糖苷,發現通過生物酶法得到的酰化產物用MS檢測未發現目標產物,而原料中卻依然存在,即435脂肪酶促酰基化矢車菊素-3-O-葡萄糖苷的過程中不起催化作用,證明生物酶法不適用于矢車菊素-3-O-葡萄糖苷的酰基化反應。原因可能是矢車菊素-3-O-葡萄糖苷等花色苷的苯并吡喃環上含有一個氧正離子,氧正離子的極性很強,會破壞酶的結構;添加的435脂肪酶活性被破壞,不能發揮作用,無法用生物酶法酰基化矢車菊素-3-O-葡萄糖苷等極性很強的花色苷類物質。Castro等[37]采用軟脂酸作為轉化供體,435脂肪酶催化反應,LC-MS檢測發現生成矢車菊素-3-葡萄糖單酯(m/z 687 [M-H]+)和飛燕草素-3-葡萄糖單酯(m/z 704 [M-H]+),但對轉化率并未測定。
2.1.3 植物組織培養
細胞組織中的花色苷在合成酰基化的過程中,酰基化轉移酶起著催化反應的重要作用。Luo Jie等[38]研究確定了3 種花色苷合成中的酰基化轉移酶編碼基因,在一定程度上擴大了該酶的應用范圍。有學者發現在MS培養基中添加p-香豆酸后可使未酰基化的YGM-oa以及YGM-ob轉化為單、雙酰化產物,穩定性提高顯著;同時,色素的總量也增加了兩倍[39]。為合成花色苷,Dougalld等[40]向胡蘿卜細胞培養液中加入苯乙烯酸和芳香酸,得到14 種新的單酰花色苷,利用氫質子磁共振波譜(1H magnetic resonance spectrocopy,1H MR)和MS分析發現,酰基化花色苷在pH 2.0和pH 6.0時,在接近中性環境下穩定性較好。Conn等[41]用花色苷液泡包含物培養液生產矢車菊素-葡萄糖苷和芍藥素-葡萄糖苷,中等濃度和高濃度下得到酰基化花色苷與非酰基化花色苷的比例分別為6.2∶1和4.9∶1,并鑒定了酰基化花色苷的種類。Ji Hua等[42]用含有蔗糖、茉莉酸的葡萄細胞培養液對花色苷液泡包含物進行培養,得到了酰基化花色苷。另外,王振宇等[43]通過微生物降解提取法在提取大花葵花色苷的同時形成酰基化結構,通過結合花色苷的紅外光譜、1H MR和MS,推斷出了乙酸與大花葵花色苷結合形成酰基化的分子結構,但未對其進行具體命名。
目前,花色苷酰基化修飾的類型、來源及轉化率見表2,可知除組織培養外(轉化率為30.9%),其他花色苷酰基化的轉化率較低,且大部分結構和命名不明確。

表2 花色苷酰基化修飾的類型、來源及轉化率Table 2 Types, sources and transformation efficiency of acylated anthocyanins
2.2 酯基修飾
花色苷的酯化修飾不僅提高花色苷的穩定性,而且酯化率較酰化率高,花色苷酯化修飾的類型、來源及轉化率見表3,可知酯化修飾的轉化率要高于酰基化修飾,但轉化后的具體結構未完全明確。朱宏明等[45]通過對黑豆皮花色苷酯化修飾,使酯化物對1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力顯著提高,分子修飾花色苷其體外抗氧化能力明顯增強。分子修飾后的黑豆皮花色苷穩定性實驗表明:K+、Ca2+、Mg2+、Zn2+、Cu2+等金屬離子對抗氧化穩定性均有促進作用,其中K+、Zn2+最明顯。對酯化后的黑豆皮花色苷研究發現,酯化修飾后可見光區最大吸收波長變大,發生紅移,這是由于丁二酸酐連至花色苷后,分子間相互作用減弱,花色苷分子π-π電子對減少,導致吸光度降低。張媛媛等[47]通過對蘿卜紅色素進行乙酰水楊酸酯化修飾,結果表明,修飾后的色素在pH 3~5范圍內保持鮮紅色;修飾后的色素在100 ℃具有較強的穩定性;在室外自然光照射5 d后,損失率僅為21.69%。修飾后的色素提高了pH值、溫度和光的穩定性,這可能與乙酰水楊酸和蘿卜紅色素形成的酯鍵有關。盧曉蕊等[48]用丁二酸酐對胡蘿卜色素進行酯化修飾得到了酯化色素回收率及其光穩定性最好的條件。孫華鈴[49]研究發現黑米色素酯化修飾后水溶解性變差,但易溶于極性低的有機溶劑,如丙酮、氯仿和乙酸乙酯。但黑米色素酯化產物的穩定性較原黑米色素顯著提高。
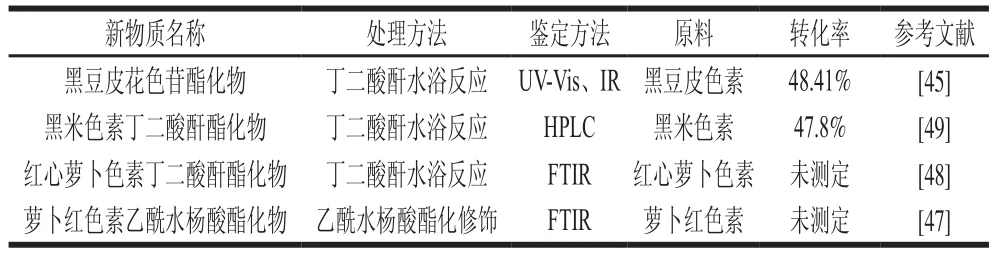
表3 花色苷酯化修飾的類型、來源及轉化率Table 3 Types, sources and conversion rates of esterified anthocyanins
2.3 形成吡喃花色苷
吡喃花色苷是由花色苷在發酵和陳釀過程中形成的一系列天然花色苷衍生物,是目前學者研究較多的一種花色苷新型衍生物[50],其基本結構見圖3。通過環加合反應在花色苷的C4位與C5位的羥基之間形成另外的第4個吡喃環D[51]。目前,許多吡喃花色苷類化合物在發酵果酒或果汁飲料中已經進行了分離和鑒定,主要有甲基吡喃花色苷、Vitisins型吡喃花色苷、酚基吡喃花色苷、Portisins型吡喃花色苷、黃烷醇-吡喃花色苷等。花色苷吡喃化修飾雖然反應時間較長,但轉化率較高。吡喃花色苷與花色苷在許多理化性質上有所不同,與酸性偏紅的花色苷相比,羧基吡喃花色苷、酚基吡喃花色苷等發生最大吸收波長部分藍移[52],顯橙紅色,其中甲基吡喃花色苷吸收波長為487 nm,黃色偏移較大[53]。通過研究吡喃花色苷衍生物的結構特征可知,它們比原花色苷更穩定。在很多研究和文獻中也已經證明了這點。He Jingren等[54]研究了酸性條件下黃烷醇-吡喃花色苷的穩定性,結果表明,pH值為3.6左右時黃烷醇-吡喃花色苷具有最大的吸收光譜,比pH 1.0時高30%~50%。在相同pH值、SO2濃度和貯藏時間下,黃烷醇-吡喃花色苷穩定性高于原花色苷,且對SO2具有很強的抗性,貯藏6 個月后,吡喃花色苷比原花色苷具有更強的穩定性。Bakker等[55]在實驗中也發現了Vitisins型吡喃花色苷衍生物對強氧化劑SO2具備一定的抵抗能力,在這一點上要強于花色苷。將其所處環境變為中性和弱酸性后,相較于花色苷顏色更深。此外,Oliveira等[56]針對pH值和SO2等因素對Portisins型吡喃花色苷的影響進行了研究,與錦葵花色苷相比,其具有很強的抵抗水和酸性亞硫酸鹽親核攻擊的能力,吡喃花色苷能抵抗水的親核攻擊,避免形成無色的半縮醛結構,因此在不同pH值溶液中具有更強的色澤穩定性。
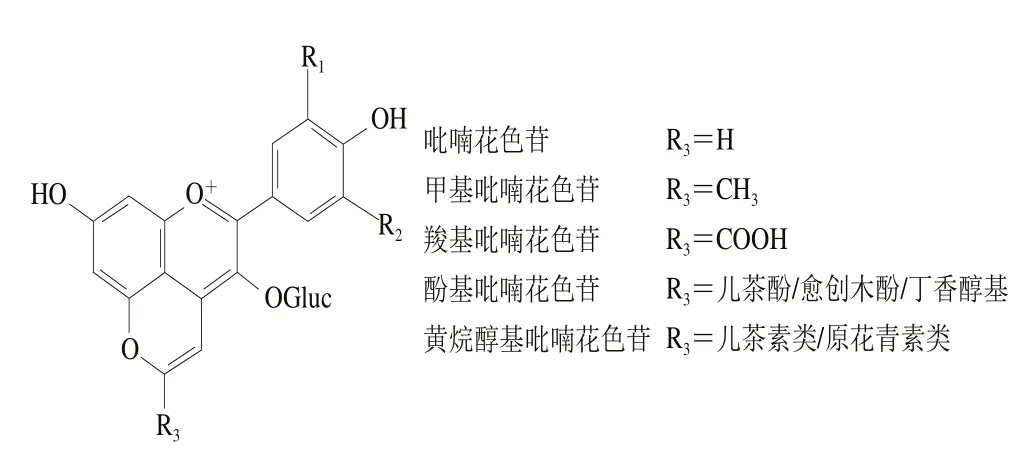
圖3 不同類型吡喃花色苷[13]Fig. 3 Different types of pyranoanthocyanins[13]
鄺敏杰[18]對葡萄皮紅色素進行了甲基吡喃花色苷的合成,經純化后純度達98.31%,在pH 3.0檸檬酸緩沖液中色價為219,最大吸收波長為487 nm,在pH值小于7.0范圍內色澤變化較小,穩定性顯著高于錦葵花色苷且抵御SO2漂白的能力很強。在乙醇和水溶液體系中甲基吡喃花色苷貯藏穩定性高于錦葵花色苷;在室溫條件下其在乙醇和水溶液中半衰期分別為257 d和144 d,遠長于錦葵花色苷(分別為131 d和71 d)。范龔健[57]認為有機酸的種類及其陳釀時間與紫玉米花色苷吡喃衍生物的形成有關。添加阿魏酸的花色苷組分降解明顯,在50 d時檢測到吡喃型花色苷,證明阿魏酸比咖啡酸(80 d)更易和花色苷反應形成吡喃型花色苷。
另外,有研究表明植物花色苷在高壓下會有新的種類以及衍生物出現。Margarita等[58]研究了矢車菊素-3-O-葡萄糖苷和丙酮酸在高壓和加熱下的縮合反應,在600 MPa、70 ℃時持續30 min,矢車菊素-3-O-葡萄糖苷降解25%。與此同時,花色苷Vitisin A類衍生物生成,可能是由于縮合反應使花色苷的共價鍵和果汁中其他黃酮類物質通過環化加成反應形成新的吡喃環。然而縮合率僅有5%,其抗氧化活性也隨之降低,原因可能是花色苷損失量大于合成量。這些反應使紅酒的色澤從棕色變為橘色,色澤變亮。Santos等[59]在實驗中發現當對紅酒進行高壓處理后,紅酒內的總酚含量有了一定的增長,3~10 個聚合度的原花青素含量增加,這可能與酚類物質的縮合反應增加有關。但在9~12 個月的貯藏期中,單體酚含量降低,pH值升高,這可能是由于紅酒花色苷主體成分錦葵素-3-葡萄糖苷含量降低,經縮合反應形成花色苷Vitisin A類衍生物所致,其形成機制見圖4。花色苷結構修飾的類型、來源及轉化率已在表2中給出,其中酰基化花色苷在人工反應中研究較多,但也普遍存在轉化率低的情況。多數研究并未測定酰基化后的花色苷結構,對其理化特性研究較少。花色苷在酯化作用下的轉化率相對較高,能達到50%左右,但其水溶解性較差,多數研究也未測定酯化后的花色苷結構。吡喃型花色苷多數在發酵的果酒中自然形成,其穩定性在醇溶液中較水溶液好,是陳釀果酒的主要呈色物質,但合成時間較長。
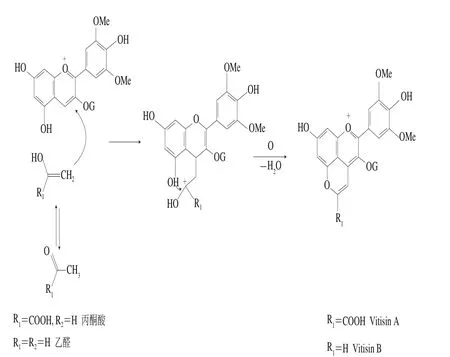
圖4 Vitisins型吡喃花色苷的形成機制[13]Fig. 4 Proposed formation mechanism of Vitisins-like pyranoanthocyanins[13]
常見花色苷吡喃化修飾的類型、來源及轉化率如表4所示。

表4 花色苷吡喃化修飾的類型、來源及轉化率Table 4 Types, sources and conversion rates of pyranoanthocyanins
3 花色苷分子修飾后生理活性
隨著對花色苷結構修飾及穩定性研究的深入,關于其生理活性研究也隨之受到了更多的關注。花色苷的酯化物和酰化物的結構不明確,且生理活性方面也研究較少,多數進行了簡單的體外抗氧化研究(DPPH法等),對體內動物實驗研究較少,因此在酯化物和酰化物的生理活性方面還有待進一步研究。
3.1 酰基修飾花色苷功能活性
酰基化除了能夠提高花色苷的穩定性,有些學者還對其生理活性進行了研究。張智等[44]對藍靛果花色苷進行酰基化修飾,并研究了藍靛果花色苷衍生物對DPPH自由基、·OH、O2-·、H2O2的清除能力,抗脂質過氧化能力,總抗氧化以及總還原能力,與VC對照相比,藍靛果花色苷衍生物具有很強的體外抗氧化活性并且與濃度呈明顯的量效關系。李路寧[46]研究發現,沒食子酰化花青素在DPPH自由基、2,2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)陽離子自由基、O2-·的清除實驗中有較強的抗氧化性。且沒食子酰化花青素抑制脂質過氧化的半抑制濃度為171.7 ng/mol,高于對照21.8%。沒食子酰化花青素對Hep G2、Caco-2兩種腫瘤細胞均有增殖抑制效果,但對于人肝癌Hep G2細胞的增殖抑制效果更好。李穎暢等[28]通過酰基化反應對藍莓花色苷進行分子修飾,用紫外-可見光譜和紅外光譜檢測酰基化藍莓花色苷,酰基化修飾后的藍莓花色苷與未修飾前相比,清除·OH、O2-·的能力略有下降,原因可能是在酰基化過程中花色苷損失較多,且酰化率不高[60]。
3.2 酯基修飾花色苷功能活性
張媛媛等[47]通過對蘿卜紅色素進行乙酰水楊酸酯化修飾,抗氧化活性實驗表明,修飾后的色素仍保持了原有的抗氧化活性。將其與VC的ABTS陽離子自由基清除能力相比較,結果表明,蘿卜紅色素具有更強的的清除能力,且清除率與濃度呈正相關。當蘿卜紅色素和VC質量濃度皆為0.01 mg/mL時,蘿卜紅色素的清除率是98.49%,而VC的清除率僅為79.50%。原因可能是乙酰水楊酸的羧基與色素苯環上的羥基發生了酯化反應,使得苯環上羥基的數量有所減少,導致蘿卜紅色素清除自由基的能力下降。但隨著質量濃度的增加,色素對羥自由基的清除率迅速增大,因此修飾后的色素保持了對羥自由基良好的清除能力。朱宏明等[45]通過分子修飾使黑豆皮花色苷的分子結構發生改變。黑豆皮花色苷酰化物和酯化物對DPPH自由基的清除能力分別達到97.3%和95.4%,且經分子修飾花色苷其體外抗氧化能力明顯增強。
3.3 吡喃花色苷的功能活性
Goupy等[61]在酚基吡喃花色苷和Vitisin A類衍生物對DPPH自由基的清除能力及抑制亞鐵血紅素誘導亞油酸過氧化反應的研究中發現:Vitisin A類衍生物和由錦葵花色苷形成的酚基吡喃花色苷對DPPH自由基的清除能力都高于原錦葵花色苷。鄺敏杰[18]在合成的甲基吡喃花色苷的抗氧化性研究中也有同樣的發現。而Goupy等認為由矢車菊花色苷形成的酚基吡喃花色苷則有相反的表現,酚基吡喃花色苷較于原花色苷對亞油酸過氧化反應具有更強的抑制作用,而Vitisin A類衍生物沒有更好的表現。但也有學者提出相反的觀點,認為Vitisin A類衍生物除了對羥自由基不起作用外,采用鐵離子還原能力(ferric reducing antioxidant power,FRAP)法、總抗氧化能力(trolox equivalent antioxidantcapacity,TEAC)法、氧自由基吸收能力(oxygenradical absorbance capacity,ORAC)法、電子自旋共振波譜法等對Vitisin A類衍生物的抗氧化活性測定結果表明其抗氧化能力很強[62-64]。另外,Garcia-Alonso等[65]采用酶聯免疫吸附測定法證實Vitisin A類衍生物對腫瘤壞死因子有一定的抑制作用。對Portisins型吡喃花色苷采用DPPH法、FRAP法及對大豆脂質過氧化的抑制作用進行測定,發現其具有很強的DPPH自由基清除能力,且抗氧化能力強,甚至能還原鐵離子,但不同花青素形成的Portisins型吡喃花色苷活性不同,如飛燕草花色苷形成Portisins型吡喃花色苷的抗氧化能力降低,而由錦葵花色苷形成的Portisins型吡喃花色苷的鐵離子還原能力最強。有其他研究表明Portisins型吡喃花色苷具有很強的抗氧化能力[66-68]和抵抗人乳腺癌細胞增殖的能力[69]。鄺敏杰[18]研究發現隨著甲基吡喃花色苷濃度增加,甲基吡喃花色苷清除自由基能力和氧化還原能力也增強,對·OH的清除能力與VC相當,顯著高于錦葵花色苷(P<0.05);而清除DPPH自由基能力和對氧化物的還原能力則較弱,但二者差異不顯著(P>0.05);其對H2O2引起的衰老模型細胞損傷具有明顯的保護作用;毒理學實驗表明,甲基吡喃花色苷對雌性和雄性小鼠均無毒害作用。范龔健[57]在對紫玉米酒的咖啡酸和阿魏酸輔色的研究中發現,花色苷阿魏酸衍生物和咖啡酸衍生物總抗氧化能力分別為15.01 U/g和13.90 U/g,清除O2-·能力分別為80.65 U/g和87.56 U/g,兩者和錦葵素-3-葡萄糖苷之間無顯著性差異(P>0.05),表明花色苷輔色后其生理活性沒有下降,達到預期目標;而兩種有機酸衍生物DPPH自由基的清除率分別為66.95%和60.33%,活性大幅度提高,與原有花色苷相比有顯著差異(P<0.05)。對阿魏酸衍生物和咖啡酸衍生物的還原力、清除DPPH自由基能力、抑制脂質過氧化能力和清除·OH能力進行比較,其中咖啡酸衍生物的清除能力和還原力都要強于阿魏酸衍生物,而阿魏酸衍生物的抗氧化力要強于咖啡酸衍生物。采用噻唑藍(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法檢驗兩種有機酸衍生物對人胃癌細胞MGC-823和人腸癌細胞HCT-ll6的抑制腫瘤活性,結果表明,5 種花色苷組分對腫瘤細胞均有抑制作用,且其抗腫瘤活性與花色苷及其衍生物濃度呈線性關系。
不同花色苷結構修飾后功能活性的測定方法及實驗對象如表5所示。
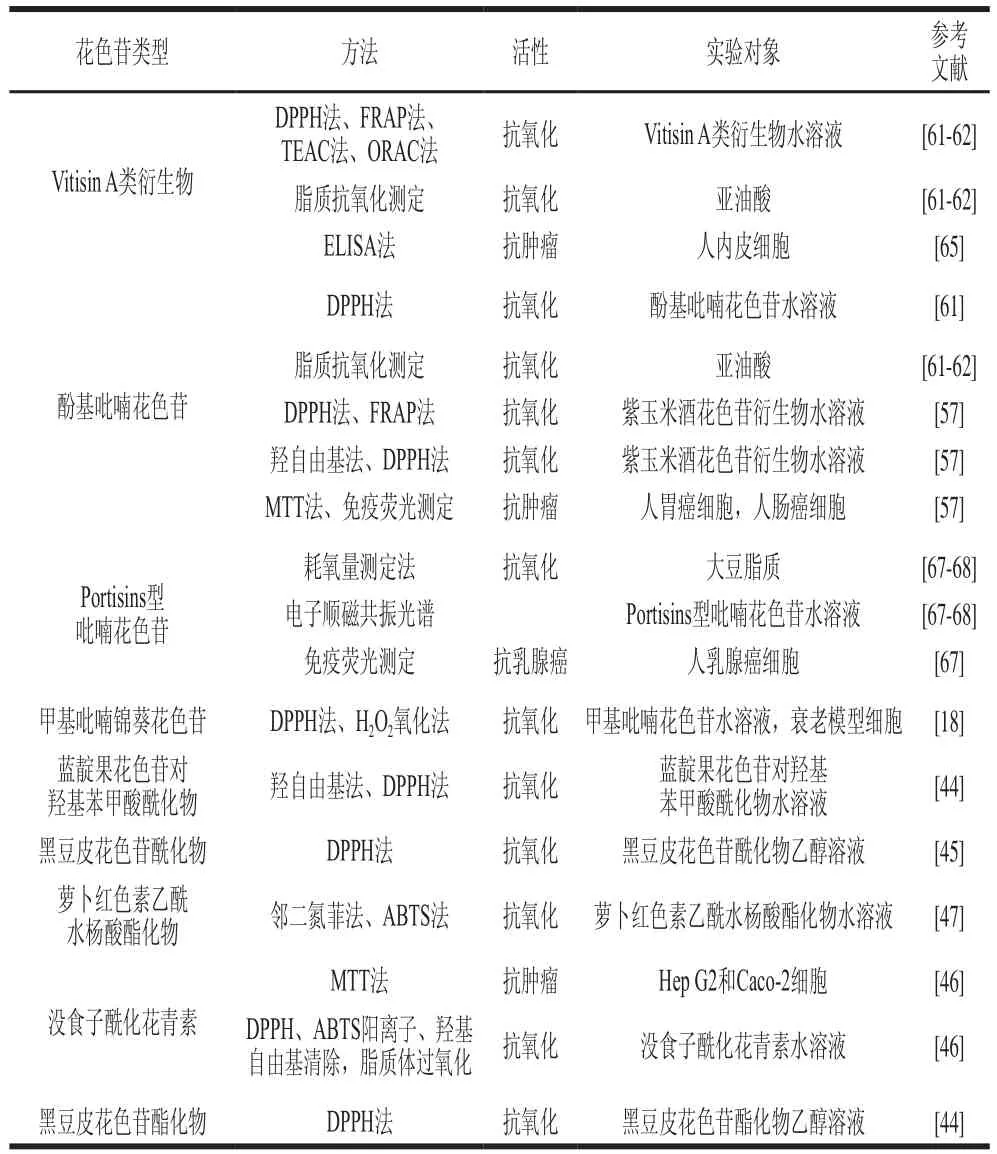
表5 不同花色苷結構修飾后功能活性的測定方法及實驗對象Table 5 Methods and test objects for functional activity assay of different anthocyanins of structural modifications
4 結 語
目前,對花青素及花色苷的基礎應用研究取得了很大進展,但其在實際食品中的應用依然存在花色苷穩定性差、色澤不牢、易受外界環境影響和加工分解等問題。由于脂溶性差、不易透過磷脂雙分子層的細胞膜、難以到達靶向作用點等問題使得其生理價值大幅度降低,因此對花色苷結構進行分子修飾是當前的研究熱點。在一般化學修飾方法中存在著定向性差的問題,而酶法修飾對花青素酰基化是否可行還有待研究。酰基化花色苷在人工反應中研究較多,其中酰基化后的花色苷穩定性高、抗氧化性強,能更好地保持溶液本身的顏色,但普遍存在轉化率低的問題。多數研究并未測定酰基化后的花色苷結構,同時對于其理化特性研究也很少,但若能克服其轉化率低的問題,將使其具有廣闊的發展潛力。花色苷的酯化作用轉化率相對較高,能達到50%左右,但其水溶性較差,多數研究也未測定酯化后的花色苷結構。吡喃型花色苷在發酵的果酒中自然形成,其穩定性在醇溶液中較水溶液好,而且是陳釀果酒的主要呈色物質,但人工合成時間較長。另外,花色苷的酯化物和酰化物的結構不明確,在生理活性方面研究較少。且研究中大都只進行了簡單的體外抗氧化研究(DPPH法等),而對體內動物實驗研究較少,獲得的結構修飾物的急慢性毒性和其在體內吸收代謝途徑等生理活性方面還有待進一步研究。如能解決以上問題,花色苷作為新型抗氧化劑和天然色素在醫藥和食品等領域會有更廣闊的應用前景。

