西瓜未受精子房離體培養技術
龔思 梁少華 嚴靜怡 鄒甜 楊潔 楚簫 陳澤南 孫小武

摘? ? 要: 西瓜未受精子房離體培養作為單倍體育種的有效方法,可極大提高育種效率。以西瓜‘早佳未受精子房為試材,對西瓜未受精子房出胚率的影響因素進行了研究,并鑒定了再生植株倍性。試驗結果表明,栽培季節對西瓜未受精子房離體培養有很重要的影響,在相同的培養條件下,秋季栽培出胚率可達21.33%,高出春季栽培約6%;取材當天的日最低、最高氣溫對西瓜未受精子房離體培養出胚率也有一定的影響,在21~35 ℃范圍內日平均出胚率均可達10%,顯著高于過低或過高氣溫下統計的出胚率;4 ℃低溫預處理并不能提高西瓜胚狀體誘導效率。利用染色體計數法與流式細胞儀鑒定36棵再生植株倍性,單倍體率為97%、二倍體率為3%。
關鍵詞: 西瓜;未受精子房;單倍體;倍性鑒定
Study on the technology of unfertilized ovary culture in watermelon
GONG Si,LIANG Shaohua,YAN Jingyi,ZOU Tian,YANG Jie,CHU Xiao,CHEN Zenan,SUN Xiaowu
(College of Horticulture and Landscape, Hunan Agricultural University,Changsha 410128,Hunan, China)
Abstract: In vitro culture of unfertilized ovary of watermelon is an effective method for haploid breeding. In this experiment, unfertilized ovaries of ‘Zaojia were chosen to study the factors affecting the germination rate of unfertilized ovary, also identify the regenerated plant ploidy. The results showed that the cultivation season was an important factor on the in vitro culture of unfertilized ovary of watermelon. In the same cultivate conditions, the induction rate which draw materials of autumn was 21.33%, about 6% higher than that in spring. The lowest and highest temperature of the day when materials selected also affect the induction rate, within the range of the 21-35 ℃, the average induction rate can reach 10%, significantly higher than the induction rate on the temperature too low or too high; Low temperature pretreatment (4 ℃) can not improve the efficiency of watermelon embryoid induction rate. We acquired 36 regeneration plants and used chromosome counting and flow cytometry to determine the ploidy levels of them. The ploidy of regeneration plants was clarified as 97% haploid, 3% diploid.
Key words: Watermelon; Unfertilized ovary; Haploid; Ploidy identification
西瓜(Citrullus lanatus)屬于葫蘆科西瓜屬,目前作為中國一種重要的園藝經濟作物,在全世界范圍內都有廣泛的種植。傳統的西瓜育種技術需要通過至少8代的反復自交篩選后獲得純系植株,因此,傳統育種方法限制了新品種的研究,不能滿足中國現階段新型農業發展的需求。單倍體育種獲得的雙單倍體(DH)不存在等位基因位點的顯隱性作用,隱性基因控制的性狀能夠充分體現,故可極大降低育種材料的誤選概率,提高育種效率。與此同時,單倍體育種獲得的完全純合同質的雙單倍體群體,可作為數量性狀研究、分子標記與遺傳分析的良好材料。但西瓜單倍體自然產生概率低[1],無法滿足育種研究進程,因此,人工誘導產生單倍體植株十分重要。
目前人工誘導單倍體方式主要是孤雄生殖與孤雌生殖兩種方式,孤雄生殖通過花藥和小孢子培養在結球甘藍、青花菜、蘿卜等十字花科作物中已有較成熟的進展[2-3],而葫蘆科作物起步晚,雖然在西瓜、黃瓜、苦瓜等作物上有過研究報道,但是獲得的結果都不理想[4-7]。目前,未受精子房離體培養是獲得西瓜單倍體植株的最佳途徑。李迎迎等[8]對西瓜在3種基因型未受精子房離體培養中獲得了4棵再生苗,利用流式細胞儀鑒定了再生植株倍性,結果表明,1株為四倍體,其余3株為單倍體與二倍體的嵌合體植株。鄒甜等[9]在西瓜未受精子房離體培養中發現,基因型是影響西瓜未受精子房離體培養的關鍵因素,對培養基成分、激素濃度進行了篩選,并對50株再生植株進行倍性鑒定,結果分析單倍體率為96%,二倍體率為4%,未發現四倍體與嵌合體。至今,雖然西瓜未受精子房離體培養研究較多,但是主要集中在基因型篩選、培養基成分、激素種類與濃度等方面的研究[9-16],且胚狀體誘導率低,供體植株栽培季節、取材時日氣溫差異、未受精子房低溫預處理等對植株離體雌核發育有重要影響[17-21],但西瓜有關此方面的研究尚未見報道。
針對上述問題,筆者以西瓜‘早佳品種為試材,進一步分析大棚春秋季不同栽培時間、日最高與最低氣溫、低溫冷凍預處理時間等對未受精子房離體培養出胚率的影響,并在前人的研究基礎上篩選西瓜未授粉子房離體培養的分化培養基,且對再生植株進行了倍性鑒定。旨在為建立高效穩定的西瓜單倍體誘導技術體系奠定基礎,為今后西瓜新品種的選育與育種新材料創制提供依據。
1 材料與方法
1.1 材料
供試西瓜品種‘早佳由湖南雪峰種業有限責任公司提供,為雜交一代材料(2n=2x=22),試驗于2017年1—12月在湖南農業大學溫室大棚與湖南省瓜類工程技術研究中心進行。
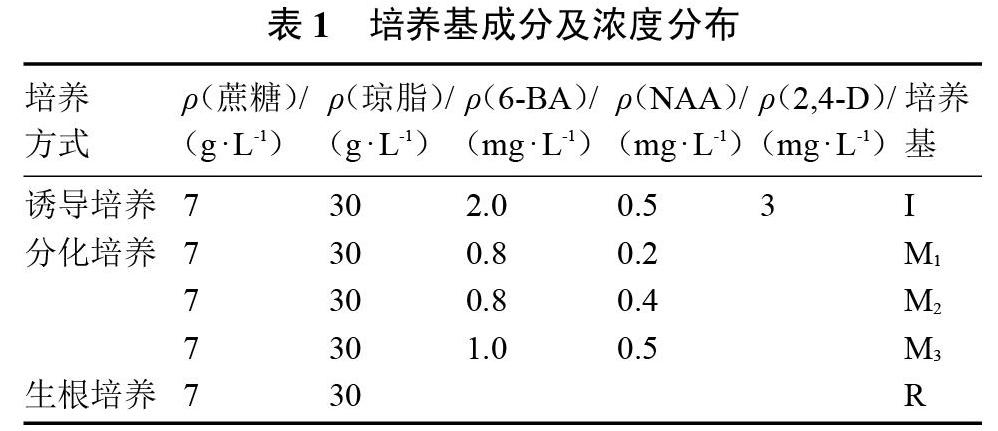
誘導、分化、生根培養基以MS為基本培養基,并附加不同濃度配比的2,4-D、6-BA、NAA等激素,pH調至5.8,培養基成分見表1。
1.2 處理及培養方法
1.2.1 未受精子房的采集與消毒 從第2個雌花節位以后開始取材,開花前一天17:30—18:00點套袋,開花當天7:30—8:00用裝有碎冰的泡木箱取樣,取回材料立即處理或者放置4 ℃冰箱保存后進行消毒切片試驗,不能放置在常溫條件下避免2次成熟。首先摘取子房并流水清洗,在超凈工作臺上先用75%的乙醇消毒1 min、無菌水沖洗3次,濾紙吸干表面水分后削皮切片成1 mm左右的薄片,而后立即放置2%的NaClO溶液消毒4 min、無菌水反復沖洗5次,無菌濾紙吸干表面水分至胚珠暴露后接種到預先準備的誘導培養基中,每個處理接種5瓶并設計3次重復,每瓶接種8片。
1.2.2 誘導培養 先在35 ℃通風透氣的恒溫箱里黑暗熱激處理4 d,熱激處理后胚珠膨大呈嫩黃色,接著放置光照為16 h·d-1,光強2 500 Lx、溫度(25±1)℃的組培室培養,組培室誘導培養5 d左右胚珠大部分轉綠。
1.2.3 分化培養 誘導培養15 d后,將子房片在超凈工作臺上轉移至分化培養基,放置組培室繼續培養,轉綠后的胚珠部分變黃,部分形成胚狀體,培養30 d左右會開始出胚,以后每隔5 d統計1次出胚數直至培養到60 d截止,出胚率為總出胚數與總接種子房片數的百分比。
1.2.4 生根培養 待胚狀體繼續生長分化出明顯的形態學上端與下端后,在超凈工作臺上轉移至MS生根培養基中,不添加輔助激素以促進胚狀體生根,并放于組培室繼續培養至長成再生植株,再生植株可在超凈工作臺上通過新長出的帶芽節位進行擴繁,之后通過選取根尖與葉片進行倍性鑒定。
1.3 栽培季節對西瓜未受精子房離體培養出胚率的影響
1月中旬育苗,1—6月為春季栽培取材時間,9月中旬育苗,9—12月為秋季栽培取材時間,在生長階段進行同樣的水肥管理,春季栽培與秋季栽培材料在培養階段用M1、M2、M3進行胚狀體誘導試驗,材料處理及培養方法如1.2。
1.4 日最高與最低氣溫對西瓜未受精子房離體培養出胚率的影響
在秋季栽培出胚率較高的9月16—27日連續12 d對生長環境進行監測,包括天氣、日最高氣溫、日最低氣溫等,統計每天西瓜未受精子房離體培養的出胚率。
1.5 冷凍預處理對西瓜未受精子房離體培養出胚率的影響
以每日同一批采回的西瓜未受精子房為材料,放置4 ℃冰箱分別冷凍預處理1、2、3 d,以不做低溫預處理的新鮮材料作對照,材料處理及培養方法如1.2。
1.6 再生植株倍性鑒定方法
1.6.1 染色體計數法 當根長至1~2 cm時取0.4~0.5 cm根尖進行預處理,預處理后用無菌水沖洗多次后再用固定液固定12~24 h。經固定后的根尖可用無菌水沖洗后進行解離,也可置于70%的酒精溶液中保存。解離后的根尖用無菌水沖洗3次后浸入改良品紅中染色。將染色后的根尖取出置于潔凈載玻片上,切除伸長區(約0.1 cm)后滴1滴45%醋酸溶液,覆上蓋玻片,然后可用鑷子輕輕敲片,以便根尖組織散開,即可在高倍顯微鏡下觀察。選取染色體分散較好的體細胞進行拍照,并統計染色體數。
1.6.2 流式細胞儀檢測 流式細胞術是一種在功能水平上對單細胞或其他生物粒子進行定量分析和分選的檢測手段,它能高速分析上萬個細胞,并能同時從一個細胞中測得多個參數。取新鮮待測植物葉片0.5 cm2,置于培養皿中,取Partec CyStain UV Precise P裂解液400 ?L加于植物葉片周圍,用刀片將葉片切碎,以充分提取出完整的細胞核,提取時間取決于樣本性質,一般為10 s,后將培養皿中的液體用30 ?m濾網過濾至樣品管中,向樣品管中加入Partec CyStain UV Precise P染液1 600 ?L,染色時間取決于樣本性質,一般為10 s,上機測定植株細胞DNA的相對含量。
1.7 數據處理
試驗數據采用SPSS 20.0與Excel 2007軟件進行統計分析。
2 結果與分析
2.1 胚狀體發育過程及誘導成苗
據試驗觀察,胚狀體發育及誘導成苗過程如圖1,在35 ℃烘箱熱激4 d后,通過外界的適度高溫脅迫,胚珠抗逆反應,顯著膨大,呈嫩黃色(如圖1-a)。轉移至組培室后光暗培養5 d左右胚珠轉綠,此時大部分胚珠都會轉綠,但并不是轉綠的胚珠都會分化成胚狀體,轉綠的胚珠又會變黃(如圖1-b)。在組培室培養大約30 d后會逐漸形成肉眼可見的黃綠色胚狀體(如圖1-c),待胚狀體分化出明顯的形態學上端與下端時轉至MS生根培養基中,最終生長成完整的植株(如圖1-d)。
2.2 栽培季節對西瓜未受精子房離體培養出胚率的影響
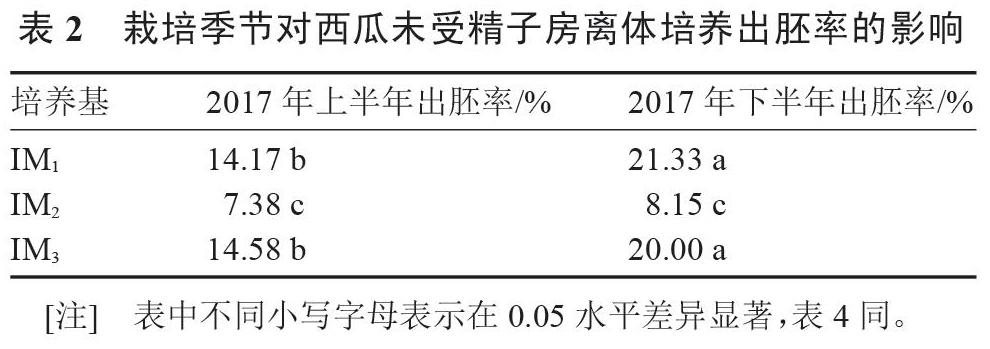
由表2可知,2017下半年西瓜‘早佳品種未受精子房在誘導效果較好的分化培養基M1、M3中出胚率可達21.33%、20.00%,均顯著高于2017上半年出胚率,而在M2中同樣略高于上半年的出胚率。由分析結果可以得出下半年種植栽培(即秋季栽培)條件下更有利于誘導胚狀體的產生。
2.3 日最高與最低氣溫對西瓜未受精子房離體培養出胚率的影響
由表3可知,2017年9月連續12 d內出胚率有6 d在10.00%以上,分別為15.00%、17.78%、11.79%、12.17%、13.33%、10.00%,相對應的日最高氣溫/最低氣溫(℃)分別為31/22、32/22、31/22、25/22、27/21、32/21,由此可見,在日最高氣溫低于32 ℃、日最低氣溫高于21 ℃條件下胚狀體誘導率相對較高。說明日氣溫過高或過低對未受精子房離體培養誘導出胚不利。
2.4 冷凍預處理對西瓜未受精子房離體培養出胚率的影響
由表4可以看出,4 ℃冷凍預處理0 d時出胚率為10.00%,顯著高于4 ℃低溫冷凍預處理1、2、3 d時的出胚率。由分析結果可以得出,西瓜未受精子房不進行冷凍預處理時更有利于誘導胚狀體的發生。
2.5 胚狀體成苗情況
通過對胚狀體后期生長狀況的觀察與記錄,筆者在胚狀體分化生長成完整植株的過程中發現了一些不完全發育的胚狀體,結果如圖2,主要分為無生長點植株(圖2-a)、白化苗(圖2-b)、生長緩慢植株(圖2-c)、玻璃化植株(圖2-d)以上4類。
2.6 再生植株的鑒定
本試驗共得到58株再生植株,我們利用染色體計數法與流式細胞儀檢測2種方法對其中36株植株進行了倍性鑒定,結果發現其中35株為單倍體,只有1株為二倍體,根尖染色體計數法如圖3,流式細胞儀鑒定結果如圖4。
3 討 論
在之前的研究中,‘早佳品種在西瓜未受精子房離體培養中出胚率最高[9],但總體來說西瓜未受精子房離體培養出胚率偏低,說明誘導體系還有待進一步的優化。植物未受精子房離體培養研究中發現春、秋不同的栽培季節,胚狀體誘導率存在顯著性差異。謝冰等[19]在西葫蘆的培養研究中,秋播材料出胚率明顯高于春播材料,認為這可能與西葫蘆是短日性植物有關。魏愛民等在黃瓜未受精子房離體培養研究中,顯示單倍體胚胎的發生率及植株的再生率在秋季溫度較高的6、7和9月份更容易發生,且明顯高于其他季節[17]。本試驗與前人研究結果一致,西瓜秋季栽培取材的胚狀體誘導率顯著高于春季,這也可能與西瓜植株的生長喜歡溫暖干燥的氣候環境有關。
供體植株取材時日最高氣溫低于32 ℃、日最低氣溫高21℃時出胚率保持在10.00%以上,高于其它溫度條件下的胚狀體誘導率,說明溫度對西瓜未受精子房離體培養出胚率的影響很大,這可能與西瓜生長發育最適溫度為24~30 ℃、根系生長最適溫度為30~32 ℃有關。此項研究僅供參照,由于供體植株的生長環境(溫度、光照等)對出胚率的影響較大,更具體的結果需做更規律性的研究。
而西瓜未受精子房在不做低溫預處理的情況下出胚率最高,這與草莓4 ℃低溫預處理2 d能提高未受精子房出胚率的結果不一致[20],但是隨著預處理時間的延長出胚率并沒有降至零或者有規律的持續降低,說明4 ℃冷凍處理對胚珠活力保持起到一定的作用,本試驗可能存在誤差,具體的結果需要更具體的研究。
在本次研究工作中,除了未受精子房離體培養出胚率仍偏低這個主要問題以外,在胚狀體分化成完整植株的過程中也遇到了一些問題,比如說植株無生長點、白化苗、植株生長緩慢、植株玻璃化等現象。閔子揚等[22]在南瓜未受精子房離體培養中有提到類似問題,這可能與在誘導培養階段使用的激素種類與濃度有關,也有可能與胚狀體在分化培養基上生長的時間有關。在下一步研究工作中,需要調整激素組成與濃度,按階段對胚狀體的分化狀態進行記錄,確定轉移至生根培養基的最佳時期。
倍性鑒定結果得出再生植株單倍體率為97%、二倍體率為3%,未發現嵌合體與四倍體。這與Zou等[9]在西瓜單倍體培養試驗中再生植株倍性鑒定結果一致,由于DNA流式細胞儀測定可靠性較高、方法簡便易懂等特點,已成為倍性檢測的一種新手段,運用到了草莓、甘藍、黃瓜、西葫蘆、西瓜等多種作物倍性鑒定的研究[15-19]。筆者用流式細胞儀基本確定了再生植株的倍性,并用根尖染色體計數法進一步驗證了其倍性。
4 結 論
筆者建立了比較完善的西瓜未受精子房離體培養體系,提高了胚狀體誘導率,獲得了較多的再生植株,并且形成了一套較為精確的西瓜再生植株倍性鑒定方法,試驗結果對后續試驗具有重要的參考意義。接下來的試驗應對獲得的西瓜單倍體植株進行馴化移栽、染色體加倍等工作,希望本試驗成果能早日運用到育種工作中。
參考文獻
[1] SARI N,ABAK K,PITRAT M,et al.Induction of parthenogenetic haploid embryos after pollination by irradiated pollen in watermelon[J].Hortscience A Publication of the American Society for Horticultural Science,1994,29(10):1189-1190.
[2] 袁素霞,劉玉梅,方智遠,等.結球甘藍和青花菜小孢子胚植株再生[J].植物學報,2010,45(2):226-232.
[3] 李金榮,歐承剛,莊飛云,等.胡蘿卜游離小孢子培養及其發育過程研究[J].園藝學報,2011,38(8):1539-1546.
[4] 胡雪丹,張曼,徐錦華,等.葫蘆科作物游離小孢子培養研究進展[J].江蘇農業科學,2016,44(6):25-29.
[5] 緱艷霞,張明方.西瓜花藥離體培養影響因子研究[J].北方園藝,2013(10):117-120.
[6] 詹艷,陳勁楓,MALIK A A.黃瓜游離小孢子培養誘導成胚和植株再生[J].園藝學報,2009,36(2):221-226.
[7] 唐懿,李萬寧,劉繼,等.苦瓜花藥培養研究進展[J].長江蔬菜,2010(24):4-7.
[8] 李迎迎.西瓜未授粉子房離體培養技術的研究[D].鄭州:河南農業大學,2017.
[9] TIAN Z,HE-NAN S,QI W.Haploid induction via unfertilized ovary culture in watermelon [J].Plant Cell,Tissue and Organ Culture,2018,135:179-187.
[10] 王燁,顧興芳,張圣平,等.黃瓜未受精胚珠離體培養及單倍體植株再生[J].園藝學報,2015,42(11):2174-2182.
[11] 李玲,閔子揚,童龍,等.西瓜未授粉子房的離體培養[J].中國瓜菜,2014,27(6):6-10.
[12] 徐洪國,宣楊,仲娟娟,等.小果型西瓜子葉節離體培養[J].中國瓜菜,2018,31(3):38-40.
[13] 王燁,顧興芳,張圣平.預處理和外源激素對黃瓜未授粉子房的胚狀體誘導的影響[J].華北農學報,2008(S1):50-53.
[14] 劉穎穎,劉世琦,薛小艷,等.大蒜未受精子房離體誘導單倍體的研究[J].園藝學報,2013,40(6):1178-1184.
[15] 賈思齊,王超,王帥,等.甘藍未受精子房離體培養及再生植株倍性的鑒定[J].中國農學通報,2017,33(18):42-48.
[16] 榮文娟,劉君璞,朱迎春,等.西瓜未受精胚珠離體培養若干影響因素的研究[J].中國瓜菜,2015,28(3):9-13.
[17] 魏愛民,韓毅科,杜勝利,等.供體植株栽培季節和栽培方式對黃瓜未受精子房離體培養的影響[J].西北農業學報,2007(5):141-144.
[18] TOSCA A,ARCARA L,FRANGI P.Effect of genotype and season on gynogenesis efficiency in Gerbera[J].Plant Cell,Tissue and Organ Culture,1999,59(1):77-80.
[19] 謝冰.西葫蘆的離體雌核發育及植株再生[D].山東泰安:山東農業大學,2005.
[20] 王文和,吳祿平,趙玉萍.草莓未受精子房的離體培養[J].中國農學通報,2011,27(13):177-182.
[21] 黃金華,董彥琪,王文英,等.葫蘆科蔬菜單倍體育種技術研究進展——未授粉子房離體培養技術[J].中國瓜菜,2016,29(5):1-4.
[22] 閔子揚,李涵,鄒甜,等.南瓜未授粉子房離體培養及植株再生[J].植物學報,2016,51(1):74-80.

