檳榔提取物對α-葡萄糖苷酶的抑制作用研究
宋菲,張玉鋒,郭玉如,李瑞,陳華,唐敏敏
(中國熱帶農業科學院椰子研究所,海南文昌571339)
糖尿病是危害人類健康的主要疾病之一,且近年來發病率呈逐年上升的趨勢,其中90%左右的糖尿病患者類型都為II 型糖尿病(非胰島素依賴型)。餐后高血糖是II 型糖尿病發病的主要風險因素[1]。α-葡萄糖苷酶屬于低聚糖水解酶類,是一類能夠從α-葡萄糖苷鍵底物的非還原端催化水解α-葡萄糖基的酶的總稱,能夠在人體內水解多糖釋放出葡萄糖,導致餐后高血糖的發生。α-葡萄糖苷酶抑制劑通過競爭性地抑制小腸刷狀緣上皮細胞的α-葡萄糖苷酶,阻礙直鏈或支鏈低聚糖單元如糊精、麥芽糖、麥芽三糖分解產生葡萄糖的過程,從而延緩葡萄糖的吸收,降低餐后血糖的升高幅度[2-3]。因此控制α-葡萄糖苷酶活性是治療前期糖尿病患者和緩解糖尿病癥狀的有效方法。目前一些人工合成的α-葡萄糖苷酶抑制劑,如阿卡波糖等已用于臨床治療,但長期服用會引發消化系統紊亂等副作用[4]。因此,眾多研究者把目光集中在了天然產物上,期望得到一種活性高且安全無毒的新型天然抑制劑成分。
檳榔是海南省第一大特色經濟作物,種植面積達15.58 萬hm2。檳榔富含多酚、多糖、生物堿等成分,具有多種功能活性,是我國四大南藥之首,有著悠久的藥用歷史[5]。然而長期以來,檳榔藥用價值的研究和開發利用嚴重不足。目前檳榔主要用于加工成檳榔干果,作為咀嚼嗜好品供消費者食用,既沒有最大化發揮其價值,還經常受到食用安全負面報道的影響,嚴重制約了檳榔產業的健康可持續發展。
目前對檳榔功能性物質的研究主要集中在檳榔堿及檳榔多酚,包括提取工藝優化及抗氧化、抗衰老等活性方面的研究[6-8]。但國內外尚未見檳榔對α-葡萄糖苷酶抑制作用的相關報道。鑒于此,本文研究檳榔提取物對α-葡萄糖苷酶的抑制作用,并通過抑制動力學試驗明確酶活性抑制類型。一方面,為新一代天然、高效降糖藥物及保健品的開發提供理論支撐,為糖尿病的治療和控制提供解決方案;另一方面,還可增加檳榔產品附加值,延長檳榔產業鏈,對促進檳榔產業健康可持續發展具有重要意義。
1 材料與方法
1.1 材料與試劑
檳榔果、檳榔花均采自中國熱帶農業科學院椰子研究所科研實驗基地;α-葡萄糖苷酶(來源于釀酒酵母,14.5 U/mL)、葡萄糖、兒茶素:美國 Sigma 公司;對硝基苯基-α-D-吡喃葡萄糖苷(P-nitrophenyl-α-D-glucopyranoside,PNPG):上海源葉生物科技有限公司;阿卡波糖:北京索萊寶科技有限公司;其他所用的化學試劑均為分析純。
1.2 主要儀器
PS-40 超聲波清洗機:深圳市超藝達科技有限公司;AL204-IC 電子天平:梅特勒-托利多儀器(上海)有限公司;DK-98-11A 電熱恒溫水浴鍋:天津市泰斯特儀器有限公司;Varioskan Flash 全波長多功能酶標儀:美國Thermo 公司;PHS-3C pH 計:上海儀電科學儀器股份有限公司;DP-406DG 真空冷凍干燥機:無錫德普儀器制造有限公司。
1.3 方法
1.3.1 檳榔提取物的制備
采收5 個~6 個月果齡的檳榔鮮果,對半切開,60 ℃烘干,將檳榔殼及檳榔籽分別粉碎后備用。檳榔花采收后60 ℃烘干,備用。粉碎后的樣品以水作為提取溶劑,超聲波輔助法提取。取樣品 10 g,料液比 1∶10(g/mL),超聲波頻率40 kHz,超聲提取時間30 min/次,提取后400 目紗布過濾,提取 3 次,合并濾液,15 000 r/min 離心30 min,收集上清,冷凍干燥后,得到提取物粉末,稱重后計算提取物得率。
提取物得率/%=冷凍干燥后各樣品粗提物的重量(g)/樣品的質量(g)×100
1.3.2 提取物中多酚及多糖含量的測定
各樣品提取物中多酚含量的測定采用福林酚法,參照文獻[9]中的方法進行,多酚含量以兒茶素當量計算。多糖含量的測定采用苯酚-硫酸法,參照文獻[10]中的方法進行,其中以葡萄糖作為對照標準品。
1.3.3 α-葡萄糖苷酶活性抑制試驗
檳榔提取物對α-葡萄糖苷酶活性抑制試驗方法參考Xu 等[11]的方法,并稍作改動。采用0.1 mol/L 的磷酸鹽緩沖液(phosphate buffered saline,PBS,pH6.8)配制α-葡萄糖苷酶液(0.04 U/mL)及底物PNPG 溶液(0.5 mmol/L)。取 40 μL 酶液和 40 μL 樣品于試管中,37 ℃水浴 5 min,加入 20 μL PNPG 底物溶液,將反應體系置于 37 ℃水浴 30 min 后加入 50 μL Na2CO3溶液(0.2 mol/L)終止反應,室溫(25 ℃)5 min 后采用酶標儀于405 nm 處測定吸光值A。同時設置空白組、空白對照組、樣品背景對照組。阿卡波糖作為陽性對照。根據上述反應程序及表1 中不同組別的反應體系,分別加入相應試劑進行反應。每個樣品設置3 個重復,計算抑制率。
抑制率/%=[1-(A1-A2)/(A3-A0)]×100
式中:A3為空白組吸光值;A0為空白對照組吸光值;A1為樣品作用組吸光值;A2為背景對照組吸光值。
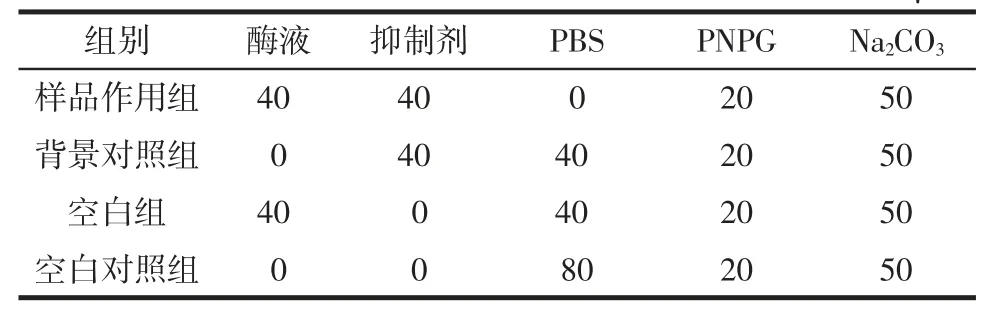
表1 α-葡萄糖苷酶活性抑制試驗反應體系Table 1 Reaction system of inhibition activity against αglucosidase μL
1.3.4 對α-葡萄糖苷酶抑制作用的動力學試驗
動力學試驗參照文獻[12]中的方法進行,并稍作修改。固定底物PNPG 的濃度(0.5 mmol/L),改變α-葡萄糖苷酶的濃度(0、0.04、0.08、0.12、0.16、0.20 U/mL),添加不同濃度的檳榔提取物,其中檳榔殼及檳榔花提取物的作用濃度為0、2、4、6 mg/mL,檳榔籽提取物的作用濃度為 0、1、2、3 μg/mL,采用酶標儀 405 nm 處測定反應體系的吸光值,并計算酶反應速率V(△A/min)。根據酶反應速率與酶濃度之間的變化關系作圖,判斷其抑制類型是否可逆。
固定α-葡萄糖苷酶濃度(0.04 U/mL),改變抑制劑濃度(檳榔殼提取物濃度0、2、4 mg/mL,檳榔籽提取物的作用濃度為0、2、3 μg/mL,檳榔花提取物濃度為0、4、6 mg/mL),改變底物 PNPG 的濃度(0.5、1、1.5、2、2.5、3、5 mmol/L),測定其反應體系的反應速率 V,以(1/V)為縱坐標,以反應時間的倒數(1/[S])為橫坐標,繪制Lineweaver-Burk 雙倒數曲線,確定不同檳榔提取物對α-葡萄糖苷酶活性的可逆抑制類型。
1.3.5 數據分析
所有試驗數據均為3 次平行試驗,測試結果以均值±標準差來表示。采用SPSS 17.0 軟件進行IC50的計算及統計分析,P<0.05 表示差異顯著。
2 結果與分析
2.1 檳榔提取物中多酚及多糖含量分析
檳榔提取物中多酚、多糖的含量見表2。
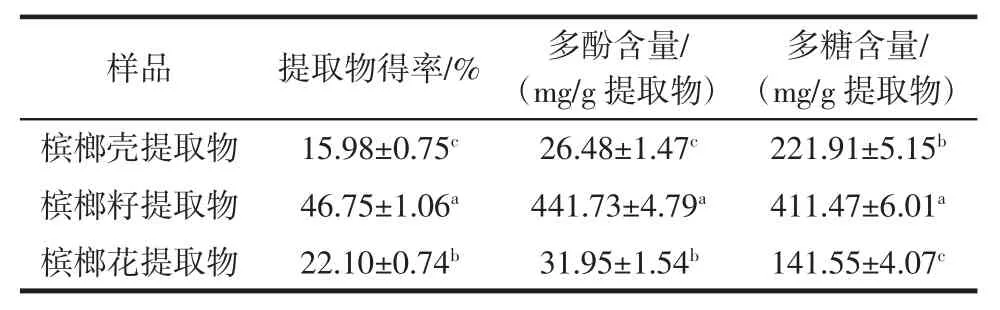
表2 檳榔提取物中多酚、多糖的含量Table 2 Content of polyphenols and polysaccharides in areca nut extracts
由表2 可知,檳榔殼、檳榔籽和檳榔花提取物的得率分別為(15.98±0.75)%、(46.75±1.06)%和(22.10±0.74)%,其中檳榔籽提取物得率最高。檳榔籽提取物中多酚和多糖的含量分別為(441.73±4.79)mg/g 和(411.47±6.01)mg/g,也比檳榔花及檳榔殼提取物的含量高。大量文獻報道多酚類物質、多糖類物質具有α-葡萄糖苷酶活性抑制作用[13-16]。
2.2 檳榔提取物對α-葡萄糖苷酶活性的抑制作用
檳榔提取物對α-葡萄糖苷酶活性的抑制作用見圖1~圖3。
由圖2 和圖3 可知,檳榔殼、檳榔籽和檳榔花對α-葡萄糖苷酶的活性均具有抑制作用,且呈濃度依賴性。檳榔籽提取物對α-葡萄糖苷酶活性具有較強的抑制作用,隨著檳榔籽提取物質量濃度的增加,抑制率也逐漸增加,在試驗濃度范圍內,檳榔籽提取物對α-葡萄糖苷酶活性的抑制率高達(96.82±0.19)%,遠遠高于阿卡波糖對α-葡萄糖苷酶的抑制作用(圖1),兩者的IC50值分別為(1.50±0.31)μg/mL 和(0.71±0.09)mg/mL。檳榔殼和檳榔花提取物對α-葡萄糖苷酶的IC50值分別為(2.87±0.48)mg/mL 和(4.00±0.53)mg/mL,效果均弱于阿卡波糖。但比文獻報道的黑茶多酚提取物[17](IC50為4.190 mg/mL)、蛹蟲草多糖[18](IC50為4.22 mg/mL)等活性要好。
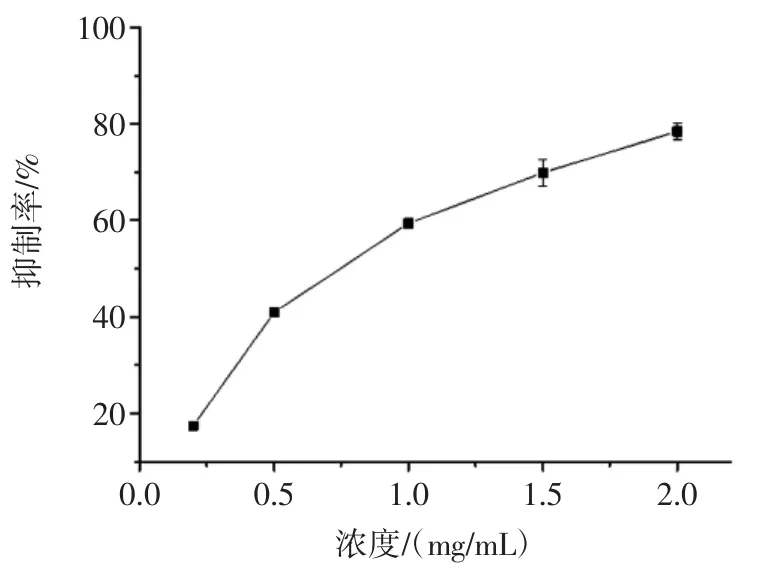
圖1 陽性對照阿卡波糖對α-葡萄糖苷酶活性的抑制作用Fig.1 Inhibitory effect of acarbose(positive control)on the activity of α-glucosidase
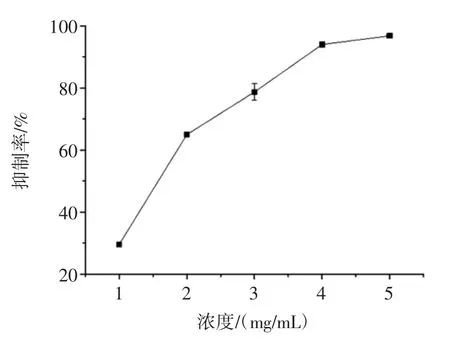
圖2 檳榔籽提取物對α-葡萄糖苷酶活性的抑制作用Fig.2 Inhibitory effect of areca seed extract on the activity of αglucosidase
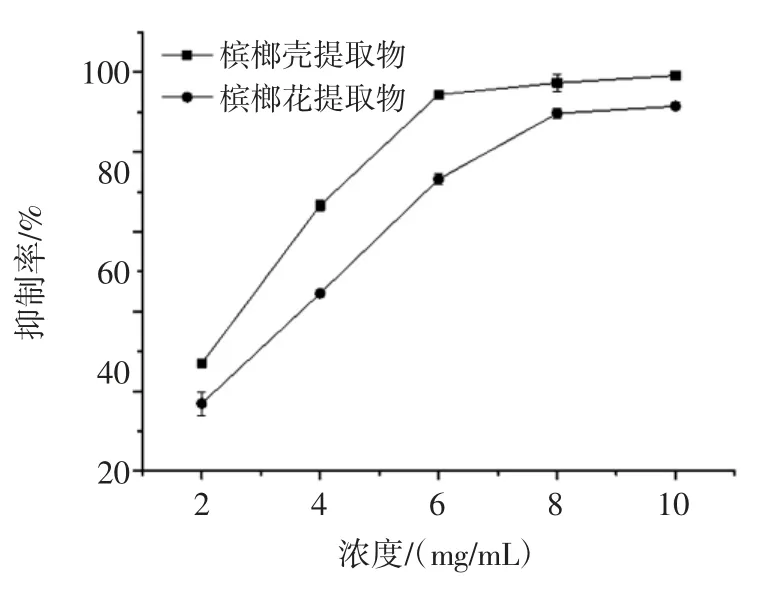
圖3 檳榔殼、檳榔花提取物對α-葡萄糖苷酶活性的抑制作用Fig.3 Inhibitory effect of areca husk and areca flower extracts on the activity of α-glucosidase
2.3 檳榔提取物對α-葡萄糖苷酶活性的抑制作用類型
根據酶與抑制劑結合的特點,抑制類型可分為可逆抑制與不可逆抑制。當反應體系中有可逆抑制劑存在時,得到的直線通過原點,但斜率小于無抑制劑時的直線斜率,當體系中存在不可逆抑制劑時,得到的直線不通過原點[19]。檳榔提取物對α-葡萄糖苷酶的抑制動力學曲線見圖4~圖6。
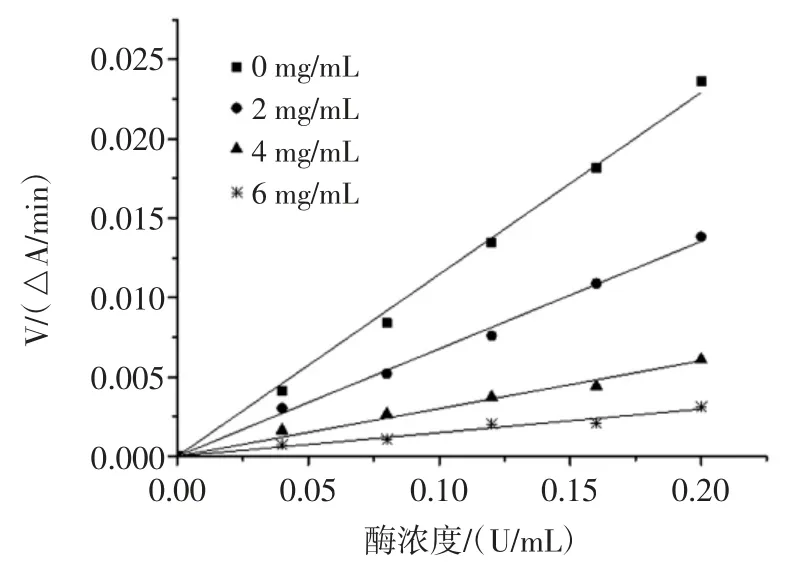
圖4 檳榔殼提取物對α-葡萄糖苷酶的抑制動力學曲線Fig.4 Kinetics curves of inhibition on α-glucosidase of areca husk extract
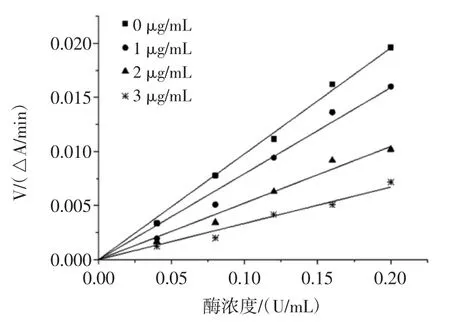
圖5 檳榔籽提取物對α-葡萄糖苷酶的抑制動力學曲線Fig.5 Kinetics curves of inhibition on α-glucosidase of areca seed extract
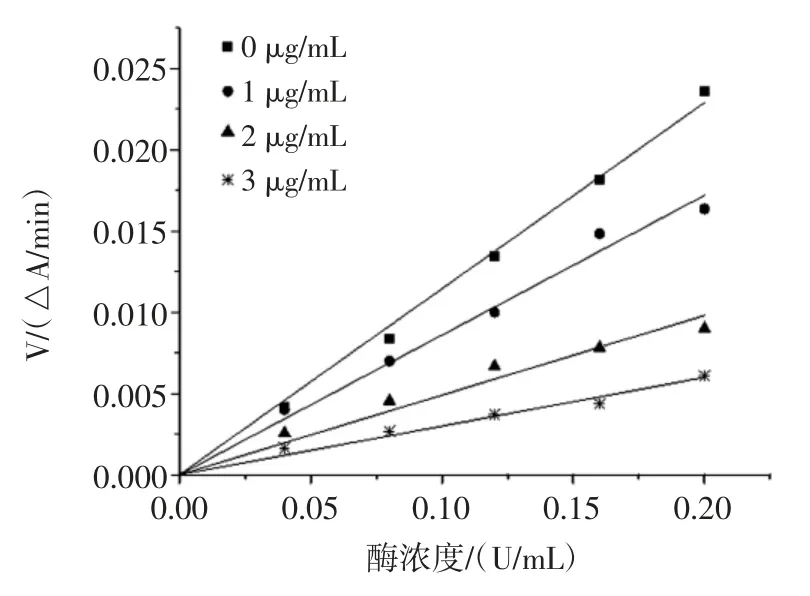
圖6 檳榔花提取物對α-葡萄糖苷酶的抑制動力學曲線Fig.6 Kinetics curves of inhibition on α-glucosidase of areca flower extract
由圖4、圖5 和圖6 可知,酶濃度與反應速率的直線均通過原點,因此,檳榔殼、檳榔籽和檳榔花提取物對α-葡萄糖苷酶活性的抑制作用類型均為可逆抑制。
2.4 檳榔提取物對α-葡萄糖苷酶活性的可逆抑制作用類型
可逆性抑制類型一般分為4 種類型[20],分別為競爭性抑制、非競爭性抑制、反競爭性抑制和混合型抑制。混合型抑制又包括競爭與非競爭的混合型、競爭與反競爭的混合型2 種。固定α-葡萄糖苷酶濃度,改變反應體系中提取物和PNPG 的濃度,測定體系反應速率,繪出Lineweaver-Burk 雙倒數曲線,見圖7、圖8和圖9。根據雙倒數圖,可計算有無提取物樣品時的反應體系的米氏常數Km 和最大反應速率Vmax,通過比較兩者的變化,即可推斷出可逆抑制類型。檳榔提取物對α-葡萄糖苷酶的抑制動力學參數見表3。
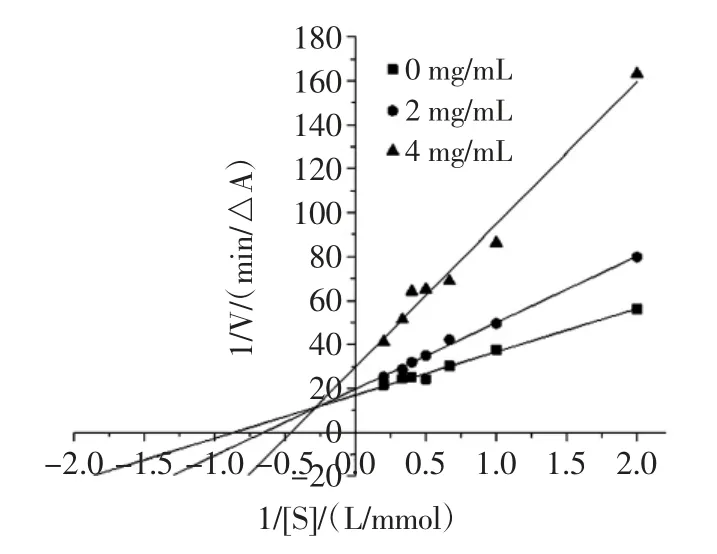
圖7 檳榔殼提取物對α-葡萄糖苷酶抑制作用的Lineweaver-Burk 曲線Fig.7 Lineweaver-burk curve of areca husk extract for inhibiting α-glucosidase
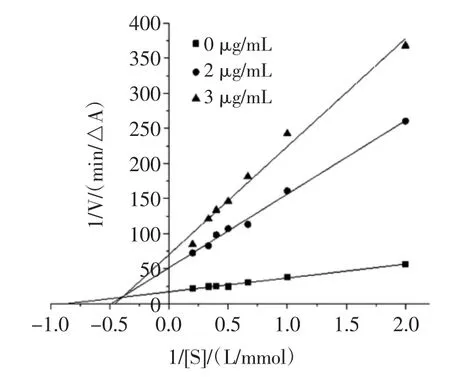
圖8 檳榔籽提取物對α-葡萄糖苷酶抑制作用的Lineweaver-Burk 曲線Fig.8 Lineweaver-burk curve of areca seed extract for inhibiting α-glucosidase
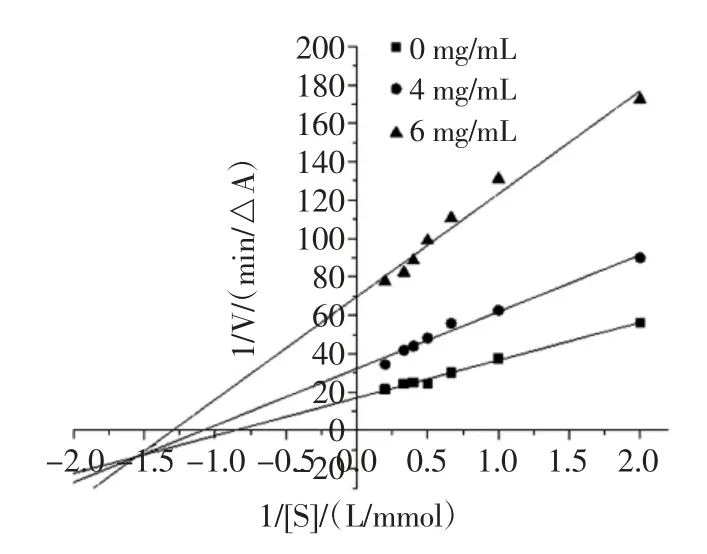
圖9 檳榔花提取物對α-葡萄糖苷酶抑制作用的Lineweaver-Burk 曲線Fig.9 Lineweaver-burk curve of areca flower extract for inhibiting α-glucosidase
由圖7 和圖8 可看出,體系中存在不同濃度檳榔殼及檳榔籽提取物時,各直線與空白組相交于第二象限,隨著抑制劑濃度的增大,米氏常數Km 逐漸升高,而最大反應速率Vmax逐漸降低(表3),這種現象屬于競爭與非競爭的混合型抑制的特點[20],因此檳榔殼和檳榔籽提取物對酶活性的抑制作用屬于競爭與非競爭的混合型抑制類型。由圖9 可知,體系中存在不同濃度檳榔花提取物時,各直線與空白組相交于第三象限,隨著抑制劑濃度的增大,米氏常數Km逐漸降低,最大反應速率Vmax也逐漸降低(表3),這種現象屬于競爭與反競爭的混合型抑制的特點[20],因此,檳榔花提取物對酶活性的抑制作用屬于競爭與反競爭的混合型抑制類型。檳榔殼、檳榔籽與檳榔花提取物對α-葡萄糖苷酶的抑制類型不同,說明其與酶的結合位點不同。
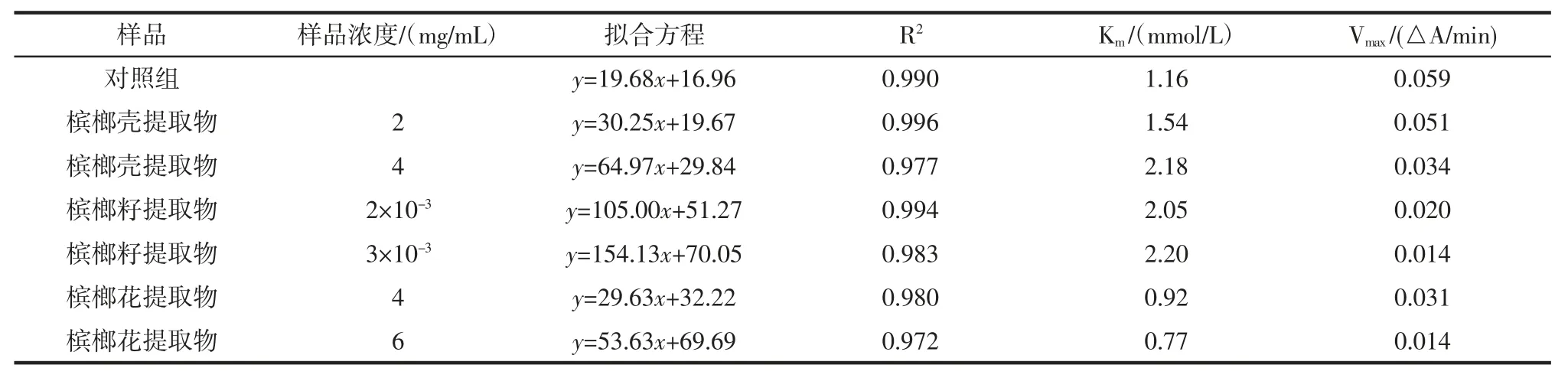
表3 檳榔提取物對α-葡萄糖苷酶的抑制動力學參數Table 3 Kinetic parameters of inhibition of α-glucosidase by areca nut extract
試驗結果同文獻中巖藻黃素[21]、焦棓酸[22]、老鷹茶乙醇提取物[23]等對α-葡萄糖苷酶的抑制類型一致,均為混合型抑制。與芡種皮多酚[12](競爭性抑制)、綠茶多酚[24]和紅松松球鱗片多酚[19](非競爭性抑制)抑制類型有所不同。
3 結論
本研究對不同檳榔提取物進行了體外抑制α-葡萄糖苷酶活性的研究,試驗結果證明,檳榔殼、檳榔籽和檳榔花提取物均具有較好的α-葡萄糖苷酶活性抑制作用,其中檳榔籽提取物對酶活性的抑制作用遠遠高于陽性對照阿卡波糖。通過動力學試驗發現,檳榔殼及檳榔籽提取物對酶活性的抑制作用類型為競爭與非競爭的混合型抑制,而檳榔花提取物對酶活性的抑制作用類型為競爭與反競爭的混合型抑制。
本研究結果表明,檳榔提取物在開發成輔助降血糖的保健食品或藥品方面具有良好的潛力,但檳榔提取物中成分復雜,發揮功效作用的主要是多酚還是多糖,主要單體成分是什么,下一步將進行研究,同時對其在體內的作用機制做進一步深入的研究。本研究對于提高檳榔產品的附加值和檳榔資源的高效利用具有重要意義。

