基于G-四鏈體-氯化血紅素DNA酶比色法測定銀離子和汞離子傳感器的構筑
肖志友,司恒丹,鄧蘭清,龍 麗,居榮梅,張 鑫,劉益飛
(貴州理工學院 化學工程學院,貴州 貴陽 550003)
銀離子在制藥、化工、制鏡、電子工業中有較多應用[1],其對人體的潛在危害逐漸受到人們的重視,如導致人體巰基酶失活,引起肝腎損害,結合代謝分子中氨基、羰基等[2-6]。汞離子是公認的高毒性重金屬離子,其通過火電廠煤燃燒、金礦開采、化石燃料燃燒、固體廢棄物焚燒等途徑進入人類生存的環境中,并能在人體細胞中累積,從而對人體心臟、腎臟、免疫系統、中樞神經系統等產生損害[5,7-9]。因此,建立簡單、靈敏、高選擇性測定銀離子和汞離子的方法具有重要意義。
G-四鏈體-氯化血紅素DNA酶是一種由富含鳥嘌呤堿基G的DNA序列與氯化血紅素(Hemin)結合而形成的具有類似過氧化物酶活性的人工模擬酶[10],該DNA酶能高效催化H2O2氧化反應底物(如2,2′-聯氮-二(3-乙基苯并噻唑-6-磺酸)二銨鹽,ABTS)產生明顯的顏色變化,利用金屬離子能促進或阻礙G-四鏈體-Hemin DNA酶的形成,導致溶液顏色發生改變。相關比色法測定金屬離子的傳感器已有很多報道,在銀離子傳感器方面,Li和Kong等[11- 12]利用Ag+通過C-Ag+-C配位鍵促進G-四鏈體-Hemin DNA酶的形成建立了比色法測定銀離子的傳感器,Zhou等[13]利用Ag+與鳥嘌呤堿基G結合阻礙G-四鏈體-Hemin DNA酶的形成構筑了比色法測定銀離子的傳感器;在汞離子傳感器方面,Lu和Kong等[14-16]利用Hg2+形成T- Hg2+-T配位鍵抑制或促進該DNA酶的形成,從而建立了比色法定量檢測汞離子的傳感器。上述傳感器雖具有較好的靈敏度和選擇性,但僅限于單獨測定銀離子或汞離子,未見同時對銀離子和汞離子產生響應的G-四鏈體-Hemin DNA酶傳感器報道。本研究中,筆者通過選擇合適的G-四鏈體DNA傳感序列,利用Ag+和Hg2+阻礙G-四鏈體-Hemin DNA酶形成,建立了比色法同時測定銀離子和汞離子的傳感器。
1 實驗部分
1.1 儀器與試劑
PE-lambda 35紫外可見分光光度計(珀金埃爾默公司),Chirascan圓二色譜儀(英國應用光物理公司),pHS-3C pH計(上海雷磁儀器廠)。
硝酸銀、氯化汞、氯化血紅素(Hemin)、硝酸鈉、硝酸鉀、二甲亞砜(DMSO)(上海國藥集團化學試劑有限公司);2,2′-聯氮-二(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(ABTS)、磷酸氫二鈉、磷酸二氫鈉(上海生工生物工程有限公司);30%過氧化氫(成都金山化學試劑有限公司);以上試劑均為分析純。G-四鏈體序列(EAD2,5′-CTGGGAGGGAGGGAGGGA-3′)及富含胞嘧啶堿基C的DNA序列購于上海生工生物工程有限公司。
顯色工作緩沖液(自制含20.0 mmol/L KNO3、200.0 mmol/L NaNO3、3.0 mmol/L ABTS、20 mmol/L pH 7.5的PBS緩沖溶液);5 mmol/L Hemin儲備液用DMSO配制于冰箱-20 ℃保存,使用時用DMSO進一步稀釋為Hemin工作液;實驗用水均為二次蒸餾水。
1.2 紫外可見吸收光譜及吸光度的測定
室溫25 ℃下,在總體積為50.0 μL pH 7.5的20 mmol/L PBS緩沖溶液(含20.0 mmol/L KNO3、100.0 nmol/L EAD2、200.0 mmol/L NaNO3)中,加入不同濃度Ag+保留30 min后,加入100.0 nmol/L Hemin保留25 min。取前述混合溶液5.0 μL于500 μL離心管中,加入490.0 μL顯色工作緩沖液、5.0 μL 30 mmol/L H2O2溶液,搖勻,顯色25 min。采用PE-lambda 35紫外可見分光光度計掃描溶液在390~450 nm波長范圍內的紫外可見吸收光譜,或測其在422 nm波長處的吸光度(A)。
1.3 圓二色光譜的測定
在體積為1 000 μL pH 7.5的20 mmol/L PBS(含20 mmol/L KAc、200 mmol/L NaAc)緩沖溶液中,第1組樣品加入3 μmol/L EAD2保留30 min,第2組樣品加入3 μmol/L EAD2及52 μmol/L Ag+或Hg2+保留30 min,第3組樣品在第1組和第2組樣品基礎上分別加入6 μmol/L Hemin保留25 min。所有樣品溶液使用光徑為1.0 mm的石英樣品池在Chirascan圓二色譜儀上進行測定。測定參數:掃描速率100 nm/min,帶寬1.0 nm,響應時間0.5 s,步長1 nm,掃描次數3次。
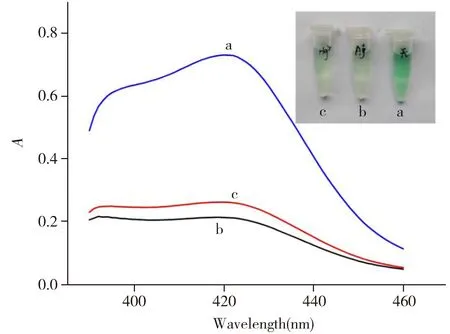
圖1 G-四鏈體DNA酶顯色溶液不含銀離子與汞離子(a)以及含1 000.0 nmol/L銀離子(b)、1 000.0 nmol/L汞離子(c)的紫外可見吸收光譜和顏色變化Fig.1 UV-Vis absorption spectra and color change of the chromogenic solution of G-quadruplex-hemin DNAzymes in the absence of silver ion and mercury ion(a) ,and in the presence of 1 000.0 nmol/L silver ion(b) and 1 000.0 nmol/L mercury ion(c)
2 結果與討論
2.1 實驗的可行性分析
從文獻報道[17]的G-四鏈體DNA序列中,本文選擇具有較高過氧化物酶活性的G-四鏈體DNA序列(EAD2,5′-CTGGGAGGGAGGGAGGGA-3′)作為識別銀離子和汞離子的傳感器序列。為了檢驗該方法的可行性,實驗對G-四鏈體DNA酶顯色溶液加入金屬離子前后顏色的變化及掃描的紫外可見吸收光譜進行了比較。圖1a為加金屬離子前顯色溶液的紫外可見吸收光譜,可觀察到在422 nm處有1個很強的吸收峰,對應溶液為綠色;而圖1b、c分別為加入1 000.0 nmol/L銀、汞離子后顯色溶液的紫外可見吸收光譜,可觀察到422 nm處吸收峰的強度均明顯降低,且溶液基本變為無色,說明該方法可用于比色法測定銀、汞離子。
為了進一步考察G-四鏈體DNA測定金屬離子的作用機理,采用圓二色譜對有無金屬離子的EAD2溶液進行了研究。如圖2所示,無金屬離子的G-四鏈體溶液在263 nm處有1個明顯的正圓二色峰,這是形成平行G-四鏈體結構的典型特征[18-19]。當溶液中加入銀離子后(圖2A),260 nm處的色譜峰明顯減弱,表明銀離子可能與鳥嘌呤堿基G螯合而阻礙了G-四鏈體結構的形成[13];加入汞離子后(圖2B),該色譜峰同樣明顯減弱,表明汞離子可能通過非T-Hg2+-T配位作用破壞G-四鏈體結構的形成[19]。存在Hemin溶液的圓二色譜變化類似,說明Hemin對銀離子或汞離子與G-四鏈體相互作用的影響不大。
2.2 實驗條件的優化
G-四鏈體-Hemin DNA酶顯色溶液的吸光度受多種因素影響,為了獲得加入相同量金屬離子產生的最大吸光度變化值ΔA[ΔA=A(無Ag+)-A(有Ag+)],本文對影響顯色溶液吸光度的實驗條件進行了優化。


圖3 溶液pH值對體系吸光度的影響Fig.3 Effect of solution pH value on absorbance of the systeminsert:plot of absorbance of the system with or without Ag+ vs.pH value
2.2.1 溶液pH值的影響由于溶液的pH值會影響G-四鏈體結構的形成及顯色溶液的吸光度大小,本實驗對溶液的pH值進行了優化。如圖3所示,雖然pH 7.0時G-四鏈體-Hemin DNA酶顯色溶液的吸光度變化值(ΔA)最大,但從插圖可以看出,此時加入銀離子溶液的吸光度約0.5,溶液仍略顯綠色;而當pH為7.5時,存在同樣量的銀離子,溶液的吸光度約為0.2,接近無色。因此,本實驗選擇pH 7.5為緩沖溶液的最佳pH值。
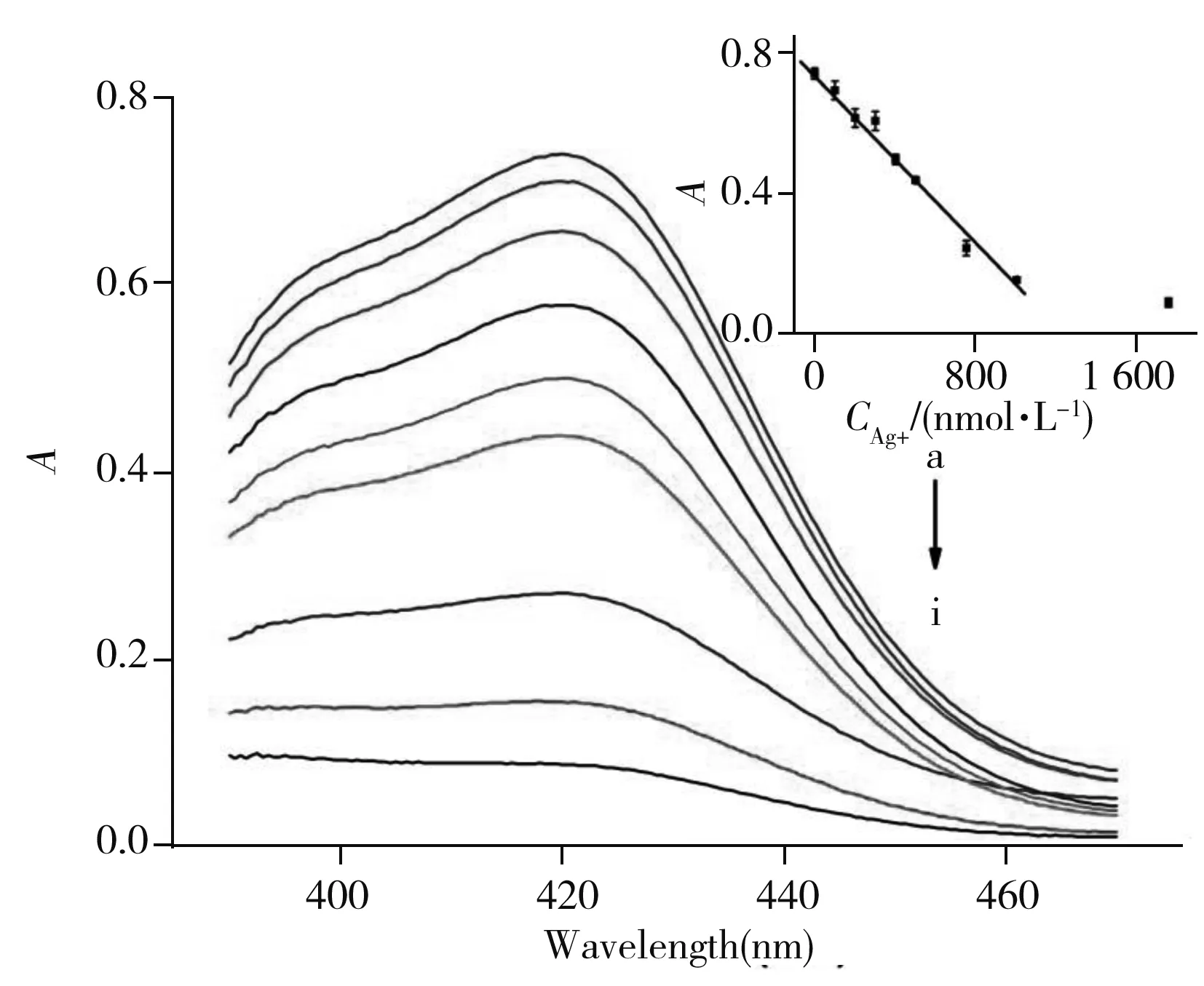
圖4 不同濃度Ag+存在下顯色溶液的紫外可見吸收光譜Fig.4 UV-Vis absorption spectra of the color solution in the presence of different concentrations of Ag+concentration of Ag+(a-i):0.0,100.0,200.0,300.0,400.0,500.0,750.0,1 000.0,1 750.0 nmol/L;insert:the plot of the assay
2.2.2 保留時間的影響金屬離子與G-四鏈體DNA作用時間的長短會影響DNA酶的形成,從而影響顯色溶液吸光度的大小,因此,實驗對加銀離子混合后的保留時間進行了優化。結果顯示,加Ag+后保留時間大于30 min時,體系的吸光度變化值ΔA不再增加。因此,本實驗選擇30 min作為金屬離子與G-四鏈體DNA的最佳保留時間。
2.2.3 硝酸鈉濃度的影響硝酸鈉濃度會影響EAD2折疊為G-四鏈體結構及DNA酶的形成,從而對顯色溶液的吸光度產生影響,本實驗對NaNO3濃度進行了優化。結果顯示,隨著NaNO3濃度的增加,加入相同量Ag+引起的吸光度變化值(ΔA)增加,當濃度達到200.0 mmol/L時,ΔA最大,繼續增大NaNO3濃度,ΔA反而降低。因此,本實驗選擇NaNO3的最佳濃度為200.0 mmol/L。
2.3 線性范圍與檢出限
在最佳實驗條件下,考察了加入不同濃度銀離子和汞離子時,顯色溶液在422 nm處吸光度的變化(圖4)。結果顯示,溶液的吸光度值(A)與銀離子濃度(C,nmol/L)在100.0 ~1 000.0 nmol/L范圍內呈良好線性關系(圖4插圖),線性方程為:A=- 6.272×10-4C+0.755 3,相關系數(r)為0.991 8,檢出限(3δ/Slope)為55.9 nmol/L。同樣考察了不同濃度汞離子對溶液在422 nm處吸光度的變化情況。結果顯示,溶液的吸光度值與汞離子濃度在80.0~800.0 nmol/L范圍內呈良好的線性關系,線性方程為:A=- 5.459×10-4C+0.713 1,相關系數(r)為0.992 6,檢出限(3δ/Slope)為64.3 nmol/L。

圖5 方法的選擇性Fig.5 Selectivity of the assay
2.4 方法的選擇性
為了考察該方法的選擇性,本實驗對1 000.0 nmol/L銀離子、汞離子及10 種常見其他金屬離子(Ba2+、Pb2+、Mg2+、Mn2+、Co2+、Fe3+、Al3+、Zn2+、Cu2+、Ni2+)與G-四鏈體DNA作用后的溶液在422 nm的吸光度值進行對比。如圖5所示,只有銀離子和汞離子存在會導致溶液的吸光度明顯降低,其他10種常見金屬離子對溶液的吸光度幾乎無影響。其中汞離子對銀離子的測定干擾可通過加入EDTA消除,而銀離子對汞離子的測定干擾可通過加入富含胞嘧啶堿基C的DNA(5′-CCACCACCACACACCACCACC-3′)消除。該方法具有較好的選擇性,既可用于銀離子的測定也可用于汞離子的測定。
2.5 水樣中銀離子和汞離子的測定
在最佳實驗條件下,采用該方法對貴陽市蔡家關雅河河水中的銀離子和汞離子含量進行測定,均未檢出,進一步進行不同濃度(200.0、750.0 nmol/L)銀離子和汞離子的加標回收實驗,測定結果見表1。樣品的加標回收率為94.8%~99.7%,相對標準偏差(RSD)為2.9%~5.0%。說明該方法用于銀離子和汞離子測定具有較好的精密度和重現性,可用于實際樣品的測定。

表1 水樣中銀離子和汞離子的測定Table 1 Determination of Ag+ and Hg2+ in water samples (n=6)
*no data
3 結 論
本文基于G-四鏈體(5′-CTGGGAGGGAGGGAGGGA-3′)與氯化血紅素(Hemin)結合形成G-四鏈體-Hemin DNA酶后,能高效催化H2O2氧化反應底物(ABTS)使得溶液由無色變綠色,當溶液中存在Ag+或Hg2+時會阻礙該DNA酶的形成,溶液綠色變淺,從而構筑了比色法測定Ag+和Hg2+的傳感器。在最佳實驗條件下,溶液的吸光度與Ag+和Hg2+的濃度分別在100.0~1 000.0 nmol/L和80.0~800.0 nmol/L范圍內具有良好的線性關系,檢出限分別為55.9 nmol/L和64.3 nmol/L。該方法具有較好的選擇性,采用該方法對實際樣品進行測試,結果令人滿意。

