宮頸HSIL行錐切術后病灶殘留的高危因素及子宮切除時機探討
王三鋒 胡 克 鐘沅月 麥 碧 何 裕 張 煦 黎玉涵
(廣東省婦幼保健院婦科,廣東 廣州 511400)
宮頸癌是婦科常見惡性腫瘤之一,隨著宮頸癌篩查普及,臨床中癌前病變的發現大幅增加。宮頸癌前病變傳統病理命名是宮頸上皮內瘤變三級(CINⅠ、Ⅱ、Ⅲ),2012年ASSCP提出用兩級分類法代替三級分類法來命名宮頸癌前病變,即低級別鱗狀上皮內病變(lowgrade squamous intraepithelial lesion,LSIL)和高級別鱗狀上皮內病變(high-grade squamous intraepithelial lesion,HSIL)[1],兩級分類法彌補了以前三級分類法的不足[2]。宮頸LSIL約90%可自然消退,無需治療,隨診即可;宮頸HSIL進展為宮頸癌的風險有20%左右,應積極治療。宮頸錐切是宮頸HSIL有效治療手段,錐切術后病變有殘留風險,影響因素有爭議;子宮切除術是宮頸HSIL的選擇之一,手術選擇時機也有一定爭議[3-4]。本研究選擇廣東省婦幼保健院2015年1月至2017年12月因宮頸HSIL行切除子宮者作為研究對象,探討宮頸HSIL宮頸錐切術后病變殘留的危險因素及子宮切除術的手術時機。
1 資料與方法
1.1 一般資料:選取2015年1月至2017年12月在廣東省婦幼保健院就診的宮頸HSIL患者,根據宮頸癌前病變三階梯原則診治。納入標準:①患者有性生活,無生育要求;②患者無嚴重內外科合并癥;③患者及家屬有切除子宮的強烈意愿;④患者能按要求定期隨訪;⑤患者無腹腔鏡手術禁忌證;⑥患者診療過程均為經培訓合格的宮頸病變專業組醫師診治。
1.2 診治流程:患者均按診療規范行宮頸癌篩查,有嚴格陰道鏡指征,陰道鏡檢查病理活檢提示宮頸HSIL;再按規范行宮頸錐切術(均為宮頸LEEP術),術后常規石蠟病理學結果提示仍為宮頸HSIL,除外癌;根據患者意愿行腹腔鏡下筋膜外子宮切除術;術后半年、1年各隨訪一次,行陰道殘端液基細胞學檢查(TCT)及高危型HPV 檢測(HR-HPV)。
1.3 觀察指標:收集患者年齡、術前HR-HPV類型、陰道鏡下宮頸轉化區類型、宮頸錐切病理結果、宮頸錐切后切緣病理情況(切緣陽性、切緣陰性)、頸管補切病理情況、子宮切除術后病理結果(病灶殘存有,無)。子宮切除術后患者均6個月、12個月隨訪,隨訪內容包括TCT、HR-HPV檢測。
1.4 病理學判定:所有組織病理均經兩個以上高級職稱病理科醫師評估。宮頸錐切切緣陽性指宮頸錐切術后切緣可見病變或切緣與病變距離<1 mm[5]。宮頸管補切組織有HSIL病變為宮頸補切陽性,沒有病變為陰性。病變殘留指子宮切除術后殘存宮頸組織仍有HSIL及以上病變。宮頸癌分期按FIGO2009年分期標準。
1.5 HR-HPV檢測方法:選擇廣東凱普生物科技股份有限公司HPV 分型檢測試劑盒,檢測14 種高危型別:HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68。
1.6 統計學處理:采用SPSS23.0軟件進行統計分析,所有統計檢驗為雙側檢驗。計數資料以絕對數和百分數(%)表示,采用卡方檢驗或Fisher 精確概率法進行組間比較。影響病灶殘留因素納入logistic多因素分析回歸模型計算相關風險因素。P<0.05為差異有統計學意義。
2 結 果
2.1 一般資料:107例患者年齡30~71歲,中位年齡49歲,平均年齡(49.18±7.01)歲;<40歲7例,40歲以上100例。術后病灶殘留率為41.12%(44/107),其中癌3例,均為IA1期(癌中切緣陽性2例,切緣陰性1例),宮頸錐切術術后病理升級率為2.8%。
2.2 宮頸錐切術后切緣狀態與病灶殘留關系:107例患者中,按宮頸術后切緣狀態分為切緣陽性組(64例),切緣陰性組(43例),兩組病變殘留率分別為50%、27.91%,二者差異有統計學意義(χ2=4.3127,P=0.0378)。見表1。

表1 子宮切除術術前切緣狀態與術后病變殘留率(%)
2.3 宮頸HSIL錐切術后病變殘留影響因素:對107例患者年齡、術前HR-HPV類型、陰道鏡轉化區類型、切緣狀態、宮頸管補切狀態對宮頸HSIL錐切術后病變殘留影響行多因素分析顯示:切緣狀態對病變殘留的影響有統計學意義(P=0.039),切緣陽性增加病變殘留風險,OR=2.469(95%CI 1.05~5.83)。年齡、術前HR-HPV類型、轉化區類型、宮頸管補切狀態對病變殘留影響無統計學意義,不是高危因素。見表2。
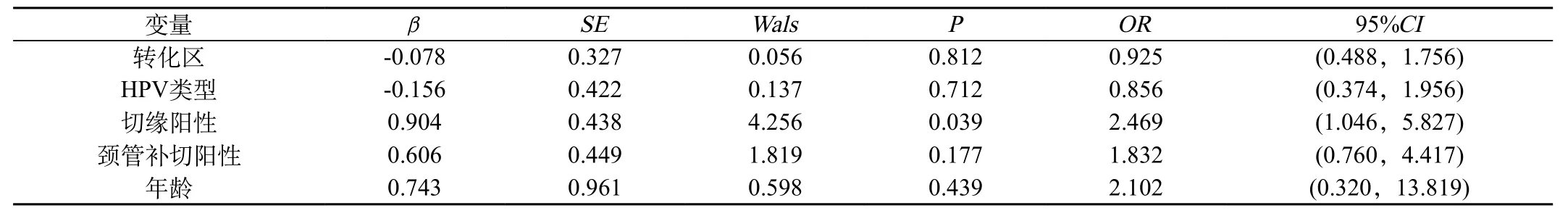
表2 宮頸HSIL錐切術后病變殘留多因素分析
2.4 子宮切除術后HPV轉陰情況:107例患者術后半年HPV轉陰率為81.31%(87/107),1年HPV消除率為83.18%(89/107),半年和1年轉陰率差異無統計學意義(χ2=0.1280,P=0.7205)。見表3。按子宮切除前切緣狀態分為切緣陽性組、切緣陰性組;切緣陽性組、切緣陰性組術后半年轉陰率分為79.69%、83.72%,兩組間差異無統計學意義(χ2=0.2753,P=0.5998);切緣陽性組、切緣陰性組術后1年轉陰率分為82.81%、83.72%,兩組間差異無統計學意義(χ2=0.0152,P=0.9020)。見表4。

表3 HPV轉陰率與子宮切除術后時間關系(%)

表4 錐切術后切緣狀況、HPV類型與HPV轉陰率(%)
3 討 論
宮頸HSIL由于病變的多中心性,手術后病變殘留的風險增加。本研究顯示宮頸錐切術后病變殘留率為41.12%;國內學者對宮頸錐切術后病變殘留率的報道不一致,可能與研究方法有關。劉莉等[6]報道1502例宮頸HSIL錐切術后半年殘留率為3.2%,該研究均未行子宮切除術,僅以宮頸細胞學結果來判定殘留,假陰性較高。文獻報道宮頸HSIL子宮切除術后發現錐切術后病灶殘留率為32.5%~50.12%[7-8],與本研究基本一致。子宮切除術后判定病變殘留是組織學證據,更準確,但缺點是樣本量均較少。對于錐切術后病變殘留的影響因素,文獻報道也有不一致。蘇曉玲等[9]研究顯示:絕經年限是病變殘留危險因素,切緣陽性、HPV感染對病變殘留的影響無統計學意義;但其他研究均顯示切緣陽性是病變殘留獨立危險因素[10-12];本研究也顯示切緣陽性對病變殘存有明確影響,是獨立危險因素。曹倩文等[13]報道高齡是病變殘留危險因素,本研究提示年齡對病變殘留無明顯影響。
高危型HPV感染是宮頸癌前病變的主要原因,因此宮頸HSIL通過錐切切除病灶來消除HPV。宮頸HSIL去除病灶后HPV轉陰時間及影響因素文獻報道也無定論。學者張晶等[14]報道宮頸HSIL行宮頸錐切后,術后3~12個月內行第1次復查,HPV轉陰率為85.5%;張忠明等[15]報道宮頸錐切術后半年HPV轉陰率為86.17%;本研究顯示宮頸HSIL子宮切除術后半年、1年HPV消除率為81.31%、83.18%;可以看出宮頸錐切術和子宮切除術1年內HPV轉陰率無明確差異。本研究提示切緣陽性和切緣陰性的錐切患者切除子宮后HPV轉陰率差異無統計學意義,切緣狀態視乎對HPV消除率無影響;王依妮等[16]報道影響宮頸錐切術后HPV轉陰的因素不明確,與切緣、年齡、錐切方式、病理類型、孕產次均無明顯相關性。有研究指出HPV持續陽性,是病變復發的高危因素[17-19],因此對于在宮頸HSIL的治療中HPV轉陰消除致關重要,HRHPV的檢測在宮頸HSIL管理中顯得極為重要。
子宮切除術是宮頸HSIL的可選擇治療方法,臨床中子宮切除的時機選擇有差異;部分選擇陰道鏡活檢后直切子宮切除,部分選擇宮頸錐切同時行快速冰凍病理檢查后行子宮切除,也有選擇宮頸錐切術后等待常規石蠟病理結果后手術;手術時機的選擇差異可能造成術后病理升級,漏診癌導致手術范圍不足。蘇曉玲等[9]報道:陰道鏡活檢后直接切除子宮組病理升級率為7.14%,術前行宮頸錐切再切除子宮病理升級率為3.88%;宮頸錐切快速冰凍病理檢查后切除子宮病理升級率為8.16%。郝真等[20]回顧分析宮頸病變高級別病變子宮切除的病理確診時間發現:宮頸錐切術中冰凍病理結果行子宮切除術后病理升級率為11.88%,宮頸錐切后石蠟病理后再子宮切除病理升級率為0.93%。本研究子宮切除是選擇錐切常規病理結果后再手術,結果顯示本研究宮頸錐切術后病理升級率僅為2.8%;明顯低于前面文獻報道的陰道鏡活檢病理升級率,也低于術中快速冰凍病理的升級率。因此宮頸HSIL子宮切除的手術時間應選在宮頸錐切常規石蠟病理結果后,可降低漏診率。
綜上所述,宮頸錐切術后切緣陽性是病變殘留的高危因素,子宮切除應選擇在宮頸錐切術后常規石蠟病理結果后進行。本研究的缺陷在于為回顧性研究,病例數相對較少,今后仍需擴大樣本量、進一步研究。

