組蛋白去乙酰化酶6抑制劑ACY1215對順鉑誘導肝癌細胞SMMC-7721凋亡的影響
邱 教 彭棟柱 勵輝輝 陸靜靜
寧波市北侖區人民醫院消化內科 (浙江 寧波, 315800)
原發性肝癌是世界上主要的惡性腫瘤之一,其中男性肝癌死亡率排世界第二位,女性排第六位[1]。絕大數的原發性肝癌是肝細胞癌(HCC),HCC起病隱匿,發現時已處于中晚期,常常錯過最佳的手術時機,因此化療是主要治療手段之一。化療藥物易出現耐藥,尋求針對肝細胞癌的高效抗腫瘤藥是研究熱點。越來越多研究發現,組蛋白的乙酰化調控與腫瘤的發展密切相關。組蛋白乙酰轉移酶(HATs)和組蛋白去乙酰酶(HDACs)共同調控組蛋白乙酰化的平衡,從而調控染色體的結構和基因的轉錄[2]。有研究發現下調HDAC能夠抑制腫瘤的生長、誘導腫瘤細胞的凋亡[3]。HDAC6是IIb類HDAC主要成員之一,其不同于其他HDACs定位于細胞核,由于存在核輸出序列,HDAC6主要定位在細胞質中[4]。研究報道HDAC6在惡性黑色素瘤和肺癌等腫瘤中的過表達[5,6],因此,抑制HDAC6的表達已成為癌癥治療的一個有吸引力的靶點。本研究探討HDAC6抑制劑ACY1215對順鉑誘導人肝癌細胞系SMMC-7721凋亡的影響。
1 材料和方法
1.1 細胞株及試劑 人肝癌細胞系SMMC-7721細胞株來源于中國科學院上海生物化學和細胞生物學研究所;ACY1215(Rocilinostat)購于美國Selleck Chemicals公司;順鉑(cisplatin, DDP)購于碧云天生物技術研究所;RPMI-1640培養基購于美國HyClone公司;胎牛血清購于澳大利亞NQBB生物有限公司; CCK-8試劑盒購于日本同仁公司;細胞裂解液、上樣緩沖液及BCA試劑盒購于碧云天生物技術研究所;SDS-PAGE凝膠制備試劑盒購于武漢谷歌生物科技公司;蛋白印跡所有一抗:微管蛋白(α-tubulin)、乙酰化微管蛋白(Acetyl-α-tubulin)、Bax、Bcl-2和Cyclin D1均購自美國Cell Signaling Technology公司。
1.2 研究方法
1.2.1 細胞增殖率檢測 SMMC-7721細胞采用含有10%胎牛血清和1%青-鏈霉素的RPMI-1640培養基于37℃、5% CO2培養箱培養,使用0.25%胰蛋白酶消化傳代。收集處于對數生長期的細胞,制備單細胞懸液,按5×103個/孔接種到96孔板,待細胞生長至融合度為60%時加入濃度分別為0、0.01、0.1、1、5、10、20 μmol/L ACY1215或0、0.5、1、2、4、8、16、32 μg/ml DDP刺激,24 h后吸棄孔內培養基,每孔加入CCK-8試劑10 μl,放置于37℃、5% CO2培養箱孵育1 h后檢測各孔 490 nm 波長的吸光度(OD)。設置陰性對照組,每組設3個復孔,計算不同藥物濃度下細胞的增殖率,公式:細胞增殖率=(OD藥物組/OD對照組)×100%。
1.2.2 誘導SMMC-7721細胞凋亡 收集處于對數生長期的SMMC-7721細胞,制備單細胞懸液接種于六孔板,并分為空白組、ACY1215組、DDP組以及DDP+ACY1215組。根據上一步實驗結果分別給予各組細胞適宜濃度的藥物,處理24 h后利用倒置顯微鏡觀察細胞形態學變化。
1.2.3 HDAC6 mRNA表達水平檢測 上述4組細胞經藥物處理24 h,通過Trizol法提取各組細胞總RNA,經逆轉錄試劑盒反轉錄為cDNA后進行熒光實時定量PCR。HDAC6引物序列:正鏈5’-GCCTCAATCACTGAGACCATCC-3’,反鏈5’-GGTGCCTTCTTGGTGACCAACT-3’。內參基因GAPDH引物序列:正鏈5’-GAATGGGGAAGGTGAAGGTCG-3’;反鏈5’-GGGGTCATTGATGGCAACAATA-3’。采用2-ΔΔCT方法計算HDAC6基因的相對表達量。
1.2.4 凋亡相關蛋白表達水平檢測 各組細胞經藥物干預24 h后吸棄培養基,用預冷的PBS緩沖液洗滌3次。六孔板每孔加入100 μl RIPA裂解液、1 μl PMSF、10 μl磷酸酶抑制劑,置于冰上裂解30 min后12 000 rpm離心15 min,上清即為細胞總蛋白溶液。采用BCA試劑盒測定各組細胞總蛋白濃度后進行聚丙烯酰胺凝膠電泳,隨后90 mA恒流電轉印90 min,電轉后采用5%脫脂奶粉/PBS 溶液室溫封閉PVDF膜1 h,然后加入一抗4℃搖床過夜。次日洗膜,并加入相應辣根過氧化物酶標記的二抗孵育1 h,洗膜后加入化學發光試劑顯影、曝光并分析結果。
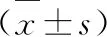
2 結果
2.1 不同濃度藥物對SMMC-7721細胞增殖率的影響 與未加藥組相比,5 μmol/L ACY1215處理24 h后細胞活性為92.67%(t=-2.401,P= 0.074),濃度升高至10 μmol/L后細胞活性為90.13%(t=-3.115,P= 0.036),濃度升高至20 μmol/L時細胞活性降為78.86%(t=-5.718,P= 0.005),故本實驗選擇5 μmol/L ACY1215進行后續細胞實驗。不同濃度DDP分別處理細胞24 h后細胞活性呈濃度依賴性抑制,選擇2 μg/ml DDP進行后續細胞實驗。見圖1。

圖1 不同藥物濃度下SMMC-7721細胞的增殖率
2.2 細胞形態學改變 將SMMC-7721細胞接種于六孔板中,分為空白(control)組、ACY1215(5 μmol/L)組、DDP(2 μg/ml)組以及DDP(2 μg/ml)+ ACY1215(5 μmol/L)組。藥物處理24 h后,空白組細胞呈梭形,緊密生長; ACY1215組細胞生長良好,緊密貼壁; DDP組可見大量漂浮細胞,貼壁細胞數明顯減少;DDP+ ACY1215聯合組相比DDP組,漂浮細胞進一步增多,貼壁細胞數進一步減少。見圖2。

圖2 ACY1215和DDP處理后細胞的形態學改變
2.3 藥物對SMMC-7721細胞HDAC6基因表達的影響 與DDP組相比,藥物處理24 h后,DDP+ACY1215組細胞HDAC6基因表達水平降低(t=6.256,P= 0.003),表明ACY1215可抑制HDAC6的表達。見圖3。

圖3 藥物處理后細胞的HDAC6基因表達水平
2.4 藥物對SMMC-7721細胞凋亡相關蛋白表達的影響 DDP組細胞Ace-α-tub蛋白相對表達量較空白組明顯升高(t=-3.457,P= 0.026),DDP+ACY1215組細胞Ace-α-tub蛋白相對表達水平進一步升高(t=-2.877,P= 0.045)。與空白組相比,DDP組細胞促凋亡蛋白Bax表達明顯增加(t=-3.005,P= 0.04),抑凋亡蛋白Bcl-2及增殖蛋白Cyclin D1明顯降低(t=2.824,P= 0.048;t=3.221,P= 0.032);而與DDP組相比,DDP+ ACY1215組細胞Bax表達進一步增加(t=-6.854,P= 0.002),且Bcl-2和Cyclin D1表達進一步降低(t=4.561,P= 0.01;t=2.772,P= 0.05)。見圖4。

圖4 藥物處理后細胞各蛋白表達水平的改變
3 討論
肝癌早期癥狀不明顯,發現時常常處于中晚期階段,手術切除療效欠佳,而且易出現術后復發,因此化療是治療肝癌的重要手段之一。由于傳統的化療藥物的不良作用及耐藥性問題,因此尋求高效低毒的治療方法是目前的熱點和難點之一。近年來,表觀遺傳學調控和腫瘤發生發展的關系受到廣泛關注,表觀遺傳學修飾的失調與癌癥密切相關,例如腫瘤抑制基因的超甲基化或低乙酰化,可導致抑癌基因的異常表達[7]。正常生理情況下,組蛋白乙酰化和去乙酰化平衡狀態受到組蛋白乙酰化轉移酶(HATs)和組蛋白去乙酰化酶(HDACs)共同調控,HATs可將乙酰輔酶A的乙酰基轉移到組蛋白賴氨酸殘基上,從而改變染色體疏松結構,促進轉錄,而HDACs具有相反作用[8]。 HDACs家族成員共有18個,分為四大類,I類包括HDAC1、2、3、8,II類包括HDAC4、5、6、7、9、10,III類包括SIRT1、2、3、4、5、6、7,IV類包括HDAC11[9]。大量研究發現,HDACs抑制劑具有抗腫瘤作用。在血液系統腫瘤中,已有HDAC抑制劑用于臨床。HDAC抑制劑伏立諾他(SAHA)和貝利司他(PXD-101)已經被美國食品和藥物管理局(FDA)批準用于治療淋巴瘤,帕比司他 (LBH589)被批準用于治療多發性骨髓瘤[10]。有文獻報道,HDAC6在膀胱癌、惡性黑色素瘤和肺癌中過表達[4~6]。并且研究顯示,HDAC6抑制劑CAY10603能抑制肺腺癌細胞的增殖[6]。
本研究為了探討新型選擇性HDAC6抑制劑ACY1215對肝癌細胞的作用,觀察ACY1215對順鉑誘導人肝癌細胞系SMMC-7721凋亡的影響。結果顯示,光鏡觀察到ACY1215聯合順鉑對細胞增殖的抑制作用明顯高于單用順鉑,而且ACY1215處理后能明顯抑制細胞HDAC6基因表達水平。通過檢測凋亡相關蛋白發現,與順鉑組相比,ACY1215聯合順鉑能明顯下調Bcl-2和Cyclin D1,上調Bax。檢測微管蛋白,發現ACY1215可明顯提高乙酰化α-tubulin的水平。這些結果表明,ACY1215可增強順鉑誘導的SMMC-7721細胞的凋亡。有學者通過siRNA下調三種肝癌細胞系(HLF、PLC/PRF/5、Hep3B)中HDAC6的表達,發現HDAC6表達下調后三種細胞的遷移和侵襲能力均降低[11]。在結腸癌的研究發現,HDAC6抑制劑ACY1215和抗腫瘤藥奧沙利鉑聯合使用可增加結腸癌細胞系(HCT116和HT29)凋亡細胞的數量,并增強對凋亡通路的影響[12]。在膠質瘤的研究中發現,HDAC6過表達可抵抗抗腫瘤藥替莫唑胺(TMZ)介導的細胞增殖抑制和凋亡誘導,而下調HDAC6可抑制細胞增殖,促進細胞凋亡,并促使膠質母細胞瘤細胞對TMZ敏感[13]。
綜上所述,HDAC6抑制劑ACY1215可通過促進順鉑誘導的肝癌細胞系SMMC-7721細胞凋亡,揭示了HDAC6抑制劑與傳統的化療藥物聯合用于臨床的肝癌治療可能性,并對進一步開發新的治療方案提供實驗基礎。

