對容量瓶幾個實驗問題的探討
夏立先
1.容量瓶本身的體積誤差是多少?
經查找,近幾年采購的容量瓶都標注了體積誤差,如100 mL容量瓶體積誤差為0.1 mL。對于標注體積誤差的100 mL容量瓶,筆者用50 mL及100 mL的酸式滴定管進行了標定,結果二者體積誤差均在0.1 mL以內。
標定方法如下:
實驗(1):在20℃時,用50 mL的酸式滴定管(最小刻度0.1 mL)向標注了體積誤差的100 mL干燥容量瓶中定量滴入50 mL水,滴入兩次共計100 mL水,發現液面低于刻度線,然后用膠頭滴管逐滴加蒸餾水至溶液的凹液面正好與刻度線相切,所需水的滴數為1滴(1滴體積約0.05 mL)。
實驗(2):在20℃時,用100 mL的酸式滴定管(最小刻度0.2 mL)向標注了體積誤差的
100 mL干燥容量瓶中定量滴入100 mL水,發現液面高于刻度線,然后用膠頭滴管吸出1滴水后溶液的凹液面正好與刻度線相切(1滴體積約0.05 mL)。
通過以上實驗還證明,用滴定管來測量和研究容量瓶體積誤差問題是可行的。
2.定容前輕輕振蕩容量瓶的作用是什么?
配制一定物質的量濃度溶液,其步驟主要為:(1)計算,(2)稱量,(3)溶解,(4)轉移,(5)定容。蘇教版必修1化學教材(2014年6月第6版)配制100 mL 0.1 mol·L-1碳酸鈉溶液第(4)步是這樣描述的:“將燒杯中的溶液用玻璃棒小心地引流到100 mL容量瓶中,用蒸餾水洗滌燒杯及玻璃棒2次~3次,并將每次洗滌的溶液都注入容量瓶中。輕輕振蕩容量瓶,使溶液混合均勻”。在實驗過程中,有許多學生忽視了“輕輕振蕩容量瓶”這一操作,從而導致實驗有較大誤差。請看下面的兩個對比實驗。
對比實驗一:
實驗步驟:
實驗(3):定容前輕輕振蕩容量瓶。取一只100 mL容量瓶,向其中加入10 mL飽和食鹽水,然后加入50 mL蒸餾水,輕輕振蕩容量瓶,使溶液混合均勻。繼續加入蒸餾水至離刻度線1 cm~2 cm時,改用膠頭滴管加蒸餾水至溶液的凹液面正好與刻度線相切,再將容量瓶塞蓋好,反復上下顛倒,搖勻。然后將容量瓶正立,靜置,使液面穩定;取下容量瓶塞,用膠頭滴管逐滴加蒸餾水至溶液的凹液面正好與刻度線相切,記錄所需水的滴數。
實驗(4):定容前沒有輕輕振蕩容量瓶。將上述容量瓶中的溶液倒掉,用水洗干凈,向其中加入10 mL飽和食鹽水,然后加入蒸餾水至離刻度線1 cm~2 cm時,改用膠頭滴管加蒸餾水至溶液的凹液面正好與刻度線相切,再將容量瓶塞蓋好,反復上下顛倒,搖勻。然后將容量瓶正立,靜置,使液面穩定;取下容量瓶塞,用膠頭滴管逐滴加蒸餾水至溶液的凹液面正好與刻度線相切,記錄所需水的滴數。
實驗結果:
實驗(3)所需水的滴數為1滴;實驗(4)所需水的滴數為3滴.
對比實驗二:
實驗步驟:
實驗(5):取一只100 mL容量瓶,向其中加入30 mL飽和食鹽水,然后加入30 mL蒸餾水,輕輕振蕩容量瓶,使溶液混合均勻。其余步驟同實驗(3)。
實驗(6):將上述容量瓶中的溶液倒掉,用水洗干凈,向其中加入30mL飽和食鹽水,其余步驟同實驗(4)。
實驗結果:實驗(5)所需水的滴數為2滴;實驗(6)所需水的滴數為6滴.
通過以上兩個對比實驗,得到的實驗結論是:定容前輕輕振蕩容量瓶,可使溶液混合均勻,減小定容時的體積變化,從而減小實驗誤差。并且,如果不振蕩,溶液濃度越大,誤差越大。
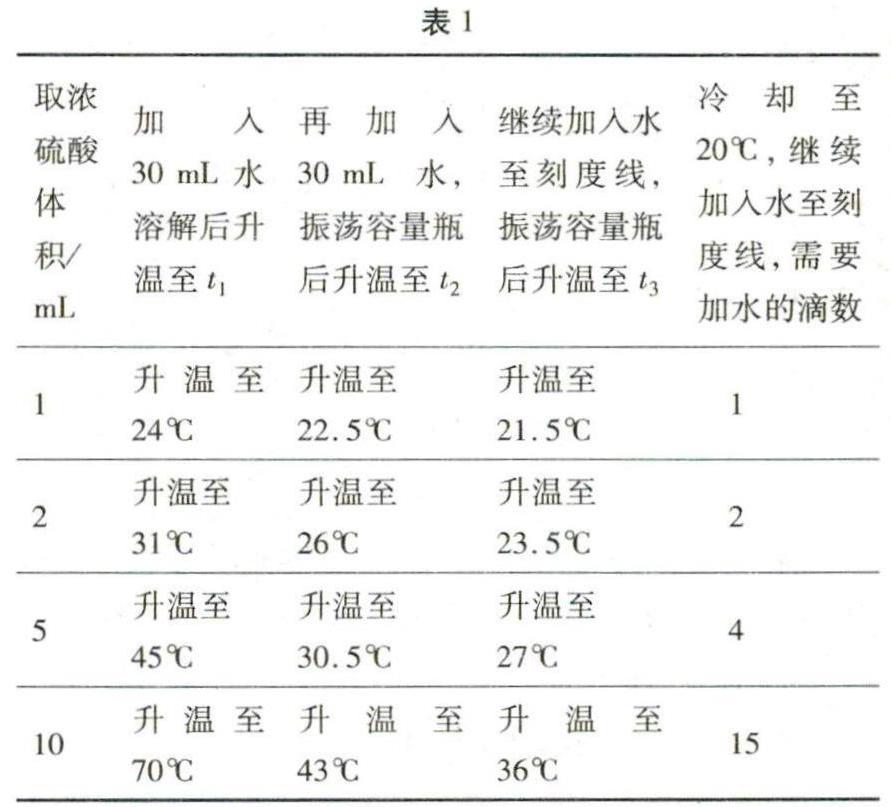
3.用濃硫酸配制稀硫酸,溶解后不冷卻就轉移,定容后再冷卻至20℃,體積誤差有多大?實驗(7):分別取30 mL水于150 mL燒杯中,各加入不同體積的濃硫酸,振蕩,測得溫度為t1;將溶解后的濃硫酸,迅速轉移至100 mL容量瓶,再向容量瓶中加入30 mL水,振蕩,測得溫度為t2;繼續加水至刻度線,反復搖勻,測得溫度為t3;從容量瓶中取出溫度計,加水至刻度線;冷卻至20℃,繼續加入水至刻度線,記錄需要加水的滴數。結果見表1。
通過表1數據可以看出:
(1)用濃硫酸配制稀硫酸,溶解后不冷卻就轉移,會帶來體積誤差。
(2)配制的硫酸越濃,需要的濃硫酸就越多,體積誤差就越大。
(3)當配制的硫酸濃度比較稀(如0.3 mol·L-1以下)時,體積誤差很小(在0.1 mL以內),因此濃硫酸溶解后可以不冷卻就轉移。
注意:溶解及轉移速度不同,測得的結果會稍有不同。按正常速度,結果不會相差太大。
4.用玻璃棒引流時,玻璃棒的下端接觸點必須在容量瓶刻度線以下嗎?
實驗(8):選取3個100 mL容量瓶,它們的刻度線分別處在頸的偏上、偏中、偏下位置。分別將玻璃棒下端接觸點沿刻度線以上和以下引流,向上述容量瓶中加水至離刻度線3 cm~4 cm時,改用膠頭滴管加水至刻度線,然后塞好塞子,反復振蕩后,正立容量瓶,使液面穩定;取下容量瓶塞,用膠頭滴管逐滴加蒸餾水至溶液的凹液面正好與刻度線相切,記錄所需水的滴數。
實驗結果:都需要2滴水。因此玻璃棒沿刻度線以上和以下引流基本沒有區別。這樣以來,用玻璃棒引流時,玻璃棒下端接觸點適當靠頸的上部一點更好操作。由此可知,加水定容時可以不用玻璃棒引流,用滴瓶等加水也可以。實際上,美國教材中轉移溶液就沒有使用玻璃棒。
5.將溶解的溶液轉移到容量瓶后,燒杯及玻璃棒不洗滌與洗滌誤差會有多大?
實驗(9):取1只酸式滴定管,向其中加入1 mol·L-1食鹽水并調節液面起始讀數為0;另取1支規格為125 mL干燥燒杯,從酸式滴定管中放出20 mL食鹽水到該燒杯中,輕輕搖晃后,將燒杯中的食鹽水全部倒入上述酸式滴定管中,待液面穩定后發現液面讀數約為0.1 mL。由此可以得出燒杯粘附溶液體積約為0.1 mL。實驗(10):另取1支酸式滴定管,向其中加入1 mol·L-1食鹽水并調節液面起始讀數為0;另取1只規格為125 mL干燥燒杯,從酸式滴定管中放出20 mL食鹽水到該燒杯中,用玻璃棒(中等粗度,周長為2 cm)攪拌溶液,將燒杯中的食鹽水沿玻璃棒全部轉移到上述酸式滴定管中,待液面穩定后發現液面讀數約為0.2 mL。由此可以得出燒杯及玻璃棒各粘附溶液體積為0.1 mL。
綜合上述結果可知,如果燒杯及玻璃棒不洗滌:若溶解液為20 mL,其帶來的濃度誤差約為1%;若溶解液為10 mL,其帶來的濃度誤差約為2%。二者都遠大于100 mL容量瓶自身0.1%的體積誤差,顯然不行。
根據燒杯及玻璃棒殘留量為0.2 mL,可計算出洗滌1次、2次、3次的濃度誤差。
若每次洗滌用水量為20 mL,洗滌1次濃度誤差約為0.01%,洗滌2次濃度誤差約為0.0001%,洗滌3次濃度誤差約為0.000001%。
若每次洗滌用水量為10 mL,洗滌1次濃度誤差約為0.04%,洗滌2次濃度誤差約為0.0008%,洗滌3次濃度誤差約為0.000016%。
如果按計算結果來看,洗滌燒杯及玻璃棒1次就可以了,當然洗滌2次效果更好。
(收稿日期:2019-02-12)

