仔豬斷奶應激對腸道微生物菌群影響的研究
于光輝,姜建陽,張華杰,耿 梅,宋春陽
(1.青島農業(yè)大學動物科技學院,山東 青島266109;2.威海市動物疾病控制預防中心,山東 威海264200)
斷奶仔豬由于消化系統(tǒng)和免疫系統(tǒng)等生理機能發(fā)育不夠完善,消化酶及胃酸分泌不足,腸道內微生物區(qū)系尚未建立,體溫調節(jié)能力差[1],導致仔豬在斷奶時會表現(xiàn)出一系列的癥狀,如食欲減退、消化力差、腹瀉、抵抗力差、易被病原微生物侵襲等,從而造成消化不良、體弱、生長發(fā)育受阻、飼料報酬低等斷奶應激綜合征[2]。斷奶應激是豬生產中的一個普遍現(xiàn)象,給養(yǎng)豬業(yè)造成巨大的經(jīng)濟損失。
寄居在動物腸道中的細菌對于維持寄主的健康發(fā)揮著重要的作用,腸道微生物菌落能夠幫助寄主消化吸收營養(yǎng)物質、提高免疫力、維持上皮細胞發(fā)育,并且是抵御外源致病菌的天然屏障[3]。當然,腸道微生物也有不利的方面,它能通過與遺傳距離較遠的致病菌以等位基因交換的方式,或者整合幾種致病菌的致病基因變?yōu)樾碌闹虏【鶾4-5]。斷奶應激和日糧改變會打破微生態(tài)的平衡,導致乳酸菌減少,大腸桿菌增多,而多數(shù)人認為仔豬斷奶后腹瀉的主要致病菌就是大腸桿菌[6]。乳酸桿菌與腸桿菌的比例通常被用于評價腸道的健康水平,比值增加說明腸道健康,斷奶導致比值下降,仔豬腸道健康受到威脅引發(fā)腹瀉甚至死亡,仔豬斷奶后抑制腸道菌能夠預防或者降低腹瀉的程度[7]。
眾所周知,中國地方品種豬經(jīng)過幾千年的遺傳進化,有著豐富的遺傳多樣性,有很多優(yōu)良性狀是引進品種豬所不具備的,它們更能適應當?shù)氐臍夂颦h(huán)境,并且比國外品種有獨特的抗逆性,腸道微生物菌群相對穩(wěn)定,斷奶應激反應相對較小。本研究以萊蕪豬和杜-長-大仔豬為研究對象,比較兩品種仔豬斷奶前后腸道微生物的變化情況,為豬的抗逆性狀選育和微生態(tài)制劑的研發(fā)提供依據(jù)。
1 材料與方法
1.1 實驗動物 試驗選擇同一日齡出生的健康杜-長-大仔豬和萊蕪豬各10 頭(來自同一窩)作為試驗動物。
1.2 試驗設計 兩品種仔豬均于28 日齡斷奶,每個品種為1 個處理組,根據(jù)斷奶時間分為5 個階段,分別是斷奶前1 周(21 d)、斷奶當天(28 d)、斷奶后1 d(29 d)、斷奶后1 周(35 d)及斷奶后2 周(42 d),每個處理組每個階段隨機選取2 頭仔豬屠宰取樣。
1.3 試驗日糧 仔豬出生5 d 開始補飼通威-200乳豬教槽料,所有試驗豬在相同的環(huán)境下采用相同的飼喂方式。
1.4 飼養(yǎng)管理 豬的飼養(yǎng)試驗在青島農業(yè)大學即墨段泊嵐學生教學實習基地進行,仔豬出生第2 天補鐵,第5 天開始補飼,第28 天時斷奶,仔豬斷奶后轉入保育舍仍飼喂1 周的教槽料,以后逐漸過渡飼喂保育料,每天更換20%,整個試驗期仔豬自由采食和飲水。
1.5 樣品采集 每個階段試驗結束時,兩個品種各選取2 頭體重相近的仔豬,當日清晨9:00 將其頸靜脈放血致死,打開腹腔立即結扎幽門瓣、回盲瓣、胰腺管,以防止消化道樣品的相互污染。迅速找到空腸后端,取出50 g 左右的食糜,立即放入液氮速凍,然后移入-80 ℃冰箱中保存?zhèn)溆谩?/p>
1.6 試驗方法
1.6.1 腸道微生物DNA 提取 采集腸道內容物(200 mg 左右)保存在3 mL 無水乙醇中,提取DNA前用13 000 r/min 離心5 min,腸道微生物DNA 從離心沉淀中提取,用商業(yè)化生產的QIAamp DNA Stool Mini Kit(Cat.51504,德國)試劑盒,所有步驟均按照說明書進行操作。每個階段同一品種的兩頭仔豬取等量的DNA 進行混合,為后續(xù)試驗提供材料。
1.6.2 16S rDNA V3 區(qū)PCR 擴增 采用Touchdown PCR 對細菌16S rDNA 的V3 區(qū)進行擴增,擴增引物如下:341 fGC:(5′-GCC GCC CGC CGC GCG CGG CGG GCG GGG CGG GGG CAC GGG GGG CCT ACG GAG GCA GCA G-3′),518 r:(5′-ATT ACC GCG GCT GCT GG-3′)其中GC 夾子為CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG G,擴增體系為50 μL,陽性對照用ddH2O 做模板。Touchdown PCR 擴增條件:95 ℃5 min,94 ℃30 s,58 ℃30 s(每個循環(huán)降低0.5 ℃),72 ℃30 s,10 個循環(huán)的降落PCR 擴增完成后取5 μL 擴增引物用2%瓊脂糖凝膠電泳進行檢測。
1.6.3 DGGE 凝膠電泳 DGGE 用采用6%聚丙烯酰胺凝膠,分離細菌16S rDNA 的V3 可變區(qū)片段,濃度梯度為38%~50%。DGGE 電泳程序為:首先在200 V 電壓條件下,電泳10 min,隨后在85 V 固定電壓、60 ℃的0.5x TAB 緩沖液(20 mmol/L Tris、10 mmol/L乙酸和0.5 mmol/L EDTA,pH 值7.5)中電泳16 h。電泳結束后,采用AgNO3染法進行染色。曝光照相后,對一些亮的條帶進行切膠回收DNA 片段,克隆測序后在NCBI 網(wǎng)站進行BLAST 比對,鑒定細菌的類型。
1.6.4 熒光定量PCR 檢測菌群表達量 空腸中雙歧桿菌、乳酸桿菌和大腸桿菌的菌群數(shù)量用Q-PCR(SYBR Premix Ex TaqTM,TaKaRa 公司,寶生物工程(大連)有限公司)檢測,引物參照Han,et al.(2013)的進行,詳見表1。各細菌的反應程序為:95 ℃15 s,60 ℃1 min,72 ℃45 s,87 ℃5 s 共40個循環(huán),以72 ℃10 min 延伸后結束。擴增和檢測DNA 的熒光定量PCR 用ABI 7900 儀器,反應體系包括上下游引物各0.75 μL,Plus 12.5 μL,Tap 酶2 μL,Dye 0.5 μL,H2O 8.5 μL。
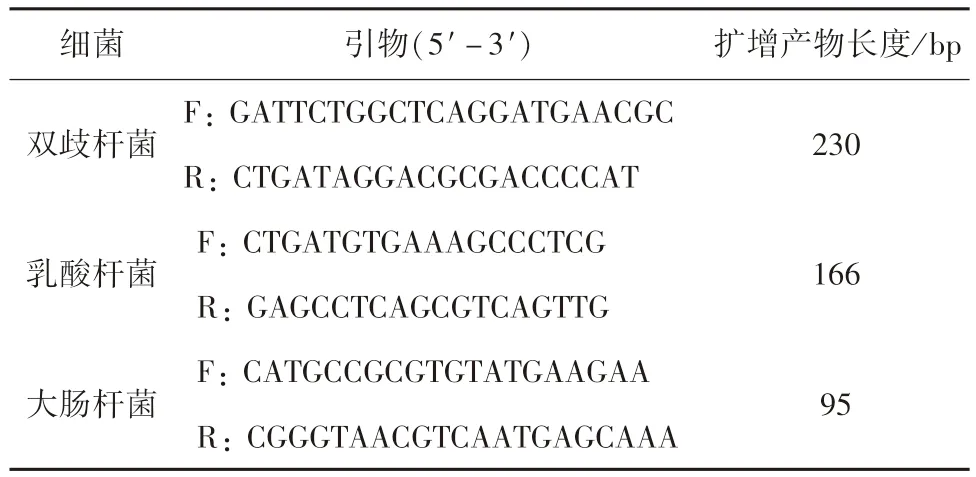
表1 熒光定量PCR 檢測3 種細菌的引物信息
1.7 統(tǒng)計與分析 兩品種豬在不同階段的數(shù)據(jù)分析用SAS 9.4 軟件GLM 過程進行方差分析(SAS Inst.Inc.,Cary,NC),菌群的Q-PCR 每個樣本8 個重復,選擇5 個平行較好的數(shù)值進行-△△t 統(tǒng)計分析,數(shù)據(jù)表示為平均值。PCR-DGGE 指紋圖譜用Quantity One(BIO-RAD,CA)和Biodap 軟件計算菌群的豐度、Shannon-Wiener 指數(shù)和均勻度。
2 結果與分析
2.1 DGGE 檢測腸道微生物 兩品種仔豬斷奶前后不同階段腸道微生物DGGE 檢測結果見圖4,斷奶前1 周兩品種豬的微生物菌群豐度差異不明顯(a和b 泳道),但是斷奶后1 d 比斷奶前1 周微生物復雜(c 和d 泳道),并且萊蕪豬比杜-長-大仔豬更復雜些。菌群的復雜程度在斷奶后1 周逐漸降低(e和f 泳道),并且萊蕪豬的仍然比杜-長-大的要復雜。優(yōu)勢菌群的菌落在斷奶后1 周比斷奶前1 周和斷奶后1 d 都有所改變。兩品種仔豬菌群在斷奶后2 周都下降(g 和h 泳道),并且優(yōu)勢菌群也不盡相同。
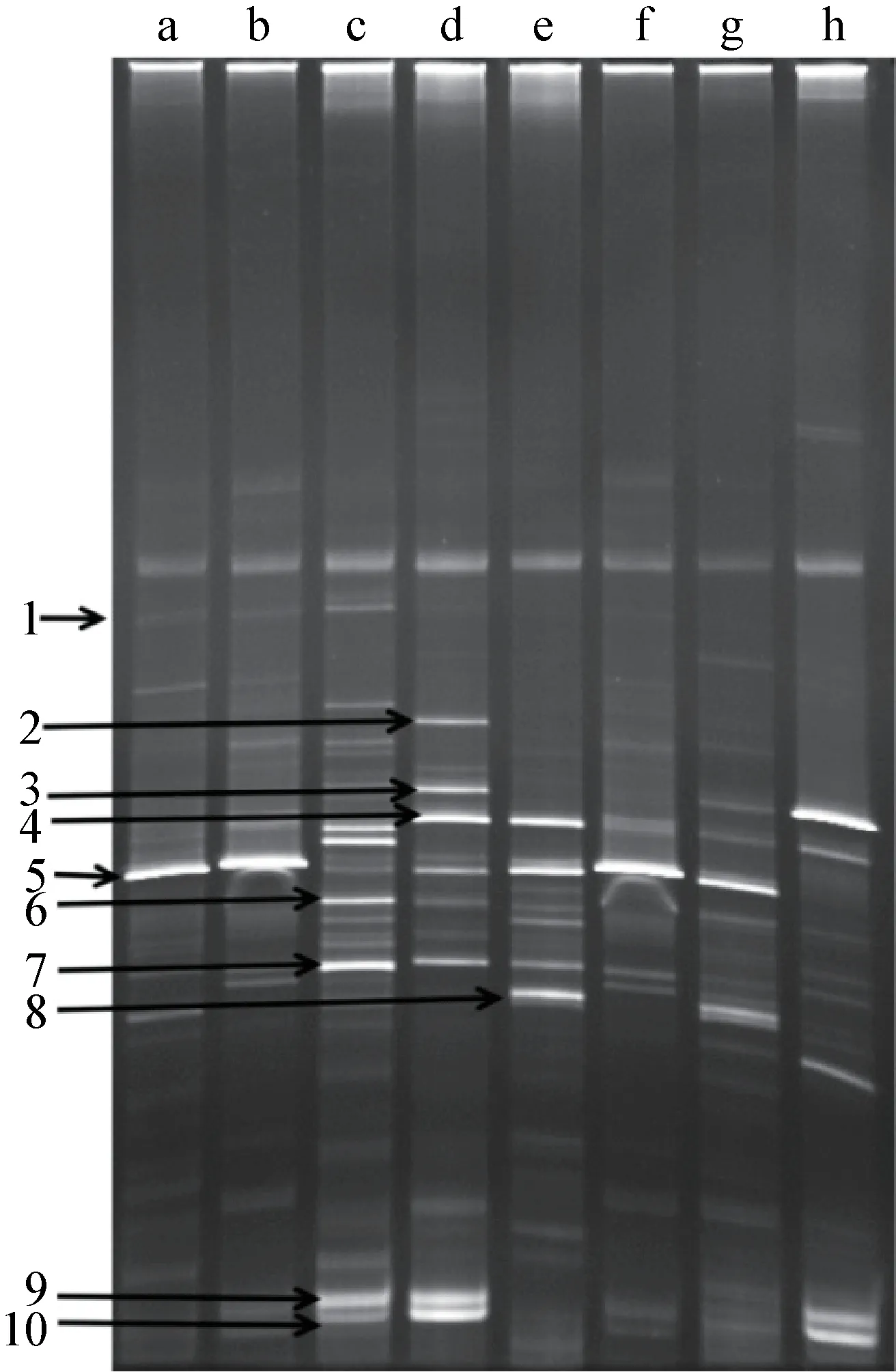
圖1 DGGE 測定兩品種仔豬斷奶前后空腸微生物菌群
2.2 腸道微生物菌群分析 空腸腸道微生物香農-維納指數(shù)和豐度信息見表2,總體來看兩品種之間微生物菌群多樣性的差別是比較明顯的,在各個階段萊蕪豬比杜-長-大仔豬有更多的菌群數(shù),菌群多樣性在斷奶后1 d 還是比較豐富的,斷奶后的前2周菌群相對較少,以后逐漸趨于平衡。對優(yōu)勢菌群切膠測序比對發(fā)現(xiàn),雙歧桿菌在各個時期都比較豐富(圖1,箭頭5),產腸毒素大腸桿菌僅在斷奶后出現(xiàn),斷奶后1 d 迅速增殖,并且成為腸道中的優(yōu)勢菌群(圖1,箭頭7)。乳酸桿菌作為動物健康的有益菌,在仔豬腸道中并不是優(yōu)勢菌群,DGGE 只能在兩品種仔豬斷奶前和萊蕪豬斷奶后1 d 檢測到(圖1,箭頭1),腸桿菌和腸球菌在各個時期都是腸道優(yōu)勢菌群(圖1,箭頭4 和10)。
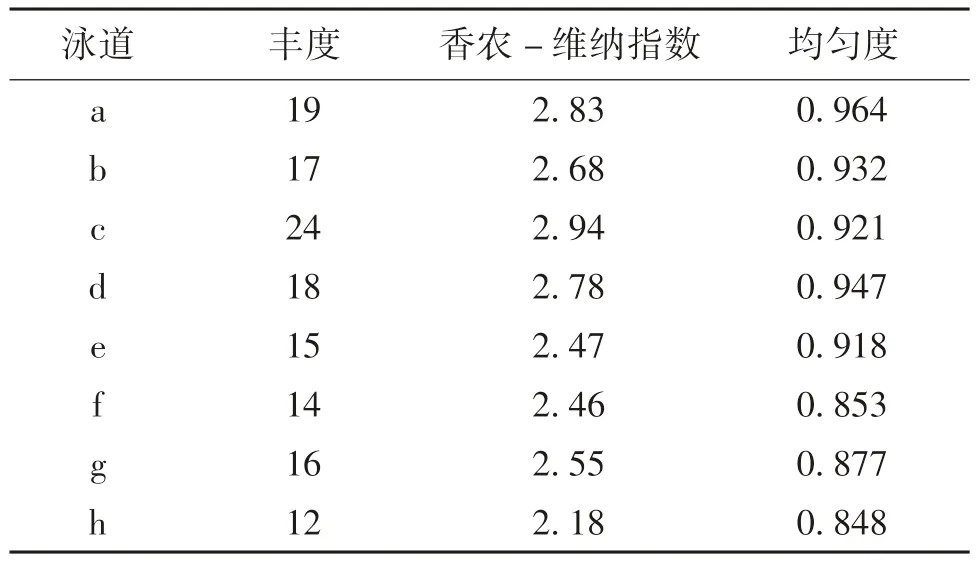
表2 空腸菌群的豐度、香農-維納指數(shù)和均勻度信息
2.3 熒光定量PCR 檢測腸道菌群 雙歧桿菌、乳酸桿菌和大腸桿菌是動物腸道中常見的幾種優(yōu)勢菌群,Q-PCR 檢測這3 種菌群的相對含量(圖2)。
由圖2 可見,萊蕪豬的雙歧桿菌、乳酸桿菌和大腸桿菌在斷奶前后各個時期變化是逐漸過渡,比較平緩,但是在杜-長-大仔豬腸道中變化幅度比較大。兩品種仔豬在斷奶前1 周、斷奶后1 d 和斷奶后2周的雙歧桿菌差異不顯著(P >0.05),但是在斷奶后1 周萊蕪豬是杜-長-大仔豬的6.4 倍(P <0.01)。對于乳酸桿菌在斷奶前1 周和斷奶后1 周杜-長-大仔豬是萊蕪豬2 倍左右(P <0.01),但是在其他時期兩品種仔豬之間差異不顯著(P >0.05)。萊蕪豬比杜-長-大仔豬的大腸桿菌在各個時期都相對較低,杜-長-大仔豬斷奶后1 周空腸大腸桿菌比萊蕪豬高87%(P <0.05)。
3 討論
腸道微生態(tài)平衡對動物的健康至關重要,在養(yǎng)豬生產中,斷奶必然改變腸道微生物菌群平衡,仔豬斷奶應激會打破微生態(tài)平衡,導致乳酸菌等有益菌減少,而大腸桿菌增加,引發(fā)大腸桿菌性腹瀉。熒光定量PCR 是檢測腸道菌群相對含量的有效方法[8-9],本試驗定量檢測了雙歧桿菌、乳酸桿菌和大腸桿菌在不同斷奶期的相對含量,在不同的斷奶期會有相應的變化,與其他人的研究結果相似[10-11]。用DGGE 的方法只能在兩品種仔豬的斷奶前1 周和萊蕪豬斷奶后1 d 檢測到乳酸菌,但是通過特異引物熒光定量PCR 卻可以在其他時期檢測到。另外,令人疑惑的是乳酸菌在杜-長-大仔豬斷奶后1 周是優(yōu)勢菌群,但是在斷奶后2 周急劇下降。
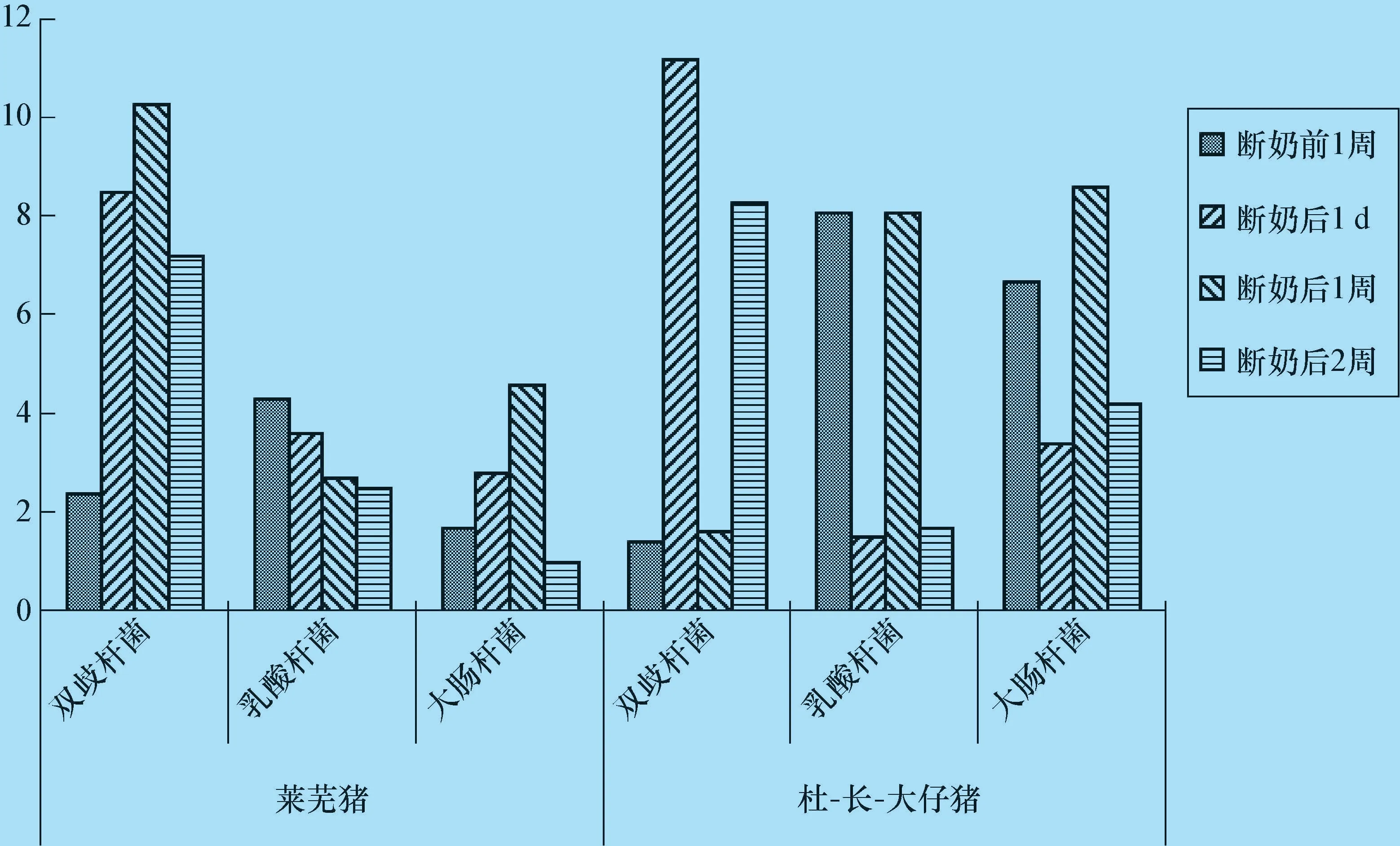
圖2 兩品種仔豬斷奶前后雙歧桿菌、乳酸桿菌和大腸桿菌相對含量
大腸桿菌不僅影響豬的腸道生理狀態(tài),而且影響其免疫應答。有些飼料添加劑通過干擾腸道微生物種群來緩解仔豬斷奶應激,例如低聚甘露糖,它是一種從酵母菌中提取的細胞壁成分,它能夠干擾細菌與上皮細胞的結合,調節(jié)腸道微生物系統(tǒng),降低腸道致病菌繁殖[8],提高動物的免疫力。氧化鋅可以通過降低大腸桿菌種系的多樣性來增加腸道微生物菌群的穩(wěn)定性[6]。
pH 值是動物體內消化環(huán)境的重要因素,適宜的酸堿環(huán)境是營養(yǎng)物質充分消化吸收、有益菌群合理生長、病原微生物受到有效抑制的必要條件[12]。仔豬出生后,胃內pH 值隨著體重的增加而呈現(xiàn)下降的趨勢;仔豬斷奶后,消化道內的pH 值會顯著升高,高于斷奶前的pH 值[13]。消化道pH 值升高,不僅會對腸道消化酶活性產生影響,還會導致腸道菌群紊亂,病原菌大量增殖,特別是大腸桿菌,引起仔豬腹瀉[10]。由于斷奶后胃和十二指腸pH 值明顯升高,使胃蛋白酶活性降低,對飼料的消化吸收能力減弱,引發(fā)食欲不振、腹瀉等問題[14]。另外,酸堿度會影響細胞生長,酸度增加可促進細胞分裂,加快腸黏膜的修復[15](Godlewski,et al.2009)。
4 結論
萊蕪豬比杜-長-大仔豬斷奶后腸道微生物更加豐富,并且萊蕪豬的腸道微生物在斷奶后能夠很快建立起新的平衡,萊蕪豬比杜-長-大仔豬有更強的抗斷奶應激能力。

