樹突狀細胞分泌的外泌體對心肌梗死后肝細胞血脂代謝的影響
白英楠, 李智行, 張亞琦, 高 微, 邵文琦, 王曉燕, 劉海波, 張真中, 錢三立, 李冰玉, 李卓權, 鄒云增, 錢菊英*, 葛均波*
1. 復旦大學附屬中山醫院心內科,上海市心血管病研究所,上海 200032 2. 同濟大學醫學院附屬東方醫院,上海 200120 3. 同濟大學醫學院,上海 200092
炎性細胞以及造成血管損傷的多種炎性因素已被證明可引發復雜的炎性反應級聯,從而產生易損斑塊,導致心肌梗死(MI)和卒中等疾病[1-2]。樹突狀細胞(DCs)是免疫系統的重要部分,參與動脈粥樣硬化及其他炎性反應過程[3]。DCs促進早期泡沫細胞的形成,參與脂質代謝的調節和T細胞應答[4]。DCs分泌的細胞外囊泡(EV)分為3種主要類型:內體衍生的外泌體、細胞表面脫落的微泡和凋亡小體;其中,外泌體已成為最受關注的研究對象之一[5]。DCs-外泌體(DEXs)是DCs通過胞吐作用分泌的雙膜囊泡,直徑為30~100 nm[6]。外泌體含有各種細胞質成分,包括細胞因子、mRNA和microRNA等[7]。研究證明,體內分離的DEXs在注射后會誘發患者的抗腫瘤特異性免疫反應,因此DEXs被認為是由DCs分泌的有益物質,可以產生免疫刺激作用[8]。然而,目前關注DEXs在心血管疾病中作用的研究較少。本課題組前期研究表明,急性心肌梗死(MI)過程中肝臟CD11c+DCs的浸潤增加,而梗死心肌中滲入的DEXs會激活CD4+T細胞,并改善MI后的傷口愈合,這為通過DEXs治療MI提供了新的思路[9]。
另一方面,血脂異常參與動脈粥樣硬化和MI的病理機制以及MI后脂質譜的變化也引起了人們的廣泛關注。目前普遍認為,高脂血癥是動脈粥樣硬化發病的關鍵因素,它可導致包括MI在內的冠狀動脈疾病[10]。然而在MI后期,脂質譜的變化相當復雜,MI后血脂異常的機制仍然未知。在肝臟脂質代謝的各種途徑中,甾醇調節元件結合蛋白(SREBPs)是涉及脂質合成的轉錄因子之一[11-12],參與某些疾病的炎性反應過程[13]。SREBPs所涉及的信號轉導通路包括受胰島素信號調節的哺乳動物雷帕霉素靶蛋白(mTOR)-SREBP途徑,該途徑受到5′-單磷酸腺苷激活的蛋白激酶(AMPK)的抑制[14]。同時,SREBPs在許多疾病的炎性反應中發揮作用,例如Li等發現SREBP-1c在奶牛脂肪肝疾病模型的炎性反應通路過度活化中起重要作用[15];另一項研究表明抑制SREBP通路可通過阻滯炎性反應來抑制肝細胞癌的活動[16]。因此,本課題組設想mTOR-SREBP途徑可能參與MI后的血脂異常,即MI后DEXs的存在會導致肝臟中mTOR-SREBP途徑改變,從而引起血脂譜的異常,并可能參與心梗后炎性反應。
本研究采用梗死心肌細胞和正常心肌細胞的上清液處理DCs,獲取DEXs后用于干預正常肝細胞,然后測量DEXs對肝細胞脂質譜的影響,檢測肝細胞中mTOR-SREBP途徑的變化,并進一步利用SREBP抑制劑,檢測其對肝細胞合成和分泌脂質譜的影響,為未來研究作為潛在治療靶點的mTOR-SREBP通路提供更多證據。
1 材料與方法
1.1 DEXs的制備和鑒定 雄性C57BL/6小鼠購自上海實驗動物研究中心,均以正常飲食喂養,并在清潔條件下飼養。所有動物飼養方案均經復旦大學附屬中山醫院動物倫理審查委員會批準。首先獲取DCs:小鼠骨髓經洗脫后,在含有10 ng/mL粒細胞-巨噬細胞集落刺激因子和1 ng/mL IL-4(美國PeproTech公司)的培養液中培養;48 h后洗去未貼壁的細胞,并每天更換新鮮培養液,在第7天收集DCs用于進一步實驗干預。用ExoQuick-TCTM外泌體沉淀溶液(美國System Biosciences Inc.公司)進行DEXs分離:將ExoQuick-TC溶液加入DCs上清液(10 mL,體積比1∶5)后,將混合物在4℃冷藏過夜,并以1 500×g離心30 min;除去上清液后,將沉淀溶于1 mL磷酸鹽緩沖液(PBS,美國Invitrogen公司)中,從而獲取DCs外泌體(命名為Control-DEX)。所有操作均在無菌條件下進行。通過透射電子顯微鏡和納米顆粒跟蹤分析儀Nanosight(英國Malvern公司)分別分析外泌體的超微結構和大小分布(圖1),采用免疫印跡法測定蛋白質標志物、CD63和Alix等,用于鑒定DEXs。以上實驗方案可參見已發表文獻[9]。
1.2 模擬MI后心肌細胞微環境 結扎小鼠心臟冠脈左前降支,建立小鼠MI模型。8 h后,在清潔條件下移除小鼠心臟,剪切梗死區及其邊緣區組織,PBS溶液洗滌3次以移除血細胞。將該組織繼續裁剪,通過Gentle MACS全自動單細胞制備系統(德國Miltenyi Biotec公司)獲得單細胞懸浮液,然后離心得細胞上清液,用于模擬MI組中體外心梗的環境。再利用此步驟所得上清液刺激DCs,并按照1.1節實驗方案獲取心梗特異性DEX(命名為MI-DEX),用于后續研究[9]。

圖1 電子顯微鏡下外泌體的鑒定
1.3 AML12細胞培養并用DEXs干預 α小鼠肝臟12(AML12)細胞系(購自ATCC,編號為CRL-2254TM),由小鼠肝細胞產生。將細胞培養于DMEM培養液和Ham’s F12培養液的1∶1混合物中,所述培養液中含有0.005 mg/mL胰島素、40 ng/mL地塞米松和10%胎牛血清。使用懸浮于100 μL PBS中的MI-DEX、Control-DEX或MI-DEX+SREBP抑制劑Fatostatin A(HY-14452,美國MedChemExpress公司產品)處理AML12細胞24 h,以進行進一步評估。
1.4 AML12細胞上清液中的脂質譜分析和油紅染色 通過自動生化檢測儀(Hitachi 7150,日本日立公司產品)、脂質測定試劑盒及酶標測量儀(Tecan酶標儀,Infinite M200 PRO )測量AML12細胞上清液中總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)和低密度脂蛋白膽固醇(LDL-C)的濃度。油紅O染色評估AML12細胞中的脂質積累。將細胞以2×106個/mL的密度,用4%多聚甲醛溶液固定在載玻片上至少30 min,PBS洗滌并浸入新制備的2%油紅O(美國Sigma Aldrich和Merck Millipore公司產品)中,室溫下染色25 min。然后將載玻片置于60%異丙醇溶液(美國Invitrogen和Thermo Fisher Scientific公司產品)中洗滌,再用蒸餾水洗滌,最后使用相差顯微鏡觀察染色情況。
1.5 實時熒光定量PCR和蛋白質印跡法分析mTOR-SREBP通路 采用TRIzol試劑[生工生物工程(上海)股份有限公司產品]從AML12細胞中提取總RNA,然后用反轉錄試劑盒(日本ToYoBo公司產品)將mRNA反轉錄為cDNA。用SYBR Premix ExTaq試劑盒(日本TaKaRa公司產品)配制實時熒光定量PCR反應體系,然后用ABI 7500實時PCR系統進行測定。小鼠SREBP-1a和SREBP-1c的引物如下:SREBP-1a (Forward) 5′-GGC CGA GAT GTG CGA ACT-3′;SREBP-1a (Reverse) 5′-TTG TTG ATG AGC TGG AGC ATG T-3′;SREBP-1c (Forward) 5′-GGA GCC ATG GAT TGC ACA TT-3′;SREBP-1c (Reverse) 5′-GGC CCG GGA AGT CAC TGT-3′。通過添加有蛋白酶抑制劑混合物(瑞士Roche公司)的RIPA緩沖液裂解AML12細胞,13 680×g離心速度進行離心20 min后,通過SDS-PAGE分離蛋白,然后轉移至PVDF膜(美國Bio-Rad公司產品),并與相應一抗和二抗(p-SREBP-1抗體購自美國Cell Signaling Technology公司,mTOR抗體和AMPK抗體購自英國Abcam公司)孵育。通過Quantity One軟件計算蛋白質豐度值。將所有結果以相對于GAPDH的表達標準化。
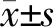
2 結 果
2.1 DEXs干預AML12細胞后的脂質譜變化 結果(表1)表明:與Control-DEX組相比,MI-DEX組肝細胞上清液中LDL-C的水平均明顯升高(P=0.047),兩組間TC、TG和HDL-C的脂質分布無顯著差異(P=0.088,P=0.378,P=0.136)。

表1 DEXs干預后AML12細胞脂質譜的變化 cB/(mmol·L-1)
TG:三酰甘油;TC:膽固醇;LDL-C:低密度脂蛋白膽固醇;HDL-C:高密度脂蛋白膽固醇
2.2 DEXs干預AML12細胞后mTOR-SREBP通路的改變 采用DEXs干預AML12細胞24 h后,通過蛋白質印跡和實時熒光定量PCR分別檢測AML12細胞中mTOR、AMPK和p-SREBP-1蛋白的水平(圖2A、2B),以及SREBP-1a和SREBP-1c基因的表達(圖2C)。結果顯示蛋白質印跡和實時熒光定量PCR實驗結果相一致:在MI-DEX組中觀察到mTOR和p-SREBP-1c蛋白表達水平升高(P<0.05),以及AMPK蛋白表達水平降低(P<0.05),而且SREBP-1a和SREBP-1c基因的表達量均增加(P<0.05)。

圖2 蛋白質印跡法及實時熒光定量PCR檢測肝細胞中mTOR、AMPK和p-SREBP-1的表達
A,B:蛋白質印跡法檢測肝細胞mTOR-SREBP蛋白表達;C:實時熒光定量PCR測定mTOR-SREBP相關基因表達.*P<0.05與Control-DEX相比
2.3 SREBP抑制劑干預后AML12細胞脂質譜的變化 結果提示:與MI-DEX組相比,加入抑制劑后肝細胞上清液中LDL-C的水平明顯降低(P=0.046),而TC、TG和HDL-C的脂質分布沒有顯著變化(PTC=0.116,PTG=0.092,PHDL-C=0.111)。Control-DEX與Control-DEX+SREBP抑制劑組比較,肝細胞上清液中脂質譜無顯著改變(表2)。油紅O染色的結果表明,SREBP抑制劑干預不會使肝細胞發生脂肪變性(圖3)。
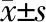
表2 SREBP抑制劑干預后肝細胞脂質譜的變化 cB/(mmol·L-1),
TG:三酰甘油;TC:膽固醇;LDL-C:低密度脂蛋白膽固醇;HDL-C:高密度脂蛋白膽固醇

圖3 AML12細胞油紅O染色結果
A:Control-DEX處理;B:SREBP抑制劑+Control-DEX處理;C:MI-DEX處理;D:SREBP抑制劑+MI-DEX處理
3 討 論
本研究發現在不同的脂質譜中,MI-DEX干預肝細胞后其TC和LDL-C合成及分泌功能增強,而mTOR-SREBP信號通路的改變與脂質譜的變化一致,提示這一信號通路可能參與肝臟調節TC的作用。
MI后的血脂異常一直是一個有爭議的話題。大多數研究認為,MI后期TC水平會短暫升高[17]。血脂異常,特別是高膽固醇血癥和高LDL-C血癥,會加重動脈斑塊不穩定[18]。因此,研究MI后的脂質譜變化具有重要臨床意義。本研究首次發現DEXs可能在MI后血脂異常中發揮作用,其中mTOR-SREBP通路參與調節。本研究的體外實驗結果提示,肝細胞內mTOR-SREBP通路異常可能導致MI后高膽固醇血癥和高LDL-C血癥。因為SREBP與血脂合成有關[19-20],故此通路與小鼠模型中脂質譜的變化緊密相關,未來該途徑可能是MI后血脂異常干預的潛在目標。
本課題組前期研究結果表明,DEXs可以激活CD4+T細胞,并改善MI后的心臟功能[9]。然而,本研究結果提示DEXs會導致高膽固醇血癥和MI后的高LDL-C血癥,這似乎與之前的研究結果相矛盾。本研究結果還提示,MI后的高膽固醇血癥可能是通過mTOR-SREBP信號通路來發揮調節作用。因此,DEX引起的MI后血脂異常可能通過抑制mTOR-SREBP途徑而改變,從而發揮其保護性作用。對此,本課題組將進行深入研究,如擬在小鼠心梗模型中進一步研究體內MI后脂質譜,以及DEXs干預和SREBP抑制劑對血脂譜的影響等,進一步證明DEXs在MI后脂質譜異常中的作用。總之,本研究為探討DEXs在MI恢復過程中可能發揮的作用提供了新的視角和研究方向。
本研究仍存在一些局限性。第一,將DEXs視為DC分泌的整體代表,不夠嚴謹。由于DEXs含有各種物質,包括細胞因子、mRNA和microRNA等,因此檢測MI-DEXs中各種物質的含量,并找出造成MI后血脂異常的具體因素,有待進一步研究。第二,僅進行了體外細胞實驗,缺少動物體內實驗等。后續本課題組將進一步行動物體內實驗,以證實MI后DEXs在脂質譜變化中的作用,以及mTOR-SREBP途徑的變化。
綜上所述,本研究發現,來自DCs的外泌體通過調節mTOR-SREBP信號通路,在MI后的高膽固醇血癥和高LDL-C血癥中發揮重要作用。這為研究DEXs的影響及其對MI后血脂異常的作用機制奠定了一定基礎,同時提示mTOR-SREBP信號通路可能作為MI治療的潛在靶點。

