多花黃精內生貝萊斯芽胞桿菌的分離鑒定及其抗菌與促生作用分析
遲惠榮 張亞惠 曾欣 陳衛良 毛碧增
摘要 為鑒定藥用植物內生菌的種類,采用稀釋涂布平板法從多花黃精Polygonatum cyrtonema Hua的根、莖、葉內分離出11株內生菌菌株,經平板對峙法篩選出對尖孢鐮刀菌Fusarium oxysporum具有拮抗作用的菌株ZJU-3。經形態學、生理生化鑒定及16S rDNA 序列分析,初步確定該菌株為貝萊斯芽胞桿菌Bacillus velezensis。通過基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS)分析,發現該菌株能產生表面活性素(surfactin)、泛革素(fengycin)和伊枯草菌素(iturin)三類脂肽類化合物。利用鹽酸沉淀和甲醇抽提法獲得了菌株ZJU-3發酵液中脂肽粗提物。該脂肽粗提物可明顯抑制尖孢鐮刀菌菌絲的生長,抑制率達到 51.6%。經液相色譜質譜聯用(LC-MS)分析表明菌株ZJU-3可產生吲哚乙酸、激動素、玉米素、赤霉素等多種植物激素。溫室栽培試驗結果發現該菌株對多花黃精具有顯著的促生效果,根長和單株根數明顯高于對照組。本研究可為進一步應用該菌株提供理論依據。
關鍵詞 多花黃精; 貝萊斯芽胞桿菌; 內生菌; 鑒定; 抗菌活性; 促生
中圖分類號: S 476
文獻標識碼: A
DOI: 10.16688/j.zwbh.2018337
Hallmann[1]首次完整地將植物內生菌(endophyte)定義為能夠在健康植物活組織內生存而不引起明顯寄主植物病變的一大類微生物,主要包括細菌、真菌和放線菌,其中內生細菌主要包括芽胞桿菌屬Bacillus、假單胞桿菌屬Pseudomonas、腸桿菌屬Enterobacter和土壤桿菌屬Agrobacterium等[2]。人們對植物內生菌的研究主要涉及內生菌的生物學作用,如可促進宿主植物的生長,促進植株對營養元素的吸收[35]、可產生抗菌物質抑制病原菌生長[6]、誘導植物自身產生系統抗性等[67]。
多花黃精為百合科黃精屬植物,被《中國藥典》(2015年版)收錄[8],是一味藥食同源的中藥材。肥厚的地下根莖是多花黃精主要的藥用部位, 干燥根莖具有補氣養陰、健脾、潤肺、益腎等功效。多花黃精主產于湖南、安徽、江西、浙江等地,生產上以根莖繁殖為佳,因其藥用價值和營養保健等功能價值不斷被人們挖掘,目前黃精原材料處于供不應求的狀況。
近年來,隨著藥用植物的分類、化學藥理和栽培方式等方面的深入研究,其內生菌的多樣性已成為當今研究的熱點。然而,目前僅有少量文獻報道黃精內生菌的研究,如李艷玲等[9]報道了泰山黃精的根、莖、葉和果實中分布最廣的內生菌類群——鐮刀菌屬Fusarium sp.,并對其抑菌活性進行了研究。汪瀅等[10]報道,浙江多花黃精內生真菌變灰青霉Penicillium canescens可產生3種抗菌物質——乙基氧苯氨基亞胺乙酸、灰黃霉素和呋喃-2-甲基-3-羧甲基-4-羥基-5-甲氧基萘,其對多種植物病原菌具有抑制活性。柏曉輝等[11]從黃山地區健康的野生黃精根莖中分離得到1株內生菌 HJ-1,該菌對綠膿桿菌P.aeruginosa、鼠傷寒沙門氏菌Salmonella typhi和蘇云金芽胞桿菌B.thuringiensis均具有顯著抑菌效果。
本論文主要針對浙江省江山市的多花黃精的內生細菌展開研究,從中分離篩選到一株對尖孢鐮刀菌F.oxysporum具有拮抗作用的菌株。在此基礎上,開展了該菌株的生理生化和分子鑒定;對其產生的抗菌物質成分和植物激素種類進行了分析,并測定了對尖孢鐮刀菌的抗菌作用和對植物的促生作用。
1 材料與方法
1.1 材料
供試植株:多花黃精采自浙江省江山市(28°22′26.97″N,118°30′36.14″E),由浙江省江山市保安鄉黃精種植基地提供。
供試菌株:多花黃精病原菌尖孢鐮刀菌F.oxysporum保存于浙江大學農業與生物技術學院生物技術研究所。
培養基與試劑:LB、PDA和PDB培養基參照《植病研究方法》[12]配制,分別用于細菌和真菌的培養。細菌基因組提取試劑盒購于上海生工生物工程有限公司;PCR引物由北京擎科新業生物技術有限公司合成;Taq酶、dNTPs等試劑購于北京擎科新業生物技術有限公司;其他試劑均為國產分析純。
儀器設備:Bio-Rad T100型PCR儀;Fire Read 型凝膠成像儀;熱電LYNX6000型高速冷凍離心機;Agilent 1100 高效液相色譜儀和Agilent 6410三重串聯四級桿質譜儀;基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS);日立HITACHI-TM100臺式掃描電鏡;HITACHI-7650透射電鏡;旋轉蒸發儀(RE301)。
1.2 內生菌株的分離與拮抗作用測定
1.2.1 內生菌株的分離
采集的多花黃精樣品用自來水沖洗10 min,自然晾干,然后依次用 75%乙醇浸泡1 min,無菌水沖洗3次,5% NaClO 浸泡6 min,無菌水沖洗5次。樣品經表面消毒后,將根、莖、葉用無菌剪刀剪開,莖切成 1 cm 左右的小段,置于 LB 培養基平板和PDA平板上;另取將根、葉加無菌水研磨至糊狀,靜置 10 min,用無菌水按梯度102~106稀釋,取20 μL分別涂布于 LB 平板和PDA平板,同時取表面消毒時最后1次的洗滌水20 μL涂布于LB 平板和PDA平板上,作為對照組以驗證消毒是否徹底。每個處理3個重復,置于28℃下培養48 h。選取不同形態特征的單菌落反復平板劃線純化后,將不同菌株菌懸液與20%甘油按照1∶1比例混合,保存于-70℃。
1.2.2 內生菌株拮抗作用測定
采用平板對峙培養法篩選對尖孢鐮刀菌F.oxysporum具有抑制作用的菌株。首先將尖孢鐮刀菌在PDA平板上于 28℃培養5 d,用直徑為5 mm的打孔器在平板上打取圓形病原菌菌餅,將其接入新的PDA平板中央,然后在病原菌菌餅兩側等距離(2.5 cm)處點接分離得到的細菌菌株,于 28℃培養 3 d 后觀察記錄抑菌圈。每個處理重復3 次,有抑菌圈的菌株即為拮抗菌。
1.3 內生拮抗菌的鑒定
1.3.1 形態學觀察
將分離菌株劃線接種于LB培養基,28℃培養 24 h 后觀察菌落形態特征。進行革蘭氏染色,并利用掃描電鏡、透射電鏡觀察菌體、芽胞形態及大小。
1.3.2 生理生化特征分析
將分離菌株劃線接種于LB 培養基,37℃培養 24~48 h 后依據《伯杰細菌鑒定手冊》[13]對該菌株的生理生化特征進行鑒定。
1.3.3 拮抗菌的16S rDNA序列測定、gyrB基因序列測定及同源性分析
利用細菌基因組提取試劑盒提取拮抗菌株全基因組DNA。采用細菌16S rDNA的通用引物27F:5′-AGA GTT TGA TCC TGG CTC AG-3′,1492R:5′-TAC GGC TAC TTG TTA CGA CTT-3′,以1.2.2篩選到的拮抗菌(ZJU-3)基因組為模板進行16S rDNA PCR擴增。PCR運行程序:94℃預變性5 min;94℃變性30 s,53℃退火30 s,72℃延伸1 min,共35個循環;72℃延伸10 min。選用引物UP1和UP2r[14] 進行gyrB基因擴增,反應條件:95℃ 4 min;98℃變性10 s,62℃退火1 min,72℃延伸3 min,30個循環;72℃10 min。經1%瓊脂糖凝膠電泳檢測得到特異性片段,將樣品送生工生物工程(上海)股份有限公司測序。將所測得序列登錄在NCBI網站,與GenBank中的所有細菌16S rDNA序列進行BLAST比對,選取同源性98%以上的序列,再結合其模式菌株序列,利用MEGA 5.0用鄰接法(neighbor-joining,N-J)構建系統發育樹,進行同源性分析鑒定。
1.4 菌株ZJU-3脂肽類化合物分析與抗菌檢測
1.4.1 MALDI-TOF-MS檢測與分析
將活化后的菌株ZJU-3按1%接種于LB液體培養基中,37℃,200 r/min,振蕩培養12 h。然后以無菌水稀釋后涂布于LB固體培養基37℃恒溫培養48 h。挑取2個單菌落于目標板孔靶上,與1 μL輔助基質混勻,自然風干后進行基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS)檢測[15]。儀器參數為: 反射操作模式,正離子檢測,檢測范圍100~2 000 Da,激光點擊數每圖譜50,激光頻率30.0 Hz,離子源加速電壓 20 kV,反射電壓23.5 kV 脈沖離子。
1.4.2 脂肽粗提物的制備
菌株ZJU-3培養:采用LB培養基,100 mL/250 mL三角瓶裝量,28℃、180 r/min恒溫搖床振蕩培養72 h。發酵液經8 000 r/min離心20 min,取上清液用孔徑為0.22 μm無菌過濾器過濾,獲得無菌發酵液。采取鹽酸沉淀和甲醇抽提法從無菌發酵液中獲得脂肽粗提物[16]。
1.4.3 脂肽粗提物對尖孢鐮刀菌菌絲生長的抑制
采用菌絲生長速率法測定脂肽粗提物的生物活性。用甲醇將得到脂肽粗提液依次稀釋為440、 220、110、55 μg/mL,加入到融化的PDA培養基中制成脂肽平板,以加等體積甲醇的PDA平板為對照,在平板中央接種直徑為5 mm的尖孢鐮刀菌菌塊,每個處理重復3次,28℃ 培養4 d。采用十字交叉法測量菌落直徑,計算抑制率[17]。相對抑制率=[(對照菌落直徑-脂肽粗提物處理菌落直徑)/對照菌落直徑]× 100%。
1.5 菌株ZJU-3對多花黃精的促生作用
1.5.1 菌株ZJU-3發酵液中激素種類分析
將菌株ZJU-3接種至固體LB培養基上,28℃培養24 h后,轉接入LB液體培養基內, 37℃ 200 r/min振蕩培養12 h,制成種子液。取種子發酵液按照1%接種量接種100 mL的LB液體培養基中,180 r/min振蕩培養72 h,之后用乙酸乙酯對發酵液進行萃取,旋轉蒸發濃縮,經過0.22 μm濾膜過濾,于4℃保存,用高效液相色譜質譜聯用儀(LC-MS)測定吲哚乙酸(IAA)、激動素(kinetin)、赤霉素(GA3)和玉米素(zeatin)的含量[18]。質譜條件如下:采用電噴霧負/正離子模式,毛細管電壓3.0 kV,霧化氣壓力0.31 MPa,干燥氣體(N2)流速5 L/min,干燥氣體溫度325℃,鞘氣溫度350℃,鞘氣流速11 L/min。采用MRM 模式進行檢測,收集LC-MS如下數據:樣品名稱,保留時間,碰撞解離電壓,母離子(m/z),子離子(m/z),碰撞能量和掃描模式。
1.5.2 盆栽促生試驗
將3年生多花黃精塊莖用0.5%次氯酸鈉表面消毒15 min,無菌水漂洗3~4次,播種于基質(草炭∶蛭石∶珍珠巖=2∶1∶1)中。設置3個處理。A:LB液體培養基灌根;B:1×108cfu/mL拮抗菌液灌根;C:1×107cfu/mL抗菌液灌根。每處理3盆,3個重復,培養條件:25℃,L∥D=16 h∥8 h,觀察多花黃精的生長情況,兩個月后記錄各個生物量的變化。
1.6 數據分析
采用SPSS 20.0統計分析軟件對試驗數據進行單因素方差分析,應用最小顯著差數(LSD)法檢驗差異顯著性。
2 結果與分析
2.1 內生菌的分離及拮抗菌鑒定
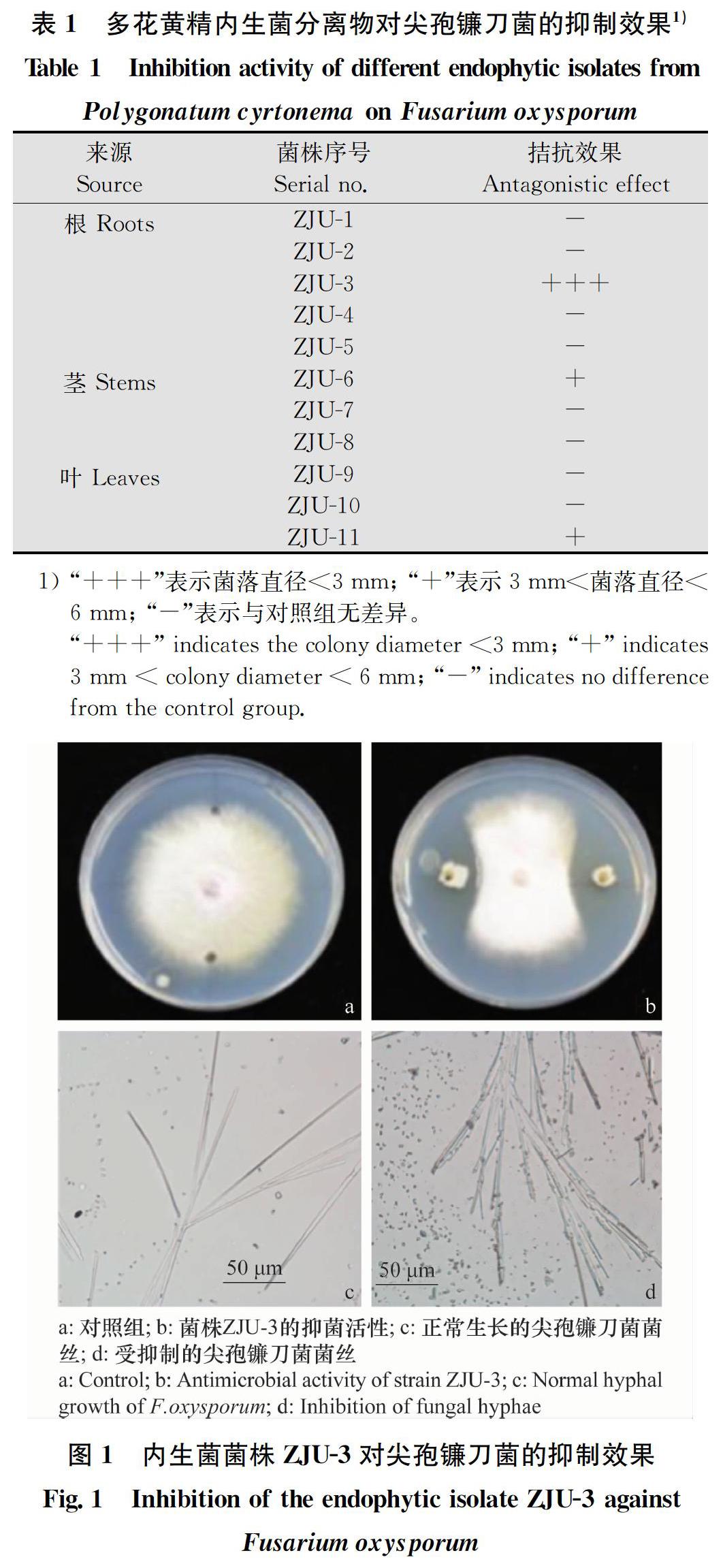
從根、莖、葉中共分離出11株內生菌,分別記作ZJU-1~ZJU-11(表1),采用平板對峙培養法獲得對尖孢鐮刀菌F.oxysporum有較強抑制作用的菌株ZJU-3(圖1),對尖孢鐮刀菌菌落邊緣的菌絲進行觀察,發現處理組的菌絲明顯變粗,菌絲出現斷裂、消融現象,表面出現褶皺,表明該菌株對尖孢鐮刀菌菌絲的生長產生了一定的抑制作用。
2.2 菌株ZJU-3的鑒定
2.2.1 菌株ZJU-3的菌落形態和生理生化特性
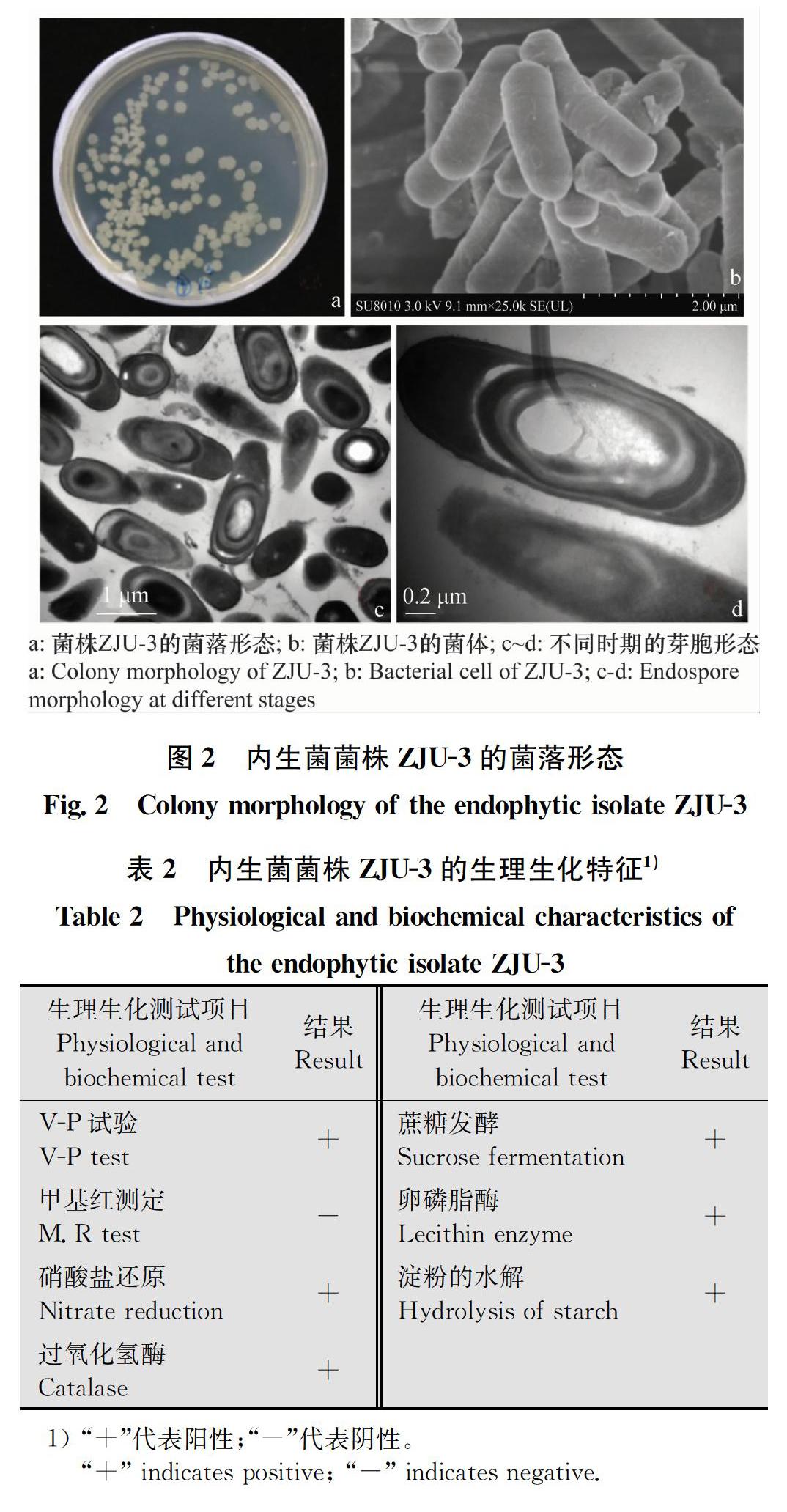
ZJU-3在LB培養基上,28℃下培養24 h后,菌落類似圓形,邊緣不規則,皺褶狀凸起,表面粗糙不透明,干燥,菌落呈淺黃色(圖2a)。掃描電鏡觀察結果顯示,菌體呈桿狀,大小為(0.5~0.7)μm×(1~3)μm(圖2b),芽胞橢圓,中生或端生,長為0.6~1 μm(圖2c~d)。菌株ZJU-3的硫化氫、接觸酶等多項生理生化特征的試驗結果見表2。
2.2.2 菌株ZJU-3的分子生物學鑒定
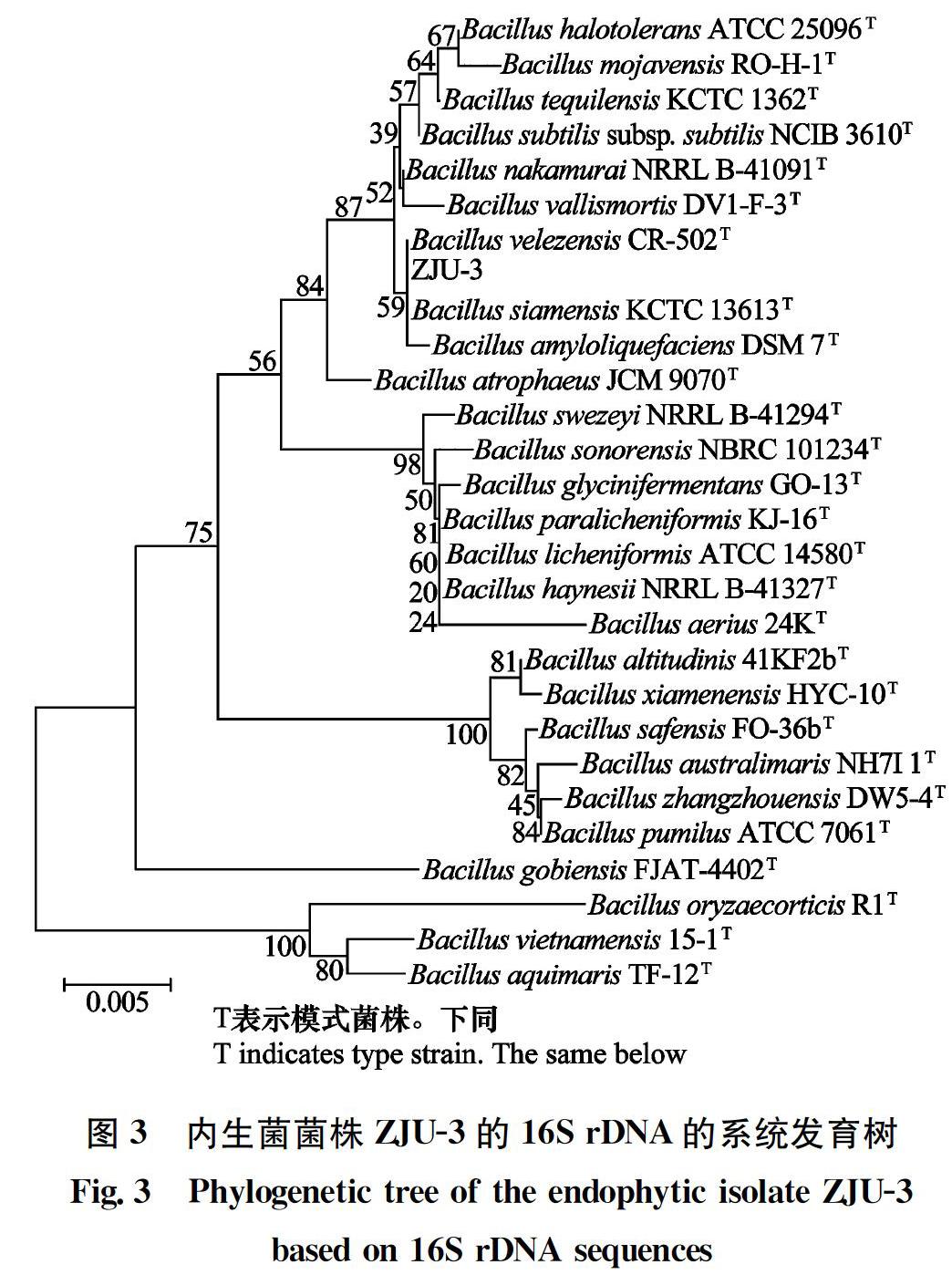
菌株ZJU-3經16S rDNA PCR擴增后,得到1條1 400 bp左右的條帶,膠回收測序后獲得長度為1 425 bp 的DNA序列,將該序列在NCBI上注冊,獲得序列登錄號MH298776。將菌株ZJU-3的16S rDNA序列與GenBank中的序列進行比對,結果表明,ZJU-3與B.velezensis CR-502(GenBank登錄號:AY603658)、B.siamensis KCTC 13613(GenBank登錄號: AJVF01000043)、B.amyloliquefaciens DSM 7(GenBank登錄號:FN597644)的同源性分別為99.85%、99.72% 和99.58%。通過MEGA 5.0構建該菌株的16S rDNA序列系統發育樹,顯示該菌株與這3個菌株在一個分支上,無法確定其分類地位。
菌株ZJU-3經gyrB基因序列的PCR擴增后,得到1條1 147 bp的條帶,該序列與GenBank中B.velezensis strain KACC 13105(GenBank登錄號:NZ_JTKJ02000014.1)、B.siamensis strain XY18(GenBank登錄號:LAGT01000009.1)、 B.amyloliquefaciens DSM7(GenBank登錄號:FN597644)同源性為99%,通過 MEGA 5.0構建該菌株的gyrB序列系統發育樹,結果顯示該菌株與B.velezensis strain KACC 13105在一個分支上。參考《常見細菌系統鑒定手冊》,根據枯草芽胞桿菌B.subtilis和解淀粉芽胞桿菌B.amyloliquefaciens不能產生卵磷脂酶,排除枯草芽胞桿菌和解淀粉芽胞桿菌的可能性。結合形態學及其他生理生化特征,將菌株ZJU-3鑒定為貝萊斯芽胞桿菌(于中國典型培養物保藏中心保藏,保藏編號:CCTCC No: M 2018311)。
2.3 菌株ZJU-3脂肽類化合物分析
2.3.1 MALDI-TOF-MS檢測與分析
圖5a為貝萊斯芽胞桿菌經MALDI-TOF-MS檢測所得的脂肽類次生代謝物的質譜圖(m/z 700~1 500),結果顯示:表面活性素和伊枯草菌素的分子離子峰集中于m/z 1 000~1 100(圖5b);泛革素位于m/z 1 400~1 500(圖5c)。菌株ZJU-3在m/z值為1 053.6、1 069.6、1 066.7、1 083.7、1 081.6、1 097.7、1 095.7、1 111.7、1 099.7(圖5b)處有離子峰,這9個離子峰對應于桿菌霉素的質量;在m/z值為1 066.7、1 082.7、1 080.7、1 094.7、1 098.7(圖5b)處有離子峰,這5個峰對應于伊枯草菌素的質量;在m/z值為1 044.7、1 059.7、1 058.7、1 074.7(圖5b)處有離子峰,這4個峰對應于表面活性素的質量。在m/z值為1 435.0、1 450.0、1 464.0、1 478.0、1 492.0、1 506.0(圖5c)處有離子峰,這6個峰對應于泛革素的質量。
2.3.2 脂肽粗提物對尖孢鐮刀菌菌絲生長的抑制效果
采用酸沉淀和甲醇抽提法從ZJU-3發酵液中提取脂肽物質,進行冷凍干燥后確定該脂肽粗提物的得率為20 mg/mL。尖孢鐮刀菌菌塊在含不同濃度脂肽粗提物的PDA培養基上23℃培養4 d后,與對照相比,供試濃度下ZJU-3脂肽物質對尖孢鐮刀菌菌絲擴展均表現出抑制作用,而且隨著脂肽濃度的增加,其抑制作用增強,440 μg/mL時抑制率為51.6%(圖6e)。
2.4 菌株ZJU-3對多花黃精的促生作用
2.4.1 菌株ZJU-3發酵液中的吲哚乙酸、激動素、赤霉素和玉米素含量測定
通過LC-MS分析,定量測定菌株ZJU-3中吲哚乙酸(IAA)、激動素(kinetin)、赤霉素(GA3)和玉米素(zeatin)的含量。在同樣的色譜條件下,赤霉素標樣在3.28 min有一個色譜峰(如圖7a1),發酵液在保留時間3.88 min有一個色譜峰(如圖7a2),它們的保留時間基本一致,可以確定發酵液中產生了赤霉素,進一步計算得到赤霉素的含量為0.07 ng/mL。
在同樣的色譜條件下,標樣激動素在保留時間2.48 min有一個色譜峰(如圖7b1),發酵液在保留時間2.48 min有一個色譜峰(如圖7b2),它們的保留時間一致,可以確定發酵液中產生了激動素,進一步計算得到激動素的含量為21.34 ng/mL。
在同樣的色譜條件下,標樣玉米素在保留時間1.59 min有一個色譜峰(如圖7c1),發酵液在保留時間1.74 min有一個色譜峰(如圖7c2),保留時間基本一致,可以確定發酵液中產生了玉米素,經過計算,玉米素含量為0.02 ng/mL。
在同樣的色譜條件下,標樣吲哚乙酸在保留時間5.94 min有一個色譜峰(如圖7d1),發酵液在保留時間5.48 min有一個色譜峰(如圖7d2),它們的保留時間基本一致,可以確定發酵液中產生了吲哚乙酸,進一步計算得到吲哚乙酸的含量為8.29 ng/mL。
2.4.2 盆栽促生試驗
多花黃精各項生物量如圖8所示,菌液處理后,多花黃精芽長差異不明顯,但根長、單株根數和芽數差異明顯,菌液處理后,根長、根數都明顯增加,1×108 cfu/mL處理組的多花黃精部分根長、單株根數相比于對照組增長了44.6%、102.4%,1×107 cfu/mL處理組的多花黃精部分根長、單株根數相比于對照組增長了20.7%、64.5%,而處理組根莖上的芽長明顯小于對照組,表明菌株ZJU-3對多花黃精地下部分有更明顯的促生長作用,據此猜想與菌體自身產生的內源激素有著密切的聯系。
3 討論
1993 年美國學者Stierle等[22]從短葉紅豆杉Taxus brevifolia中分離到內生真菌,其可以產生抗癌藥物紫杉醇,這一發現掀起了從藥用植物中分離內生菌的熱潮。人們逐漸開始研究具有重要經濟價值的藥用植物與自身內生菌的關聯。國內有學者研究表明,內生菌對藥用植物生長發育有著巨大影響,植物內生菌自身能夠產生次生代謝物,對病蟲害產生一定程度的抵抗力[23]。Wen等[24]在藥用植物樟腦中發現枯草芽胞桿菌B.subtilis EBS05對小麥紋枯病菌Rhizoctonia cerealis的防治效果高達91.2%,并在該拮抗菌株所產生的抗菌物質中分離得到surfactin A,并研究了該物質對根莖生長的作用。鄧建良等[25]發現解淀粉芽胞桿菌YN-1發酵液對棉花枯萎病有抑制作用,質譜分析發現其發酵液中含有C14-Iturin A~C16-Iturin A、C14-Fengycin A~C17-Fengycin A、C16-Fengycin B和C17-Fengycin B 9種脂肽類抗生素。本試驗采用提取效率更高的酸沉淀法,研究發現B.velezensis ZJU-3能夠產生表面活性素、桿菌霉素、伊枯草菌素、泛革素等多種脂肽類化合物,且440 μg/mL濃度的脂肽粗提液對尖孢鐮刀菌菌絲生長的抑制率達到51.6%,可抑制病原真菌菌絲生長發育,或許在一定程度上破壞了膜結構,后期將針對脂肽粗提液對孢子的影響展開研究。
同時,研究表明,固氮螺菌屬Azospirillum、假單胞菌屬Pseudomonas、芽胞桿菌屬Bacillus、微桿菌屬Microbacterium以及根瘤菌屬Rhizobium等多種內生菌可產生植物生長激素吲哚乙酸[2],促進植物的生長。Lu等[26]發現黃花蒿內生菌在體外培養時,能產生對小麥和黃瓜幼苗生長具有抑制或促進作用的次級代謝產物,對其發酵產物進行深入分析,發現該菌能產生吲哚乙酸。在本研究中發現B.velezensis ZJU-3產生多種植物內源激素如吲哚乙酸、激動素、玉米素,用菌株發酵液對多花黃精植株進行定期澆灌,發現植株的側根明顯增多,根長相比對照組明顯增加,植株營養代謝加快。
已有資料表明,在內生菌與植物長期協同進化的過程中,內生菌可能因與植物之間發生基因橫向轉移或受植物內生環境的影響,具有產生與藥用植物相似結構或相似功效的天然產物、甚至新結構或新活性的天然活性產物的潛力[27]。我國學者已從蛇足石杉Huperzia serrata和柳杉葉馬尾杉Phlegmariurus cryptomerianus中分離到6種以上的產石杉堿甲的內生真菌,其中一株編號為 Slf14 的 Shiraia 屬菌株石杉堿甲產量較高,達到了327.8 μg/L[28]。分離自黃花蒿的青霉屬Penicillium內生真菌能有效促進黃花蒿組培苗生長及青蒿素合成[29]。但對于多花黃精來說,內生菌與藥用黃精成分的相關性還需進一步深入研究。
綜上所述,本研究獲得的多花黃精內生貝萊斯芽胞桿菌菌株ZJU-3不但產生多種抗菌的脂肽類化合物,同時產生多種植物內源激素,對多花黃精具有良好的促生長效果,尤其促進植株生根,以上研究為未來該菌株的綜合開發利用及研制生防藥劑提供了理論依據。
參考文獻
[1] HALLMANN J, KLOEPPER J W, MAHAFFEE W F, et al.Bacterial endophytes in agricultural crops [J].Canadian Journal of Microbiology, 1997, 43(10): 895914.
[2] 喻江, 于鎮華, 劉曉冰, 等. 植物根組織內生細菌多樣性及其促生作用[J]. 中國農學通報, 2015, 31(13): 169175.
[3] MNASRI N, CHENNAOUI C, GARGOURI S, et al. Efficacy of some rhizospheric and endophytic bacteria in vitro and as seed coating for the control of Fusarium culmorum infecting durum wheat in Tunisia[J]. European Journal of Plant Pathology, 2017, 147(3): 501515.
[4] AHMAD F, AHMAD I, KHAN M S. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities [J].Microbiological Research,2008,163(2):173181.
[5] HASSAN E D.Plant growth-promoting activities for bacterial and fungal endophytes isolated from medicinal plant of Teucrium polium L.[J]. Journal of Advanced Research, 2017, 8(6): 687695.
[6] EGAMBERDIEVA D, WIRTH S J, SHURIGIN V V. Endophytic bacteria improve plant growth, symbiotic performance of chickpea (Cicer arietinum L.) and induce suppression of root rot caused by Fusarium solani under salt stress [J]. Frontiers in Microbiology, 2017, 8: 1887.
[7] HAN Qin, WU Fengli, WANG Xiaonan, et al. The bacterial lipopeptide iturins induce Verticillium dahliae cell death by affecting fungal signaling pathways and mediate plant defence responses involved in pathogen-associated molecular pattern-triggered immunity [J]. Environmental Microbiology, 2015, 17(4): 11661188.
[8] 國家藥典委員會.中華人民共和國藥典[S].北京:中國科技醫藥出版社,2015:306307.
[9] 李艷玲,王德才,史仁玖,等.泰山黃精內生真菌的分離鑒定及抑菌活性研究[J].中草藥,2013,44(11):14901494.
[10]汪瀅,王國平,王麗薇,等.一株多花黃精內生真菌的鑒別及其抗菌代謝產物[J].微生物學報,2010,50(8):10361043.
[11]柏曉輝,劉孝蓮,劉娣,等.一株黃精內生菌的分離鑒定及抑菌活性研究[J].天然產物研究與開發,2018,30(5):777782.
[12]方中達.植病研究方法[M].第2版.北京:中國農業出版社,1998.
[13]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
[14]YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains [J].Applied Environmental Microbiology, 1995, 61(3): 11041109.
[15]李興玉,毛自朝,吳毅歆,等.芽孢桿菌環脂肽類次生代謝產物的快速檢測[J].植物病理學報,2014,44(6):718722.
[16]呂倩,胡江春,王楠,等.南海深海甲基營養型芽孢桿菌SHB114抗真菌脂肽活性產物的研究[J].中國生物防治學報,2014,30(1):113120.
[17]魏新燕,黃媛媛,黃亞麗,等.甲基營養型芽孢桿菌BH21對葡萄灰霉病菌的拮抗作用[J].中國農業科學,2018,51(5):883892.
[18]WANG Beibei, SHEN Zongzhuan, ZHANG Fengge, et al. Bacillus amyloliquefaciens strain W19 can promote growth and yield and suppress Fusarium wilt in banana under greenhouse and field conditions [J]. Pedosphere, 2016, 26(5): 733744.
[19]ONGENA M, JACQUES P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol [J].Trends in Microbiology, 2008, 16(3): 115125.
[20]CHEN Xiaohua, KOUMOUTSI A, SCHOLZ R, et al. More than anticipated-production of antibiotics and other secondary metabolites by Bacillus amyloliquefaciens FZB42 [J]. Journal of Molecular Microbiology and Biotechnology, 2009, 16(1/2): 1424.
[21]LI Xingyu, MAO Zichao, WANG Yuehu, et al. Diversity and active mechanism of fengycin-type cyclopeptides from Bacillus subtilis XF-1 against Plasmodiophora brassicae [J]. Journal of Microbiology and Biotechnology, 2013, 23(3): 313321.
[22]STIERLE A, STROBLE G, STIERLE D, et al. Taxol and taxane production by Taxomycetes andreanae, an endophytic fungus of pacific yew [J].Science,1993,260(5105):214216.
[23]FAHEEM M, RAZA W, ZHONG W, et al. Evaluation of the biocontrol potential of Streptomyces goshikiensis YCXU against Fusarium oxysporum f.sp. niveum [J].Biological Control,2015, 81(10): 101110.
[24]WEN Caiyi, YIN Zhigang, WANG Kaixuan, et al. Purification and structural analysis of surfactin produced by endophytic Bacillus subtilis EBS05 and its antagonistic activity against Rhizoctonia cerealis[J]. Plant Pathology Journal, 2011, 27(4): 342348.
[25]鄧建良,劉紅彥,劉玉霞,等.解淀粉芽孢桿菌YN-1抑制植物病原真菌活性物質鑒定[J].植物病理學報,2010,40(2):202209.
[26]HONG Lu, ZOU Wenxin, MENG Juncai, et al. New bioactive metabolites produced by Colletotrichum sp. an endophytic fungus in Artemisia annua[J]. Plant Science, 2000, 151(1): 6773.
[27]譚小明,周雅琴,陳娟,等.藥用植物內生真菌多樣性研究進展[J].中國藥學雜志,2015,50(18):15631580.
[28]孫劍秋,郭良棟,臧威,等.藥用植物內生真菌及活性物質多樣性研究進展[J].西北植物學報,2006,26(7):15051519.
[29]袁亞菲,董婷,王劍文.內生青霉菌對黃花蒿組培苗生長和青蒿素合成的影響[J].生物資源,2011,33(4):14.
(責任編輯:田 喆)

