辣椒膠孢炭疽菌遺傳轉化體系的建立
曾泉 滿益龍 陳岳 張鑫 張卓 李成剛 杜嬌 張德詠 劉勇 譚新球

摘要 由辣椒膠孢炭疽菌Colletotrichum gloeosporioides導致的辣椒炭疽病是辣椒生產上最為嚴重的真菌病害之一。本文以辣椒膠孢炭疽菌CSLL11為供試菌株,采用PEG-CaCl2介導的原生質體轉化法,將含有潮霉素B抗性基因和eGFP表達基因的DNA片段成功轉入辣椒膠孢炭疽菌的原生質體中,獲得了穩定表達綠色熒光的轉化子,從而成功建立了辣椒膠孢炭疽菌的遺傳轉化體系。試驗結果表明,可有效篩選陽性轉化子的潮霉素B濃度為500 mg/L;PCR及Southern blot結果顯示,eGFP表達基因已單拷貝整合至辣椒膠孢炭疽菌轉化子的基因組中;使用熒光顯微鏡觀察第一代及繼代培養后的轉化子,菌絲與分生孢子均表現出強烈的綠色熒光信號,說明GFP能在轉化子中穩定遺傳;將轉化子與野生型菌株相比,菌落形態、生長速率及致病力水平無明顯差異。本研究建立了辣椒膠孢炭疽菌遺傳轉化體系并獲得了穩定表達綠色熒光蛋白的轉化子,對辣椒炭疽菌與寄主互作的研究及病害防治具有重要意義。
關鍵詞 辣椒炭疽病菌; 遺傳轉化; GFP; 生長; 致病性
中圖分類號: S 436.418
文獻標識碼: A
DOI: 10.16688/j.zwbh.2019037
辣椒為茄科辣椒屬的一年生草本植物[1],是我國種植面積最大的蔬菜作物之一,目前種植面積已經超過146.7萬hm2[2]。辣椒炭疽病是辣椒生產上最為嚴重的真菌病害之一,分布廣,危害重,傳播快,可引起辣椒幼苗死亡、落葉和果實腐爛,嚴重影響辣椒的產量和品質[35]。
辣椒炭疽病的病原菌為膠孢炭疽菌Colletotrichum gloeosporioides,屬于半知菌亞門刺盤孢屬真菌[6]。類似于其他真菌,炭疽菌在冬天或者環境脅迫條件下能產生大量的微菌核在土壤中休眠,待條件適宜時,微菌核產生大量孢子,經過雨水傳播到寄主表面,一旦孢子接觸寄主后,萌發形成附著胞,病原菌借助其巨大的膨壓穿透寄主表皮,然后在寄主細胞內形成侵染菌絲再擴展到相鄰細胞,形成病斑,同時在病斑上產生大量的孢子,開始下一輪的侵染[7]。盡管炭疽病菌的侵染循環已然明了,但由于炭疽菌種類繁多,同屬不同種的炭疽病菌間生物學性狀差異巨大,膠孢炭疽菌各寄主專化型與相應寄主間的互作機制復雜,因此辣椒膠孢炭疽菌的致病機理還不清楚,其與寄主的互作機理尚不明確,因此,有必要針對辣椒膠孢炭疽菌建立一套有效的研究體系。遺傳轉化是研究病原菌生長發育與致病分子機制的基本方法和手段。在前期對炭疽菌的研究中,包括PEG-CaCl2介導的原生質體轉化技術[89]、根癌農桿菌介導的孢子轉化技術[1011],以及電穿孔轉化法[12]在內的遺傳轉化操作已得到廣泛的應用,但是由于膠孢炭疽菌各寄主專化型間培養性狀方面存在較大差異,因此以上轉化體系在辣椒炭疽病菌上還未得到成功應用。因此,建立一套高效、穩定的辣椒炭疽病菌遺傳轉化體系,有助于進一步深入研究其生物學、致病分子機理以及挖掘潛在的藥劑分子靶標,為辣椒炭疽病的防治提供理論依據。
1 材料與方法
1.1 試驗材料
1.1.1 菌株及質粒
辣椒炭疽病菌菌株CSLL11分離自湖南省長沙縣榔梨鎮,采集典型癥狀標本,經單孢分離,病原鑒定后保存備用。含潮霉素B抗性的質粒SK1044由江蘇省農業科學院劉永鋒研究員饋贈。
1.1.2 培養基
PDA培養基:購自索萊寶Solarbio公司制備的不含抗生素的馬鈴薯葡萄糖培養基,46 g于1 L ddH2O,溶解,121℃高壓滅菌20 min。
TB3培養基:酵母提取物3 g,酸水解酪蛋白3 g,蔗糖200 g,加ddH2O定容至1 L,121℃高壓滅菌20 min,固體培養基加瓊脂1.5 g/200 mL(m/V)。
1.1.3 試劑
裂解酶(lysing enzyme)、聚乙二醇(PEG)和潮霉素(hygromycin B)購自美國Sigma aldrich公司。
1×STC緩沖液:蔗糖100 g,Tris-HCl(50 mmol/L) 3.028 5 g(pH=8.0),CaCl2(50 mmol/L)2.774 5 g;加ddH2O至500 mL,121℃高壓滅菌20 min。
PTC緩沖液:稱量PEG 4000 120 g,溶解于1×STC緩沖液中,定容至200 mL,121℃高壓滅菌20 min。
5×YEG:酵母提取物5 g,葡萄糖10 g,加ddH2O溶解,定容至1 L,121℃高壓滅菌20 min。
酶解液配制:細胞壁破壁酶0.3 g,完全溶解于0.7 mol/L NaCl后定容至30 mL,用0.22 μm細菌過濾器過濾除菌。
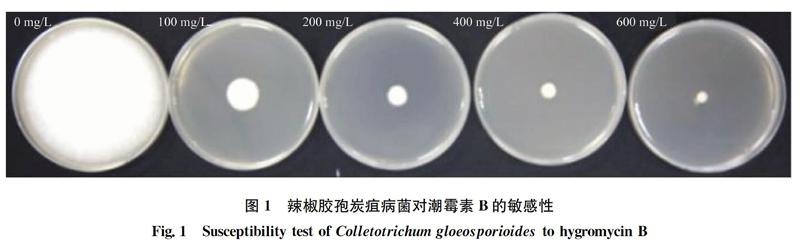
1.2 辣椒膠孢炭疽病菌對潮霉素的敏感性測定
將辣椒膠孢炭疽病菌菌株CSLL11接種在PDA培養基培養5 d后,用打孔器沿菌落邊緣打取菌絲塊,轉接到潮霉素濃度分別為0、100、200、400 mg/L和600 mg/L的PDA平板上, 26℃恒溫培養箱中培養7 d,觀察生長情況,每個濃度設置3次重復。
1.3 辣椒膠孢炭疽病菌的遺傳轉化
1.3.1 原生質體的制備
培養由單個分生孢子再生的菌落,切取菌絲塊于PDA平板上生長1~2 d,切取菌絲塊,盡量切碎,置于約80 mL 5 × YEG的液體培養基中,28℃、150 r/min振蕩培養16 h;用1~2層Miracloth過濾收集菌絲,無菌水沖洗兩遍,用吸水紙將殘留水分吸干,將菌絲置于盛有25 mL酶液的50 mL離心管中酶解。離心管水平放置,30℃、60 r/min振蕩1.5~2 h酶解;向酶解液內加少許0.7 mol/L NaCl溶液,輕輕搖晃,使用三層滅菌擦鏡紙過濾,用0.7 mol/L NaCl溶液輕輕沖洗1~2次,去殘渣,收集濾液于50 mL離心管中,3 600 r/min、4℃離心10 min;小心棄上清,加10~20 mL 1×STC懸浮沉淀,用剪去尖頭的槍頭輕輕吹打,然后3 000 r/min、4℃離心5 min,重復上述步驟兩次,加適量(約300 μL)1×STC溶液懸浮,計數,使原生質體終濃度為108個/mL,分裝為150 μL/管,立即進行轉化操作。
2.4 GFP轉化菌株及野生型菌株的生物學特性差異
2.4.1 GFP轉化菌株及野生型菌株的生長情況
采用菌餅法檢測菌株生長速率,并利用搖菌法進行產孢量試驗。試驗結果表明轉化菌株與野生型菌株菌落形態及生長速率無明顯差異(表1)。轉化菌株平均產孢量為0.8×105~1.8×105個/mL,野生型菌株的產孢量為0.8×105~1.4×105個/mL,沒有明顯差異。
2.4.2 GFP轉化菌株的致病性測定
以5×105個/mL 分生孢子接種辣椒果實進行致病性測定,接種6 d后調查致病情況。結果表明,轉化菌株及野生型菌株接種的辣椒均出現向內凹陷的病斑,而未接種病原菌的對照未發病(圖6)。
3 討論
PEG-CaCl2介導的原生質體轉化方法具有轉化效率高、操作簡便、體系成熟等特點,在稻瘟病菌、禾谷鐮刀菌等絲狀真菌遺傳轉化研究中應用非常成熟[1314],在楊樹、蘋果、梨炭疽菌的遺傳操作中也有報道,但是在辣椒炭疽病菌中還未報道。膠孢炭疽菌寄主繁多,病菌根據寄主范圍而分化為各種類型,各專化型間培養性狀、形態及致病力水平存在較大差異。本研究在前期膠孢炭疽菌轉化體系的基礎上,進一步對辣椒炭疽病菌的轉化條件摸索優化,通過PEG-CaCl2介導的原生質體轉化方法把含GFP序列的DNA片段轉入到辣椒炭疽菌中,并且獲得穩定的綠色熒光表達菌株,從而在辣椒炭疽菌中成功建立了高效、穩定的遺傳轉化體系,為后續研究奠定了基礎。
原生質體的制備在辣椒炭疽菌遺傳轉化的過程中起著關鍵作用,其質量和數量直接影響轉化的效率,而菌株專化型、菌株培養時間等因素均決定著原生質體的質量。辣椒炭疽菌在固體平板及液體培養條件下均易產生分生孢子,當大量分生孢子混雜在原生質體中時,不僅會導致轉化效率降低,還會影響轉化子的再生。在梨炭疽病菌中,分生孢子在CM液體培養基生長至24 h后,繼續轉接到新的CM液體培養基中擴培24 h[9],而本研究縮短了培養時間,新鮮菌絲塊置于5×YEG的液體培養基中振蕩培養16 h后即用于轉化,從而避免了分生孢子對轉化過程的影響。
目前,真菌遺傳操作過程中的選擇標記有潮霉素、博萊霉素、G418等,為真菌的基因轉入、敲除提供了多種選擇[1516]。本研究在尚不明確辣椒炭疽菌對潮霉素B敏感性的前提下,首先開展了潮霉素B的敏感性測定,經檢測發現當潮霉素B濃度為500 mg/L時,能顯著抑制辣椒炭疽菌的生長,表明此濃度適合作為遺傳轉化選擇濃度。
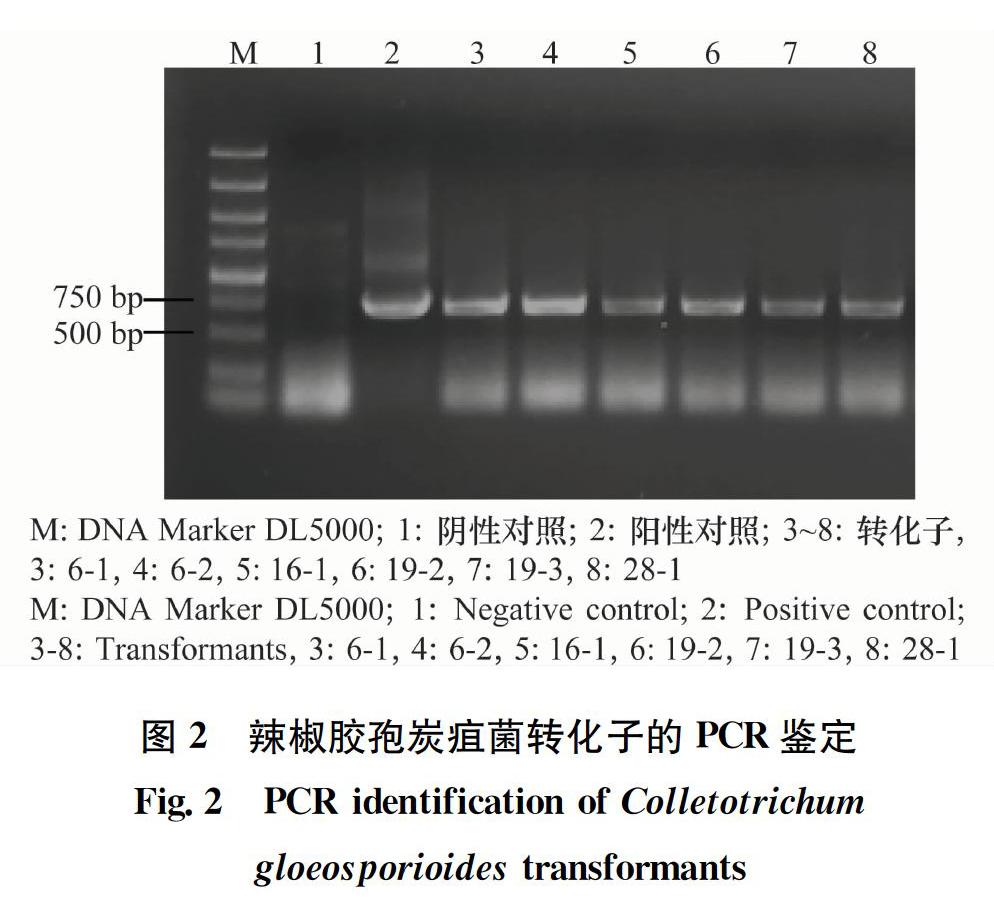
本研究所用的轉化片段以農桿菌質粒SK1044為模板擴增獲得,含有增強型綠色熒光蛋白GFP及來源于異旋孢腔菌的強啟動子GPDh,目前SK1044表達載體多在鐮刀菌中使用[17],本研究首次在辣椒炭疽菌中使用了該啟動子,獲得的轉化菌株熒光強度高且較一致,說明GPDh啟動子可以在辣椒炭疽菌中高水平啟動目的基因的表達。此外,本研究轉化過程中使用的是含有T-DNA上下臂、GFP基因及hygR基因的DNA片段,相比轉化質粒更加方便且陽性率達到了100%。
在辣椒炭疽病菌遺傳轉化體系成功建立的同時發現,轉化子通過3代培養仍可以表達出明亮綠色熒光,說明GFP基因已整合至轉化子基因組中并且能夠穩定遺傳。同時,考慮到PEG介導的轉化方法具有隨機插入的特點,我們對獲得的轉化子進行了Southern blot驗證,所選的6個轉化子均為單拷貝插入,單拷貝插入比例達到100%。在對其生長和致病過程中的研究發現,盡管轉入了外源片段,但是轉化子的生物學表型與野生型較為一致,表明轉入的GFP片段并不影響辣椒炭疽菌自身的生長發育,因此可用于后續研究辣椒炭疽菌與寄主互作關系。
本研究摸索了辣椒炭疽病菌的原生質體轉化條件,建立了高效、穩定的PEG-CaCl2介導的辣椒炭疽病菌遺傳轉化體系,通過轉入綠色熒光表達基因獲得帶有綠色熒光標記的轉化菌株,并且其生長形態、生長速率及致病性與原始菌株沒有差異,該結果將為挖掘辣椒炭疽病菌致病相關基因提供強大的技術支持,從而為后續的辣椒炭疽菌與寄主互作的機制研究奠定了良好基礎。
參考文獻
[1] 張莉.促進辣椒產業進一步發展——我國辣椒制品行業現狀及發展趨勢[J].產品可靠性報告,2008,10:3637.
[2] 黃任中,黃啟中,呂中華,等.我國干制辣椒產業現狀及發展對策[J].中國蔬菜,2015(2):911.
[3] 汪愛娥,丁克堅,馬珂.辣椒炭疽病的研究進展[J].安徽農業科學,2005,33(3):508509.
[4] 郭明程,李保同,湯麗梅,等.爵床提取物對辣椒炭疽病菌的抑制作用及其苗期防效[J].植物保護,2013,39(4):119123.
[5] 胡彬,王曉青,梁鐵雙.辣椒主要病蟲害化學防治技術[J].中國蔬菜,2017(4):8792.
[6] 孫春英,毛勝利,張正海,等.辣椒抗炭疽病遺傳與育種研究進展[J].園藝學報,2013,40(3):579590.
[7] THAN P P, PRIHASTUTI H, PHOULIVONG S, et al. Chilli anthracnose disease caused by Colletotrichum species [J]. Journal of Zhejiang University-Science B, 2008, 9(10):764778.
[8] 李思蒙,王永林,黃冬輝,等.楊樹炭疽病菌原生質體遺傳轉化的建立及綠色熒光蛋白的表達[J].林業科學,2013,49(5):121127.
[9] 杜艷,劉永鋒,常有宏,等.梨炭疽病菌原生質體遺傳轉化體系的建立及GFP標記菌株的獲得[J].江蘇農業學報,2017,33(2):295300.
[10]林春花,劉先寶,蔡吉苗,等.橡膠樹尖孢炭疽菌綠色熒光蛋白(GFP)標記轉化株的獲得[J].熱帶作物學報,2009,30(10):14951500.
[11]LIN C H, CAI Z Y, SHI T, et al. The use of T-DNA tagging to isolate mutants of Colletotrichum gloeosporioides and Colletotrichum acutatum with reduced virulence against Hevea brasiliensisa[J]. Forest Pathology, 2013, 43(4):289296.
[12]ARMESTO C, MAIA F G M, DE ABREU M S, et al. Genetic transformation with the gfp gene of Colletotrichum gloeosporioides isolates from coffee with blister spot [J]. Brazilian Journal of Microbiology, 2012, 43(3):12221229.
[13]SWEIGARD J A, CHUMLEY F G, VALENT B. Disruption of a Magnaporthe grisea cutinase gene [J]. Molecular & General Genetics, 1992, 232(2):183.
[14]GU Qin, ZHANG Chengqi, LIU Xin, et al. A transcription factor FgSte12 is required for pathogenicity in Fusarium graminearum [J].Molecular Plant Pathology,2015,16(1):113.
[15]ZHOU Xiaoying, LI Guotian, XU Jinrong. Efficient approaches for generating GFP fusion and epitope-tagging constructs in filamentous fungi [J]. Methods in Molecular Biology, 2011, 722:199212.
[16]ZHOU Xiaoying, LIU Wende, WANG Chenfang, et al. A MADS-box transcription factor MoMcm1 is required for male fertility, microconidium production and virulence in Magnaporthe oryzae [J]. Molecular Microbiology, 2011, 80(1):3353.
[17]趙芹,張向向,鄧淵鈺,等.莖基腐亞洲鐮孢菌侵染抗感小麥品種的組織病理學觀察[J].植物病理學報,2017(2):6272.
(責任編輯:田 喆)

