1,2,4-苯三甲酸與 2,2-聯吡啶構筑的銀(Ⅰ)和鎘(Ⅱ)配合物的合成、晶體結構、熱穩定性及熒光性質
楊洪利 陳 芳 張 丹 賀 雄 張秀清
(桂林理工大學化學與生物工程學院,廣西電磁化學功能重點實驗室,桂林 541004)
過渡金屬配合物可以在光、電、磁、氣體吸附與儲存以及生物醫藥等方面發揮重大的作用[1-10],因此它一直受到眾多科學研究者的關注。羧基是構筑過渡金屬配合物的重要官能團之一,其可以通過單齒、螯合和橋聯等多種配位方式來構筑多種結構,因此羧酸配體是重要的過渡金屬配合物構筑單元,也受到了研究者們的高度重視。此外,有機羧酸配體的構象靈活性對最終結構的維數和拓撲結構的確定也起著決定性的作用。
具有多種配位模式的有機多羧酸配體是構建配合物的優良選擇,因為它們可以用于設計與合成從零維到多維等多種空間結構類型的晶體,其結構的復雜性與多樣性受到了廣泛關注[11-12]。之前我們曾報道了使用 1,2,4-苯三甲酸(H3btc)作為主配體,通過pH調控的水熱合成法合成出了一種一維鏈狀結構Mn(Ⅱ)配合物,并探討了它的熒光與磁性性質[13]。作為工作的延續,我們又陸續合成出了2種新穎的基于 H3btc的配合物[Ag(H2btc)(bpy)](1)和[Cd(Hbtc)(bpy)(H2O)2]n(2)(bpy=2,2′-聯吡啶),并用 X 射線單晶衍射儀測定了晶體結構,對其進行了紅外光譜、熱重分析以及熒光性質的研究。
1 實驗部分
1.1 試劑與儀器
試劑包括H3btc(AR,鄭州阿爾法化工有限公司),bpy、八水合硫酸鎘(AR,成都市科龍化工試劑廠),硝酸銀(AR,廣州市金珠江化學有限公司立新化工廠),三乙胺(AR,西隴化工股份有限公司)。
所用儀器有Agilent G8910A CCD單晶衍射儀,美國安捷倫公司;Spectrum One FT-IR Spectrometer傅里葉變換紅外光譜儀,KBr壓片,美國PerkinElmer公司;TGA Q600熱重分析儀,日本TA公司;F-4600熒光光譜儀,日本Hitachi公司。
1.2 配合物的合成
1.2.1 配合物[Ag(H2btc)(bpy)](1)的合成
稱取 H3btc(0.2 mmol,0.042 0 g)、bpy(0.2 mmol,0.031 2 g)、 硝 酸 銀(0.2 mmol,0.033 9 g)加 入 到 25 mL的帶有聚四氟乙烯襯底的水熱反應釜中,并加入15 mL蒸餾水,以及滴加2滴三乙胺,將反應釜放入393 K烘箱中反應72 h。自然降溫,冷卻后開釜,得到白色粒狀晶體。產率為38%(以金屬原子Ag為基準)。 元素分析按 C19H13AgN2O6計算值(%):C 48.18,N 5.92,H 2.75;實驗值(%):C 48.27,N 5.86,H 2.71。IR(KBr,cm-1):3 441(b),1 707(s),1 660(w),1 585(m),1 547(m),1 468(s),1 370(s),1 234(m),1 180(m),905(w)。
1.2.2 配合物[Cd(Hbtc)(bpy)(H2O)2]n(2)的合成
稱取 H3btc(0.2 mmol,0.042 0 g)、bpy(0.2 mmol,0.031 2 g)、八水合硫酸鎘(0.2 mmol,0.153 8 g)加入到25 mL的帶有聚四氟乙烯襯底的水熱反應釜中,并加入15 mL蒸餾水,以及滴加3滴三乙胺,將反應釜放入393 K烘箱中反應72 h。自然降溫,冷卻后開釜,過濾靜置1個月后得到無色針狀晶體。產率為31%(以H3btc為基準)。元素分析按C19H16CdN2O8計算值(%):C 44.47,N 5.46,H 3.12;實驗值(%):C 44.39,N 5.49,H 3.17。IR(KBr,cm-1):3 417(b),3 159(b),1 588(m),1 479(w),1 436(w),1 370(m),1 120(s),768(m),650(w),618(w)。
1.3 配合物的晶體結構測定
晶體的X射線衍射數據收集采用美國Agilent Technologies公司的G8910A CCD面探單晶衍射儀。在常溫情況下,用 Mo Kα 輻射(λ=0.071 073 nm),以ω掃描的方式來收集所有衍射點數據,使用CryAlis pro程序還原原始數據,全部數據均進行Lp因子校正和經驗吸收校正[14-15]。先用SHELXS[16a]中的直接法解出粗結構,再用SHELXL程序[16b]對非氫原子坐標及其各向異性溫度因子進行全矩陣最小二乘法精修[16c]。所有氫原子坐標均由理論加氫而得。整個結構修正過程在OLEX2[17]平臺上完成。配合物1和2的晶體參數表見表1,主要的鍵長鍵角見表2。
CCDC:1872165,1;1872166,2。
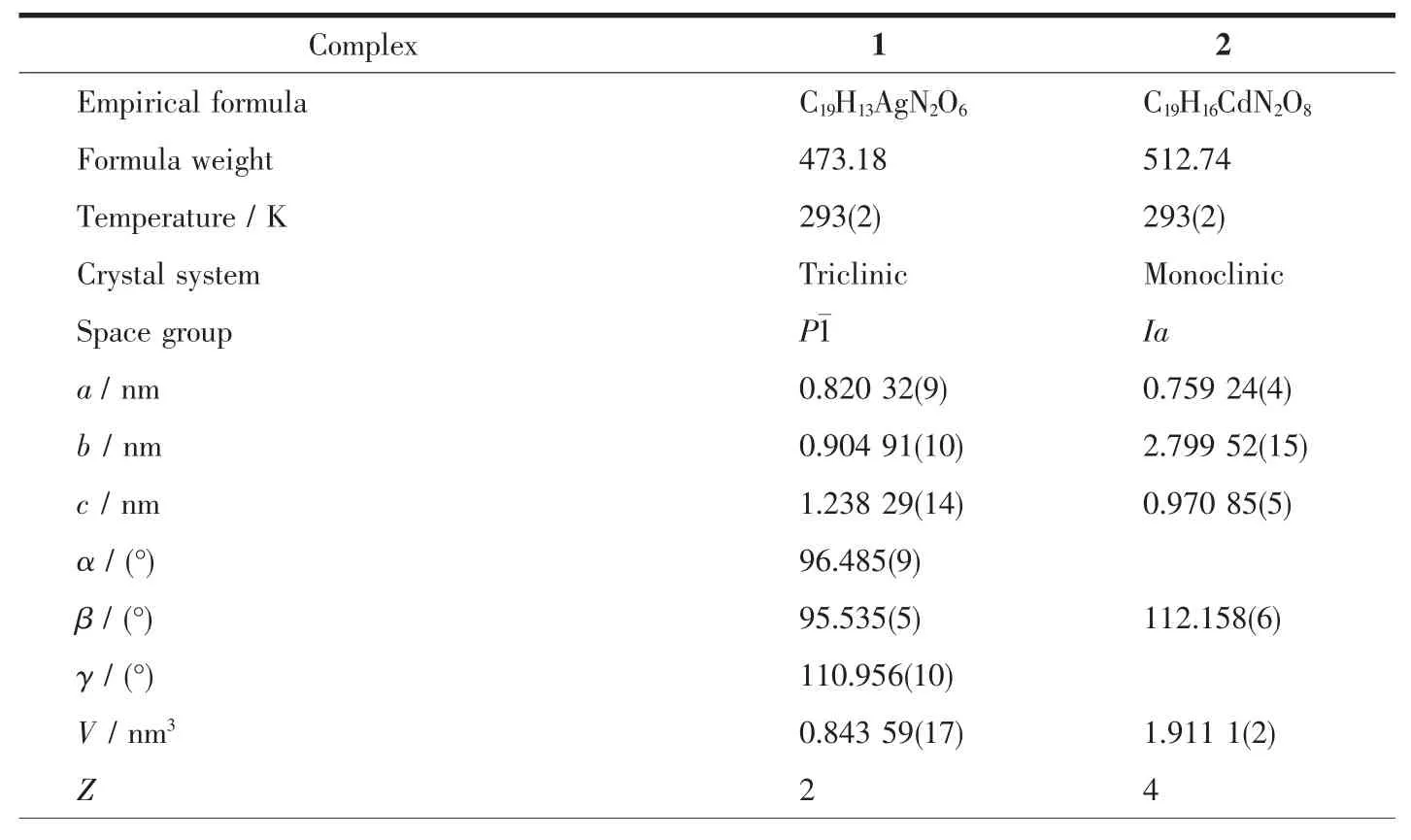
表1 配合物1和2的晶體學和結構修正數據Table 1 Crystallography and structure parameters of complexes 1 and 2
2 結果與討論
2.1 配合物的晶體結構描述
2.1.1 配合物1的晶體結構描述
配合物1的分子結構如圖1所示。晶體結構解析表明,其最小結構單元包含1個Ag(Ⅰ)離子,1個H2btc-和1個bpy中性分子。僅脫去1個質子的H2btc-通過1個羧基氧原子單齒配位,中性bpy配體通過2個氮原子雙齒螯合配位。Ag1分別與來自H2btc-的1個氧原子(O1)和1個bpy中性分子的2個氮原子(N1,N2)配位,3個配位原子在Ag1周圍形成了平面三角形構型。
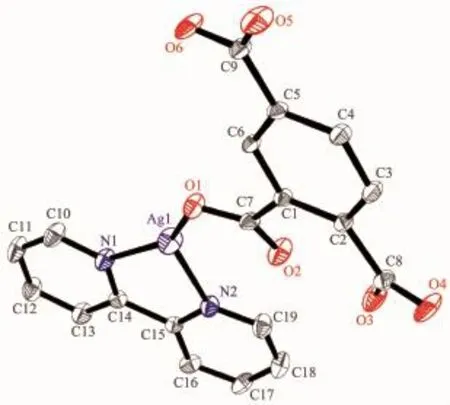
圖1 配合物1的結構圖Fig.1 Crystal structure of complex 1

表3 配合物1的氫鍵鍵長和鍵角Table 3 Hydrogen bond parameters of complex 1
由圖2所示,在三維空間結構中,分子與分子之間存在一定程度的π…π堆積作用,由相互平行的Cg(1)環(由C1-C2-C3-C4-C5-C6組成的苯環)與Cg(2)環(由C1i-C2i-C3i-C4i-C5i-C6i組成的苯環)之間形成(Symmetry code:i-x,1-y,2-z)。 其中,Cg(1)環的質心坐標為:-0.069 00,0.634 7,0.917 0,Cg(2)環的質心坐標為:0.069 00,0.365 3,1.083 0,環中心之間的距離為0.375 5 nm,二面角為0°。另外,如圖3所示,配合物1分子之間還存在著大量的氫鍵作用,氫鍵鍵長鍵角如表3所示。這些相互作用構筑了該配合物的三維空間結構。赤道平面平均偏離0.014 0 nm。
如圖5所示,通過Hbtc2-的雙齒橋聯的作用,配合物2形成了一維鏈狀結構,鏈內鄰近Cd…Cd之間的距離為0.759 2 nm。另外,鏈與鏈之間通過未脫去質子的羧基以及配位水分子等形成弱的氫鍵作用,和范德華力等相互作用力構建了配合物2的三維空間結構(圖6),氫鍵的鍵長鍵角表如表4所示。
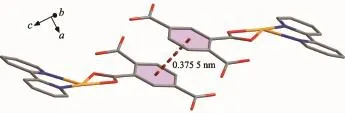
圖2 配合物1分子間的π…π堆積相互作用Fig.2 π…π stacking interaction between molecules of complex 1

圖3 配合物1的三維堆積圖Fig.3 Three-dimensional packing diagram of complex 1
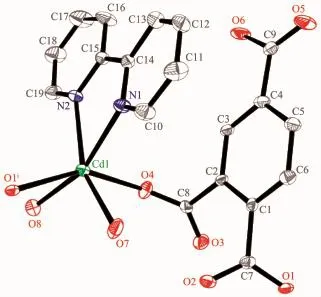
圖4 配合物2的結構圖Fig.4 Crystal structure of complex 2
2.1.2 配合物2的晶體結構描述
配合物2的分子結構如圖4所示。晶體結構解析表明,其最小結構單元包含1個Cd(Ⅱ)離子,1個Hbtc2-,1個bpy中性分子和2個配位水分子。脫去2個質子的Hbtc2-的羧基采用單齒配位的方式,中性bpy配體通過2個氮原子雙齒螯合配位。Cd1分別與Hbtc2-羧基的2個氧原子 (O1i,O4),1個 bpy中性分子的 2個氮原子(N1,N2)和 2個水分子(O7,O8)配位,6個配位原子構成了畸變的八面體構型,O7,O8,N1,N2組成赤道平面,O1A和O4呈軸向分布,
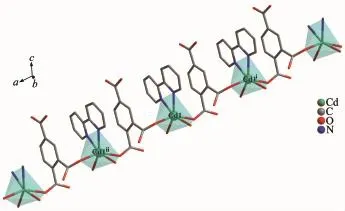
圖5 配合物2的一維鏈狀結構Fig.5 One-dimensional chain structure of complex 2

表4 配合物2的氫鍵鍵長和鍵角Table 4 Hydrogen bond lengths(nm)and bond angles(°)of complex 2
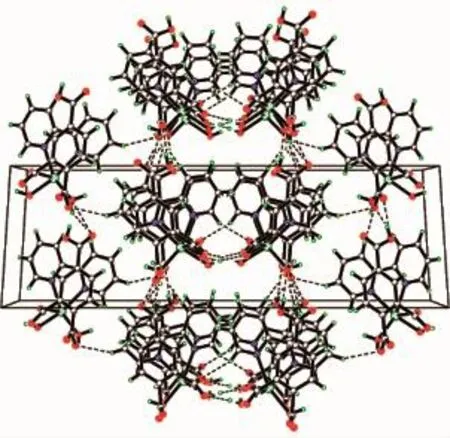
圖6 配合物2的三維堆積圖Fig.6 Three-dimensional packing diagram of complex 2
2.2 紅外光譜
根據有機羧酸類配合物的紅外光譜可以對其羧基的配位方式進行判斷[18-19]。結果如圖7所示。對于1和2,在3 441、3 448 cm-1均有一個非常寬的吸收帶,這是形成氫鍵而締合的-OH伸縮振動。配合物1 的-COOH 特 征 峰 νas(OCO)、νs(OCO)分 別 出 現 在1 585、1 370 cm-1處,其中 Δν(νas(OCO)-νs(OCO))=215 cm-1,說明配合物1中的羧基存在單齒配位的方式[20]。苯環的伸縮振動出現在1 468 cm-1,-C=O的伸縮振動、-C-O的伸縮振動分別出現在1 707和1 234 cm-1[21]。配合物2的-COOH特征峰νas(OCO)和νs(OCO)分別出現在1 588和1 370 cm-1處,其中Δν(νas(OCO)-νs(OCO))=218 cm-1,說明配合物 2 中的羧基也存在單齒配位的方式。3 159 cm-1處的峰為C-H的伸縮振動,而-C-O的伸縮振動出現在1 120 cm-1處。
2.3 配合物1和2的熱穩定性分析
為了測定配合物1和2的熱穩定性,在流速為10 mL·min-1的N2保護下對其進行熱重測試,升溫速率為10 K·min-1,測試溫度范圍從293~1 173 K。從圖8可以看出,配合物1從460 K左右開始,晶體骨架開始分解坍塌,一直到646 K時失重曲線才開始趨于平坦,總失重率為77.64%(理論值為77.58%,殘余產物推測為Ag)。而從圖9得知,配合物2在428 K之前,失重率為7.84%(理論值為7.02%),是由于配位水分子的失去造成的。該配合物在溫度達到428 K之后,骨架發生坍塌,H3btc開始分解。在576~720 K溫度范圍內,失重率為31.92%(理論值為30.46%),是由于bpy的分解造成。直至溫度達到1 173 K時,配體仍未完全分解。
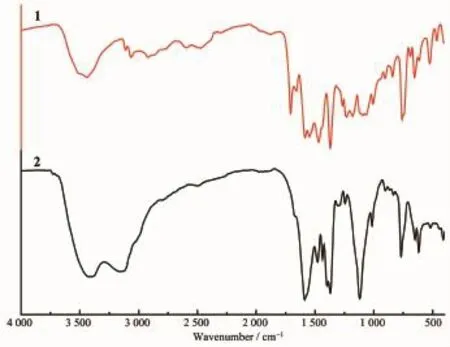
圖7 配合物1和2的紅外光譜Fig.7 IR spectra of complexes 1 and 2
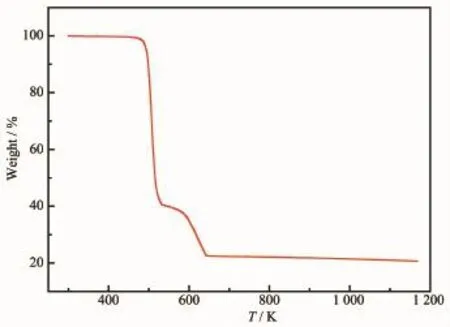
圖8 配合物1的熱重曲線圖Fig.8 Thermal behavior of complex 1
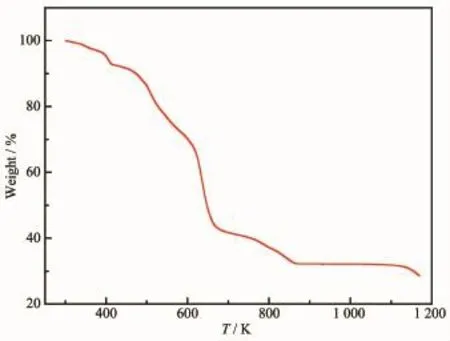
圖9 配合物2的熱重曲線圖Fig.9 Thermal behavior of complex 2
2.4 配合物1和2的熒光性能
近年來,高效發光材料特別是含d10金屬配合物發光材料得到科研工作者的重視,一方面其結構存在著一定的剛性,使其分子結構的輻射躍遷得到了較大地增強;另一方面,由于配合物分子結構的穩定性,使得該類化合物為功能型材料的應用提供了一定的保證,因此含d10金屬配合物是一類有廣泛應用領域的光致發光材料[22-24]。
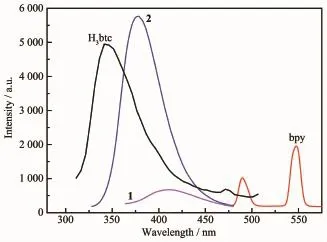
圖10 配體、配合物1和2的熒光光譜Fig.10 Solid-state luminescent spectra of ligands,complex 1 and 2
本文對常溫下以固態形式存在的2種配體以及配合物1和2的熒光性能進行了研究,結果見圖10。熒光光譜表明,H3btc 在 331 nm(λex=260 nm)處出現了較強的熒光發射峰,主要是由于H3btc配體內部的π*→π電荷躍遷所致。bpy在489和546 nm(λex=331 nm)處出現2個較弱的熒光發射峰。而配合物1和2的最大發射峰的峰形與配體H3btc相似,且均發生了明顯的紅移,其最大發射峰分別出現在410 nm(λex=330 nm)和 377 nm(λex=279 nm)處,這可能是由于Ag+/Cd2+的核外電子構型是d10構型,不易發生氧化還原反應,因此配合物的熒光光譜既不是源于配體到金屬的電荷轉移,也不是源于金屬到配體的電荷轉移,配合物的熒光可能來自于配體H3btc配體內部的π*→π躍遷。但熒光強度均發生了明顯的變化,配合物1的熒光強度明顯降低,而2的熒光強度卻顯著增強,這可能是由于金屬離子與配體H3btc結合后使得結構剛性發生變化,1和2的非輻射躍遷相對升高和降低造成的[25]。
3 結 論
通過水熱合成法,以H3btc為第一配體,bpy為第二配體,在過渡金屬Ag(Ⅰ)和Cd(Ⅱ)的作用下合成了新的金屬有機配合物[Ag(H2btc)(bpy)](1)和[Cd(Hbtc)(bpy)(H2O)2]n(2),用X射線單晶衍射儀測定了配合物的單晶結構,并對它們進行了紅外光譜、熱重分析和熒光性質的表征。配合物1和2均具有良好的熱穩定性。熒光測試結果表明,1和2均具有熒光性,為熒光材料的研究提供了一定的基礎。

