基于種子無菌苗的云南甜龍竹組培快繁研究
鄭祥亁 陳凌娜 孫茂盛 崔永忠 楊漢奇
(1 中國林業科學研究院資源昆蟲研究所 昆明650233;2 西南林業大學竹藤研究所 昆明650233)
竹類植物是重要的林業種質資源, 2017 年中國以竹筍和竹材為主的竹產業產值達2 346 億元, 成為國民經濟中一項重要的產業[1]。 優質種苗是農林產業的基礎。 傳統的竹子育苗技術多見于扦插、 分篼、 埋稈、 埋鞭等, 這些技術存在母竹消耗多、 成本高、 繁殖系數低等問題, 因此快速高效的快繁技術越來越多地在竹子育苗研究中得到應用[2]。 目前,竹子的離體快繁技術已在多個散生和叢生竹種中取得成功[3-5]。
云南甜龍竹 (Dendrocalamus brandisii) 分布于緬甸、 越南、 老撾、 泰國以及中國云南中部和南部地區, 稈莖粗10~12 cm, 稈高10~15 m, 是優良的筍材兩用大型叢生竹種, 其鮮食筍質好, 具有很高的經濟價值[6]。 云南甜龍竹是云南栽種面積最廣的筍用竹之一, 常用埋節或埋稈法育苗, 但其效率低、育苗成本高, 2008 年種苗價格達到20 ~30 元/叢,而且苗木質量不易控制, 極大地阻礙了該竹種的推廣栽培。 由于罕見開花結實, 目前云南甜龍竹的快繁技術僅見以嫩芽為外植體材料的報道, 且增值系數較低[7]。 本研究以云南甜龍竹種子為實驗材料,通過探索不同植物生長調節物質組合對其種胚無菌苗的叢生芽誘導、 增殖及生根的影響, 建立其離體快繁體系, 為促進云南甜龍竹種苗產業化生產、 顯著減低苗木成本提供技術基礎。
1 材料與方法
1.1 材料
2018 年3 月在云南紅河州采集成熟云南甜龍竹種子, 剝去稃片, 自然晾干, 選擇健康飽滿的種子于4 ℃冰箱保存備用。
1.2 試驗方法
1.2.1 叢生芽誘導培養基的篩選
種子經滅菌[8]后, 接種于以MS 為基本培養基并含植物生長調節劑的培養基中, 植物生長調節劑為不同濃度的6-芐氨基腺嘌呤(6-BA) 和6-糠氨基嘌呤(KT), 分別設置4 種濃度梯度, 即6-BA,1.0、 2.0、 3.0 和4.0 mg/L; KT, 0.3、 0.6、 0.9和1.2 mg/L。 首先比較2 種常用細胞分裂素6-BA和KT 對叢生芽的誘導效果, 效果較好的6-BA 再與萘乙酸(NAA) 配合, 篩選最佳的濃度組合。 每個處理接種60 瓶, 每瓶接種2 粒種子, 重復3 次。
1.2.2 叢生芽增殖培養基的篩選
取長勢和形態相似, 高約2.0 cm 的叢生芽, 分切為每2~3 個芽為一叢, 接種于含不同濃度水平的NAA、 6-BA、 噻苯隆(TDZ) 的MS 增殖培養基上,采用正交試驗設計篩選適合叢生芽增殖的最佳培養基。 每種植物生長調節劑設置3 種濃度水平 (表1), 每個處理接種45 瓶, 每瓶接種2 叢, 重復3 次。
1.2.3 試管苗生根培養基的篩選
將以上增殖的叢生芽(長約3 cm) 轉接到含不同濃度的NAA、 吲哚丁酸(IBA) 及不同培養基的生根培養基上, 采用正交試驗設計篩選最佳生根培養基。 每種植物生長調節劑和基本培養基設置3 種濃度水平(表2), 每個處理接種45 瓶, 每瓶接種2叢, 重復3 次。

表2 試管苗生根試驗的各處理水平
1.2.4 培養條件
各階段培養基均含蔗糖30 g/L、 瓊脂6.5 g/L,pH 值為5.9~6.3, 在不同培養階段添加相應的植物生長調節劑, 培養環境為8 h 黑暗、 16 h 光照, 溫度(25±2) ℃, 相對濕度80%。
1.3 數據統計與分析
叢生芽誘導、 增殖、 生根情況均在接種21 d 后分別統計。 誘導率、 增殖倍數、 生根率等指標按以下公式計算:
誘導率=未污染且萌發叢生芽的種子數/ (接種種子總數-污染種子總數) ×100%;
增殖倍數=增殖后芽苗的總數(>0.5 cm) /接種時芽苗總數;
生根率=生根苗數/ (接種苗數-污染苗數) ×100%。
數據分析由SPSS 17.0 軟件完成。
2 結果與分析
2.1 植物生長調節劑對叢生芽誘導的影響
試驗結果顯示(表3), 6-BA 對云南甜龍竹種胚苗叢生芽誘導效果顯著高于KT, 并在濃度為3.0 mg/L 時誘導率最高, 為75.00%; 而KT 處理與對照沒有顯著性差異, 但經KT 處理后的幼苗高生長快,21 d 可達15 cm 左右, 而且節間較長, 每節5 cm左右。
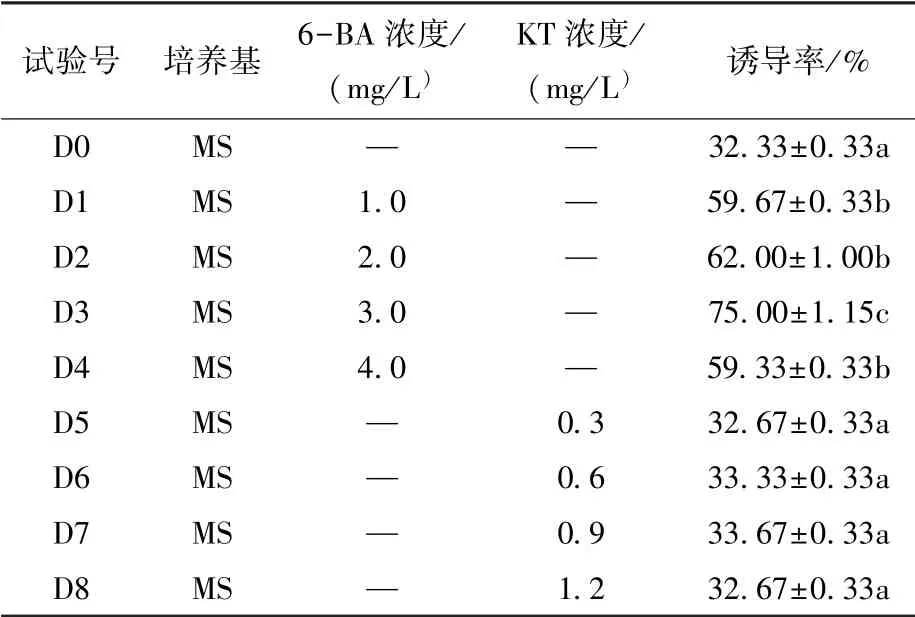
表3 不同濃度6-BA 和KT 處理的種胚苗叢生芽誘導率
將濃度為3.0 mg/L 的6-BA 與不同濃度的NAA組合處理無菌苗叢生芽, 試驗發現(表4), 隨著NAA 濃度的提高, 叢生芽的誘導率呈現先升高后下降的趨勢。 NAA 濃度為0.7 mg/L 時叢生芽誘導率最高, 達86.33%, 且叢生芽長勢良好。 因此, 云南甜龍竹叢生芽誘導的最佳培養基為MS+6-BA 3.0 mg/L+NAA 0.7 mg/L。
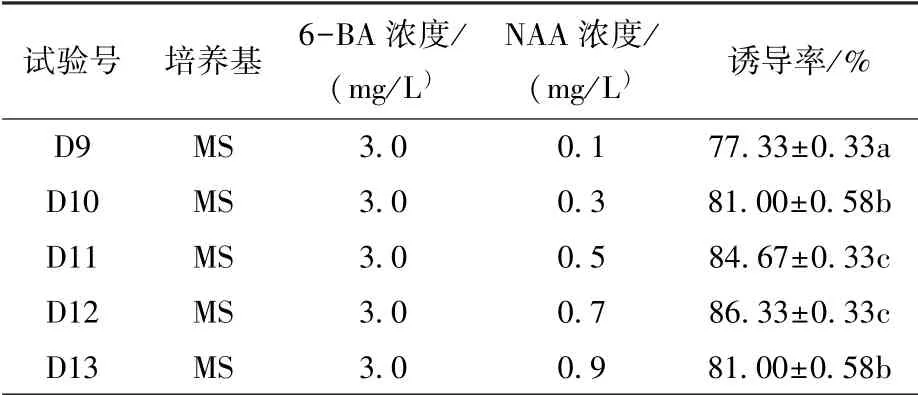
表4 6-BA+NAA 組合對云南甜龍竹無菌苗叢生芽誘導的影響
2.2 植物生長調節劑對叢生芽增殖的影響
試驗結果顯示(表5), 9 個處理的增殖倍數最小為4.33 (處理9), 最大為4.86 (處理5)。 極差R 值顯示NAA、 6-BA、 TDZ 對叢生芽增殖的影響從大到小依次是: 6-BA>NAA>TDZ; 多重比較結果表明, NAA、 6-BA 處理中的水平1 和2 的叢生芽增殖倍數均顯著高于水平3; 而TDZ 對叢生芽增殖倍數的影響不顯著。 因此, 云南甜龍竹叢生芽增殖的最適培養基為MS + NAA 0.3 mg/L + 6-BA 6.0 mg/L +TDZ 0.001 mg/L。 以此培養基進行實驗, 增殖倍數可達4.90, 且叢生芽的生長狀態良好。
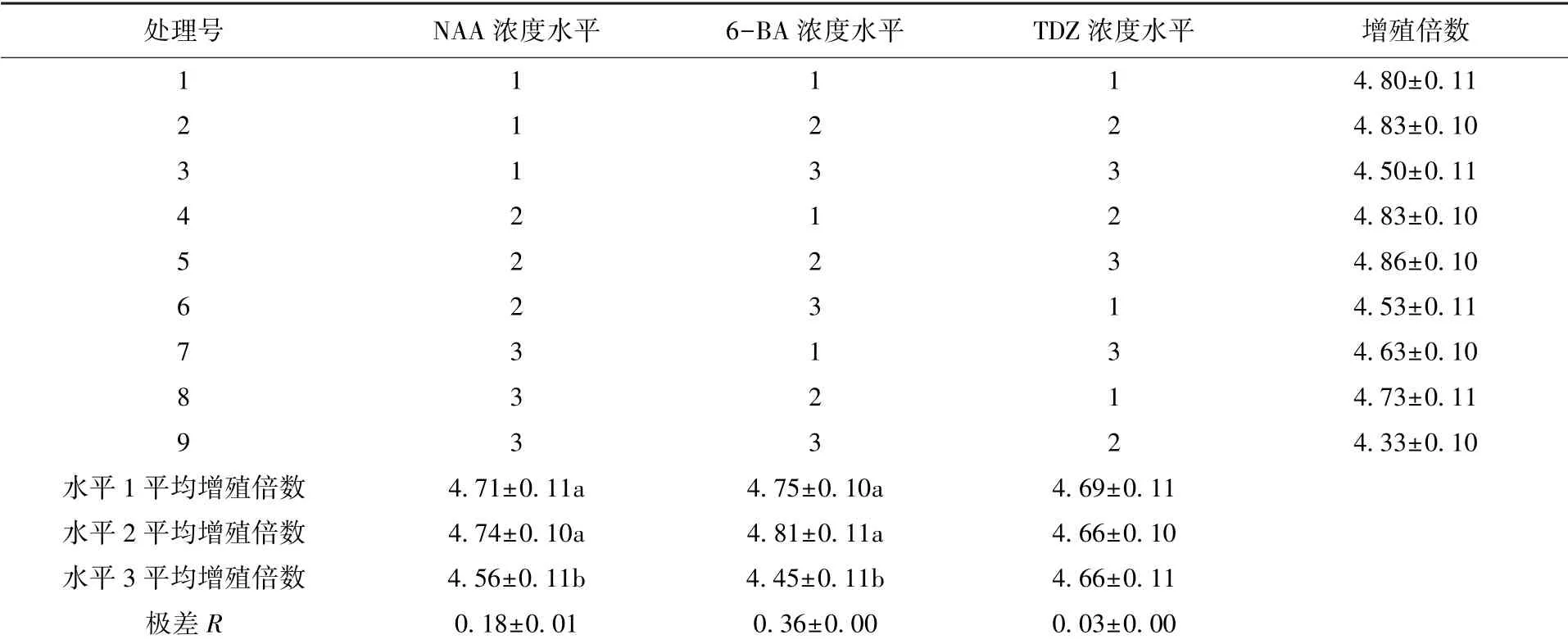
表5 不同濃度植物生長調節劑處理的叢生芽增殖情況
2.3 植物生長調節劑對叢生芽生根的影響
由表6 可見, 各處理的生根率(去掉受污染的叢生芽) 最小為59.35% (處理9), 最大為69.96%(處理5)。 極差R 值顯示, 6-BA 對其叢生芽生根率的影響最大, 其次是NAA, 而培養基的影響最小。 多重比較結果顯示, NAA、 IBA 處理中的水平1 和2 對叢生芽生根率的影響均顯著大于水平3, 而培養基對生根率的影響不顯著。 由此, 云南甜龍竹叢生芽生根的最適培養基為1/2MS+NAA 2.0 mg/L +IBA 4.0 mg/L。 以此培養基進行實驗, 其生根率為71.45%。
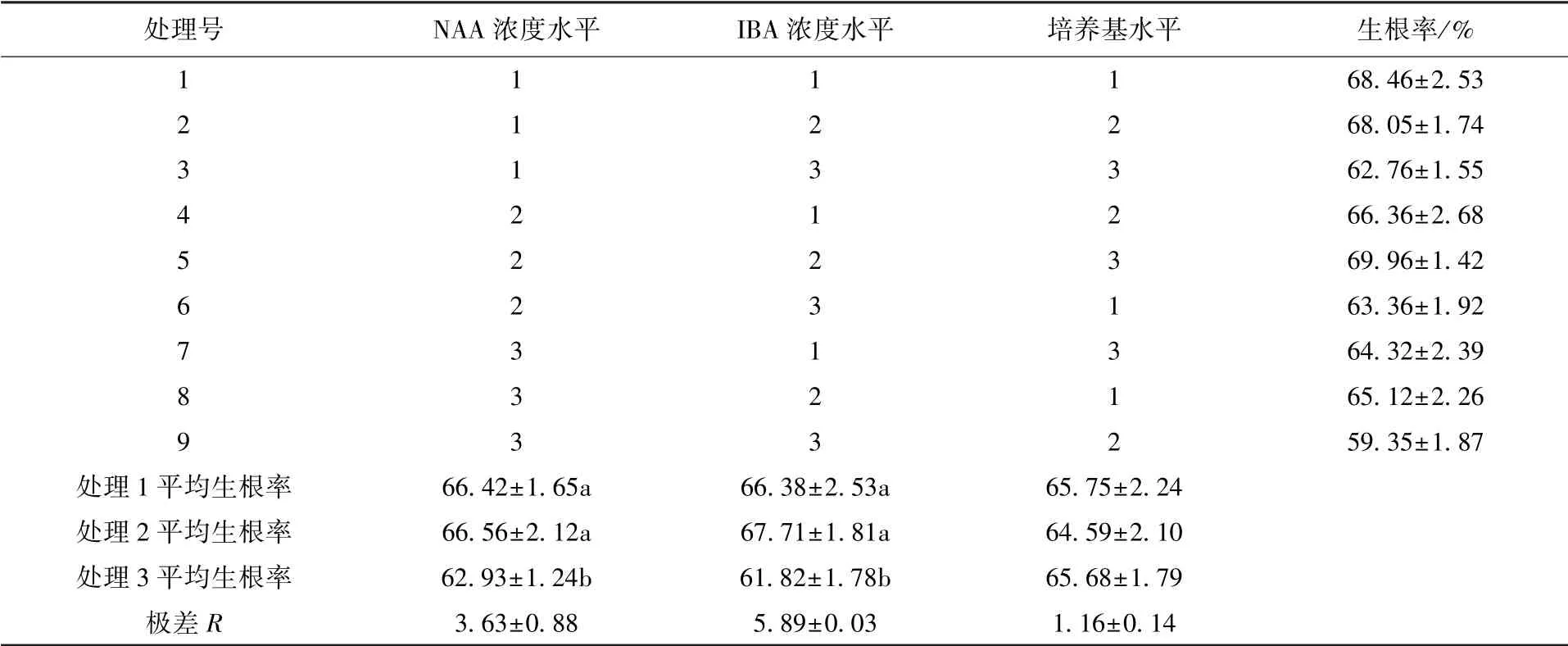
表6 不同濃度植物生長調節劑處理的叢生芽生根情況
3 結論與討論
種子是竹類組織培養研究中最便利的材料, 容易得到具有強分化能力和活力的胚性外植體材料[2]。本試驗利用不同的植物生長調節劑和培養基, 以實生無菌苗為外植體材料, 對云南甜龍竹的組培快繁技術進行了全面研究。 在云南甜龍竹叢生芽誘導方面, KT 沒有明顯的促進作用; 而6-BA 可以顯著地提高叢生芽的誘導效果, 隨著6-BA 濃度的升高,誘導率呈現先升高后降低的趨勢。 這與以云南甜龍竹新萌發的嫩枝為外植體[7]以及慈竹(Neosinocalamus affinis)[9]叢生芽誘導的結果相似。另外, KT 處理的幼苗其高生長較快且節間較長, 這可能與KT 能夠促進細胞分裂有關[10]。 另一方面,6-BA與NAA 配合使用會顯著提高叢生芽的誘導率[11], 本試驗篩選出云南甜龍竹叢生芽誘導的最佳培養基為MS + 6-BA 3.0 mg/L + NAA 0.7 mg/L, 誘導率可達86.33%。 而以云南甜龍竹新萌發嫩枝為外植體[7], 篩選出的叢生芽最佳誘導培養基為3/4MS +6-BA 2.0 mg/L + KT 1.0 mg/L, 但誘導率僅為72.7%。 這種差異可能是由于外植體以及外源激素的不同而引起的。
在云南甜龍竹叢生芽增殖過程中, 6-BA 對叢生芽增殖倍數的影響最大, 這與對慈竹、 小佛肚竹(Bambusa ventricosa) 的研究結果相似[11-12]。 其次NAA 也具有較好的效果, 這與慈竹的結果相似[11];但NAA 對小佛肚竹叢生芽的增殖并沒有顯著影響[12], 這可能是由于竹種差異以及外植體的內源激素含量存在差異, 從而造成其對外源激素的敏感程度不同。 本文篩選出的云南甜龍竹叢生芽最佳增殖培養基為MS + NAA 0.3 mg/L + 6-BA 6.0 mg/L +TDZ 0.001 mg/L, 增殖倍數可達4.90, 高于以新萌發的嫩枝為外植體的叢生芽增殖倍數 (最高4.50)[7], 這可能是由于種子萌發的叢生芽生命活力較強所致。
叢生芽的生根培養是植物快繁的關鍵技術之一[13]。 本試驗發現NAA、 IBA 對云南甜龍竹生根率有顯著性影響, 最佳生根培養基為1/2MS + NAA 2.0 mg/L + IBA 4.0 mg/L, 生根率達到71.45%。 而同樣采用NAA、 IBA、 培養基組合的生根培養基, 在其它竹種中卻取得了較高的生根率, 如麻竹(Dendrocalamus latiflorus) 在1/3MS + NAA 3 mg/L +IBA 4.5 mg/L 中, 生根率可達90%以上[14]; 以云南甜龍竹新萌發的嫩枝為外植體誘導的叢生芽在1/2MS +NAA 3.0 mg/L + IBA 5.0 mg/L 中, 生根率約為75%~80%[7]。 造成本試驗中云南甜龍竹生根率較低的原因可能由于竹種和外植體差異引起的[4,15-16]。 另外, 盡管種子是竹子組培研究中難得的外植體材料,但零星開花結實的竹子種子普遍存在自交衰退的現象, 部分種子表現出萌發率低、 生活力差[17-18], 這也可能會導致種胚產生的快繁幼苗生根困難。
本研究通過1 年多的大量重復試驗對云南甜龍竹種胚組織培養進行了詳細研究, 獲得了高增殖系數且長勢較好的無菌苗; 不僅擴展了該重要經濟價值竹種的育苗方法, 而且也為今后建立其遺傳轉化體系提供了試驗基礎。


