氮補充對氮饑餓銅綠微囊藻生長的影響
張達娟 張樹林 王澤斌 李鵬英
摘要:【目的】探討氮缺乏及氮補充對銅綠微囊藻細胞密度、光合色素和葉綠素熒光參數的影響,為揭示水華暴發機制及其影響因素提供參考依據。【方法】使用BG-11全培養基(對照組)和無氮BG-11培養基(處理組)分別培養銅綠微囊藻7 d后,再轉移至BG-11全培養基中繼續培養,于不同培養時期測定銅綠微囊藻密度、光合色素含量及葉綠素熒光參數等指標,觀察其變化規律。【結果】氮饑餓處理銅綠微囊藻7 d后,處理組藻密度(2.10×107 cell/mL)極顯著低于對照組(3.11×107 cell/mL)(P<0.01,下同),氮補充144 h后,處理組的藻細胞密度為3.35×107 cell/mL,仍極顯著低于對照組(4.32×107 cell/mL);氮缺乏會極顯著或顯著(P<0.05)抑制銅綠微囊藻葉綠素a、類胡蘿卜素和藻膽蛋白的合成,但抑制作用隨氮補充時間的延長而降低;氮饑餓處理后,處理組銅綠微囊藻可溶性蛋白含量較對照組減少64.50 μg/L,氮補充144 h后二者相差44.10 μg/L,但差異不顯著(P>0.05);氮饑餓處理后再恢復氮補充對銅綠微囊藻光合作用速率有明顯促進作用,尤其是Fv/Fm在氮補充12 h后開始逐漸提高,至144 h后極顯著高于對照組。【結論】氮缺乏會抑制銅綠微囊藻的分裂增殖及正常代謝過程,但這種抑制作用隨著氮補充時間的延長而減弱;在氮補充后,銅綠微囊藻葉綠素a、類胡蘿卜素和藻膽蛋白的含量雖然呈升高趨勢,但很難恢復至正常水平。Fv/Fm等葉綠素熒光參數對氮營養鹽缺乏后再補充具有良好的響應作用,可作為營養鹽監測的指示指標。
關鍵詞: 銅綠微囊藻;氮饑餓;氮補充;光合色素;可溶性蛋白;葉綠素熒光參數
中圖分類號: S663.4? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2019)11-2592-07
Effects of nitrogen recovery on the growth of nitrogen
starved Microcystis aeruginosa
ZHANG Da-juan, ZHANG Shu-lin*, WANG Ze-bin, LI Peng-ying
(Tianjin Key Laboratory of Aqua-Ecology and Aquaculture/College of Fisheries, Tianjin Agricultural University,
Tianjin? 300384, China)
Abstract:【Objective】In the present study, effects of nitrogen recovery on cell density, photosynthetic pigments content and chlorophyll fluorescence parameters of Microcystis aeruginosa after nitrogen starved were studied to provide reference for the mechanism of Microcysis blooms outbreaks and its influencing factors. 【Method】Using BG-11 medium(control group) and nitrogen-free BG-11 medium(treatment group) cultured M. aeruginosa for 7 d, then transferred to BG-11 medium, measured the cell density, photosynthetic pigments content and chlorophyll fluorescence parameters in different times. 【Result】After nitrogen starved 7 d, the cell density of M. aeruginosa in the treatment group(2.10×107 cell/mL) was extremely lower than that in the control group(3.11×107 cell/mL)(P<0.01,the same below), after nitrogen recovered 144 h, its cell density of treatment groups was 3.35×107 cell/mL, still extremely lower than the control groups(4.32×107 cell/mL). Nitrogen starvation could inhibit the synthetize of chl-a, carotenoid and phycobiliprotein, the difference reduced with the time of nitrogen recovery. The soluble protein content was 64.50 μg/L lower than that in the control groups because of nitrogen starvation, it was still 44.10 μg/L lower than that after recovery,but the difference was not significant(P>0.05). The recovery of nitrogen could accelerate the photosynthesis rate of M. aeruginosa significantly, especially the Fv/Fm responded to nitrogen recovery in 12 h obviously, and was extremely higher than control group after 144 h. 【Conclusion】Nitrogen starved can inhibit the cleavage, proliferation and metabolize, however, the inhibition reduces with the nitrogen recovery time. After nitrogen recovery, the contents of chl-a, carotenoid and phycobiliprotein increase, but cannot reach the normal levels. Fv/Fm respond to the nutrient deficiency and recovery sensitively, soit can be used as indicator of the nutrient monitors.
Key words: Microcystis aeruginosa; nitrogen starvation; nitrogen recovery; pigment; soluble protein; chlorophyll fluorescence parameters
0 引言
【研究意義】隨著社會經濟的快速發展及工業化進程的飛速前進,大量氮、磷等營養性污染物質的排放致使我國江河、湖泊及沿海海域水體中的氮、磷營養鹽含量不斷升高,富營養化程度不斷加重。淡水生態環境的格局由草型轉變為藻型,而藻的種類組成由硅藻為主轉變為藍藻為主,水華頻發(顧崗,1996),且發生的時間和范圍不斷擴大,已引起社會各界的普遍關注(孔繁翔和高光,2005;Schindler,2006)。在藍藻水華中以銅綠微囊藻(Microcystis aeruginosa)最常見,其隸屬于藍藻門(Cyanophyta)色球藻科(Chroococcaceae)微囊藻屬(Microcystis)。銅綠微囊藻外有一層膠被,不能被養殖對象消化吸收,同時蛋白含量較高,藻體死亡后可分解產生羥胺和硫化氫等物質,進而影響水質及養殖對象(姜小玉等,2019)。微囊藻大量繁殖時水體pH急劇升高,致使養殖對象體內硫胺酶活性增加,導致神經系統失調或痙攣,尤其大量暴發時可造成水體變色、散發異味并產生有害氣體及釋放藻毒素,嚴重威脅養殖對象及其他水生生態功能的正常發揮,甚至影響人類健康(Codd,2000)。因此,研究微囊藻水華發生與環境因子間的關系,對深入了解微囊藻暴發機制及進行有效防控具有重要意義。【前人研究進展】微囊藻水華發生不僅與氮、磷營養鹽初始濃度有關,還與其缺失和補充有關。已有研究結果表明,在較高的總氮/總磷比條件下,水體會形成藍藻水華;較低的總氮/總磷比不是藍藻水華形成的條件,而是水華產生的結果(Xie et al.,2003)。孔繁翔等(2010)研究認為,伴隨著水體的富營養化,尤其是磷濃度的增加,通常會導致水體中浮游植物的群落組成向可形成水華的藍藻演替,且當水體中總氮/總磷比小于29時,水華藍藻會占優勢,為水華的暴發提供條件。在自然水體中,因廢水排放、降雨及底泥營養物質的釋放等,氮、磷營養鹽在水體中的含量時刻都在發生變化。微囊藻水華的發生受化學、物理和生物因素等的綜合影響。孔繁翔等(2010)提出在四季分明、擾動劇烈的富營養化水體中,藍藻的生長與水華的形成分休眠、復蘇、生物量增長、上浮及聚集4個階段,每個階段中藍藻的生理特性及主導環境因子均有所不同。在冬季,水華藍藻的休眠主要受低溫及光照強度影響;春季的復蘇過程主要受水底表面溫度和溶解氧控制,而光合作用和細胞分裂所需要的物質與能量決定了水華藍藻在春季和夏季的生長狀況,一旦有合適的氣象與水文條件水華藍藻即大量暴發(陳衛民等,2010;孔繁翔等,2010)。室內研究表明,氮、磷起始濃度與微囊藻生長速率和生物量間呈顯著正相關,但當氮或磷單一營養鹽處于富營養化狀態,另一種營養鹽濃度降低,微囊藻仍能保持較高的生長速率,且明顯高于綠藻的生長速率(孫凱峰等,2017);當氮、磷維持在一定濃度范圍內時,藍藻生長速率隨氮/磷比的降低而升高(周健等,2014;雷鵬和孫成渤,2015)。【本研究切入點】上述學者大多將研究重點集中在微囊藻水華的形成機制和不同氮磷濃度及比例對微囊藻生長特性的影響,而有關短期營養鹽限制解除后藻類響應方面的研究鮮有報道。李杰等(2008)研究表明,氮磷饑餓可以顯著影響銅綠微囊藻的生長,主要表現為葉綠素a含量顯著下降,超氧化物歧化酶(SOD)和過氧化氫酶(CAT)活性顯著上升。在營養鹽得到補充后,微囊藻能快速生長,氮饑餓的藻細胞生長周期變短,磷饑餓的藻細胞營養鹽補充后固碳能力和光合作用相關基因的表達會有所提升,但難以恢復至未經饑餓的藻細胞水平,且關于銅綠微囊藻在經受氮磷饑餓后其光合作用水平、葉綠素含量及可溶性蛋白等恢復情況尚未得到深入研究。【擬解決的關鍵問題】以銅綠微囊藻為研究對象,在實驗室條件下模擬氮缺乏后大量補充對其生長和主要代謝產物的影響,為揭示水華暴發機制及其影響因素提供參考依據。
1 材料與方法
1. 1 試驗材料
銅綠微囊藻(M. aerμginosa 905)由中科院水生生物研究所淡水藻種庫提供,采用BG-11培養基進行培養,溫度27 ℃,光暗比12 h∶12 h,光照強度38 μmol/(m2·s)。
1. 2 試驗設計
本研究設1個對照組和1個處理組,對照組使用BG-11全培養基,處理組使用不含氮的BG-11培養基,每組設3個平行。開始培養時,銅綠微囊藻的初始濃度均為2.00×107 cell/mL,氮饑餓處理7 d后,將對照組和處理組中的銅綠微囊藻分別轉接至正常的BG-11全培養基中,分別于轉接后的第0、12、24、48、72、96、120和144 h取樣,測定相應指標。
1. 3 測定項目及方法
1. 3. 1 銅綠微囊藻密度測定 用血球計數板對銅綠微囊藻進行細胞計數,每個平行樣品均重復計數3次,取其平均值。
1. 3. 2 葉綠素a和類胡蘿卜素含量測定 參照王曼(2013)、戴立洲等(2015)的方法:取10.0 mL藻液4500 r/min離心10 min,棄上清液,向藻泥中加入等體積95%乙醇,混勻后4 ℃下提取8 h,4500 r/min離心10 min,取上清液,分別在665、649和470 nm處測定吸光值并記錄。
Chla=13.7×OD665-5.76×OD649
A=(1000×OD470-2.05×Chla)/245
式中,Chla為葉綠素a濃度(μg/mL),A為類胡蘿卜素濃度(μg/mL)。
1. 3. 3 藻膽蛋白含量測定 參照李小路等(2008)的方法:取5.0 mL藻液4500 r/min離心10 min,棄上清液,向藻泥中加入5.0 mL磷酸緩沖液(0.05 moL/L,pH 7.0),混勻后用錫紙將樣品包好,避光放入超低溫冰箱(-80 ℃),8 h后取出室溫解凍,反復凍溶4次,4500 r/min離心10 min;取上清液,分別在650、620和565 nm處測定吸光值并記錄。
根據以下公式計算藻藍蛋白(PC)、別藻藍蛋白(APC)和藻紅蛋白(PE)的含量(mg/L)及相對含量:
PC=(OD620-0.7×OD650)/7.38
APC=(OD650-0.19×OD620)/5.65
PE=(OD565-2.8×PC-1.34×APC)/1.27
1. 3. 4 可溶性蛋白測定
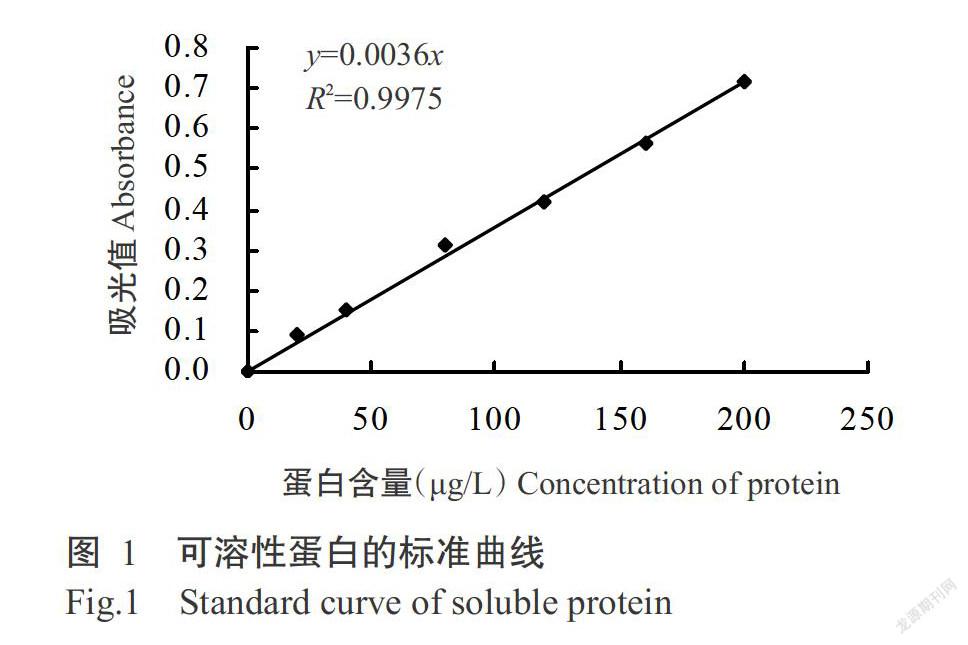
1. 3. 4. 1 蛋白標準曲線的制作 準確稱取100.0 mg牛血清蛋白溶于少量無菌水中,并定容至100.0 mL容量瓶中,配制成1000 μg/mL的母液,再稀釋制成不同濃度的蛋白標準溶液,分別吸取不同濃度的蛋白標準溶液0.5 mL于20.0 mL的比色管中,加入5.0 mL考馬斯亮藍G-250蛋白試劑,渦旋混勻,反應2 min后在1 cm光徑、595 nm波長處測定溶液吸光值,然后以蛋白含量為橫坐標、吸光值為縱坐標繪制蛋白標準曲線(圖1)。
1. 3. 4. 2 可溶性蛋白提取與測定 參考孫穎穎等(2010)、谷兵等(2017)的方法:取10.0 mL藻液,4500 r/min離心10 min,棄上清液,將藻泥分別用無菌水和磷酸鹽緩沖液(10 mmol/L、pH 6.8)沖洗藻泥1次,再用400 μL磷酸緩沖液將藻泥轉入2.0 mL離心管并放入冰盒,以勻漿儀破碎藻細胞(4.0 M/S,MP:24×2,TIME 10,破碎10 s停頓5 min,重復4次),破碎液4500 r/min離心10 min,收集的上清液即為可溶性蛋白粗提取物。吸取0.5 mL蛋白粗提取物置于20.0 mL比色管中,加入5.0 mL考馬斯亮藍G-250蛋白試劑,渦旋混勻,反應2 min后在1 cm光徑、595 nm波長處測定溶液的吸光值并記錄,然后根據可溶性蛋白標準曲線計算銅綠微囊藻的可溶性蛋白含量。
1. 3. 5 葉綠素熒光參數測定 參考張媛媛等(2015)的方法,檢測所得的指標根據葉綠素熒光基礎參數(Fo、Fm、Fs和Fm')可得到最大電子傳遞速率(ETRmax),并計算最大光能轉化效率(Fv/Fm)、實際光能轉化效率(ΦPSⅡ)及有效光能轉化效率(Yield')。計算公式:
Fv/Fm=(Fm-Fo)/Fm
ΦPSⅡ=(Fm'-Fs)/Fm'
F'v=Fm'-Fo'
Yield'=Fv'/Fm'
Fo'=1/(1/Fo-1/Fm+1/Fm')
1. 4 統計分析
采用SPSS 19.0中的獨立樣本T檢驗對試驗結果進行統計分析。
2 結果與分析
2. 1 氮補充對氮饑餓銅綠微囊藻生長的影響
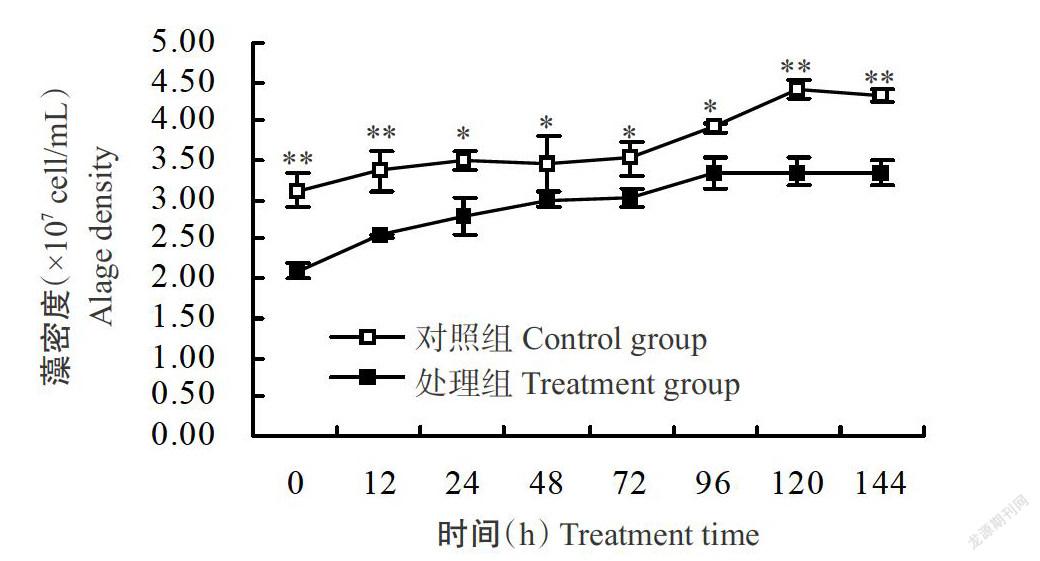
氮補充后銅綠微囊藻的生長趨勢與對照組基本一致(圖2),氮饑餓7 d后,銅綠微囊藻的平均密度為2.10×107 cell/mL,極顯著低于對照組(3.11×107 cell/mL)(P<0.01,下同);隨著氮的補充,兩組藻細胞密度明顯升高,至144 h時,對照組的平均密度為4.32×107 cell/mL,處理組的平均密度為3.35×107 cell/mL,兩組間依然存在極顯著差異,經饑餓處理的微囊藻生長很難恢復至未處理前的水平。
2. 2 氮補充對氮饑餓銅綠微囊藻色素含量的影響
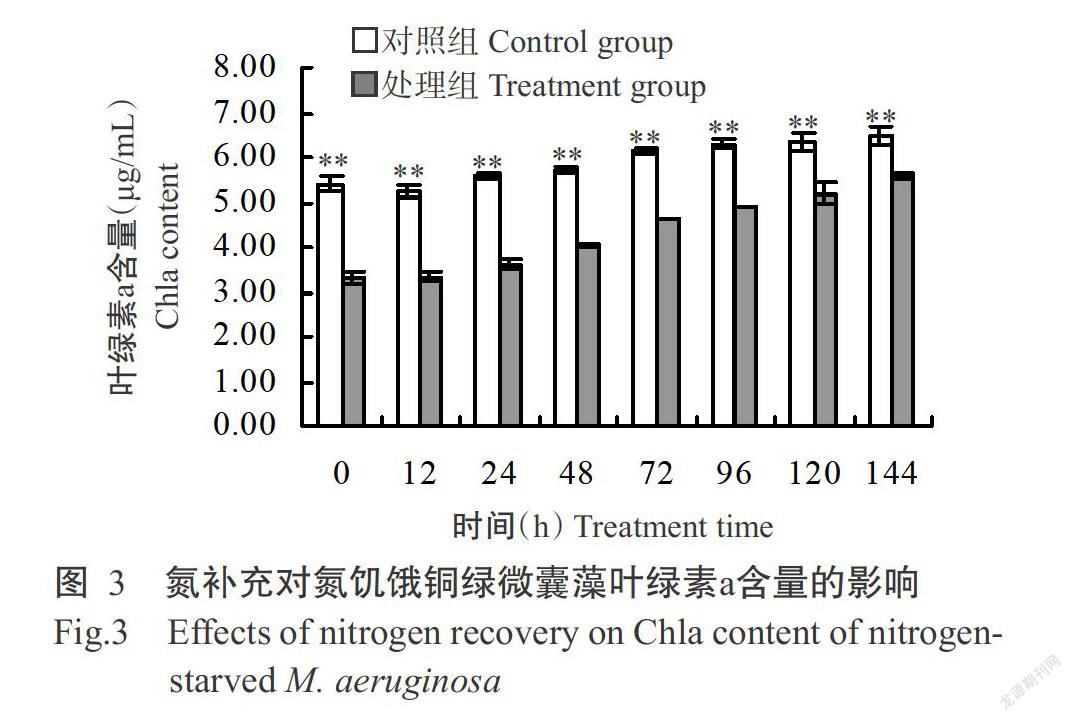
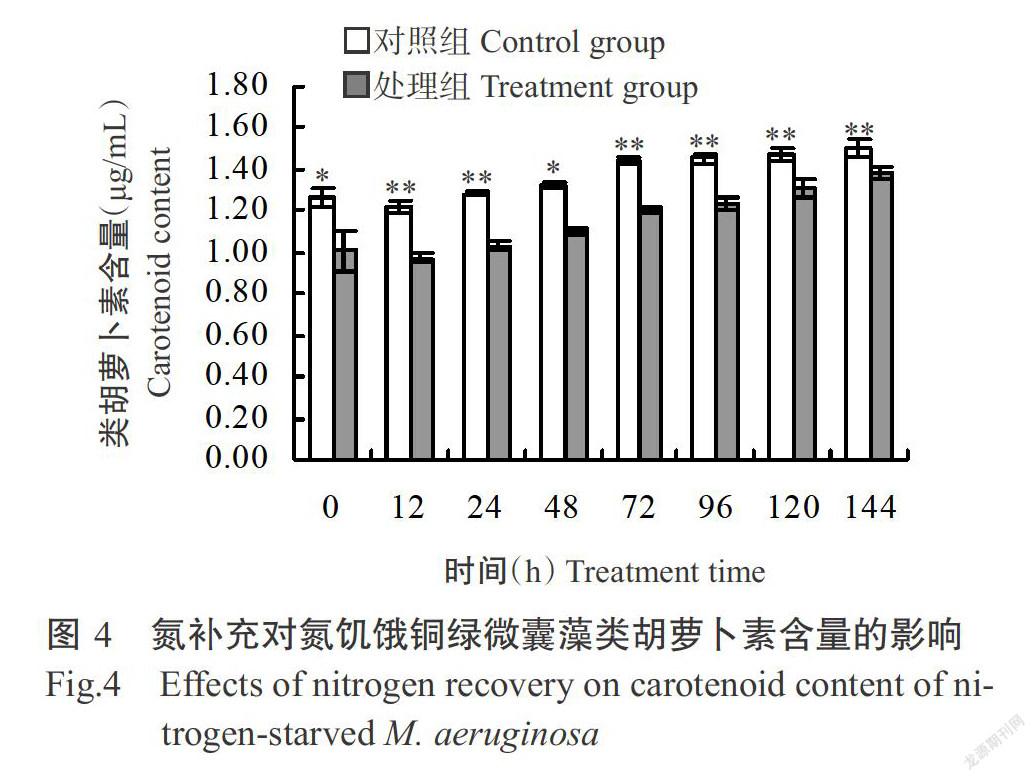
2. 2. 1 氮補充對氮饑餓銅綠微囊藻葉綠素a和類胡蘿卜素含量的影響 銅綠微囊藻葉綠素a含量的變化情況見圖3。氮饑餓7 d后,對照組銅綠微囊藻葉綠素a含量(5.41 μg/mL)極顯著高于處理組(3.29 μg/mL),且這種極顯著差異一直持續至培養結束。經氮饑餓后,對照組與處理組間的銅綠微囊藻類胡蘿卜素含量存在顯著差異(P<0.05,下同);隨著氮的補充,二者間的類胡蘿卜素含量差距逐漸縮小,但至培養結束時二者間仍存在極顯著差異(圖4)。
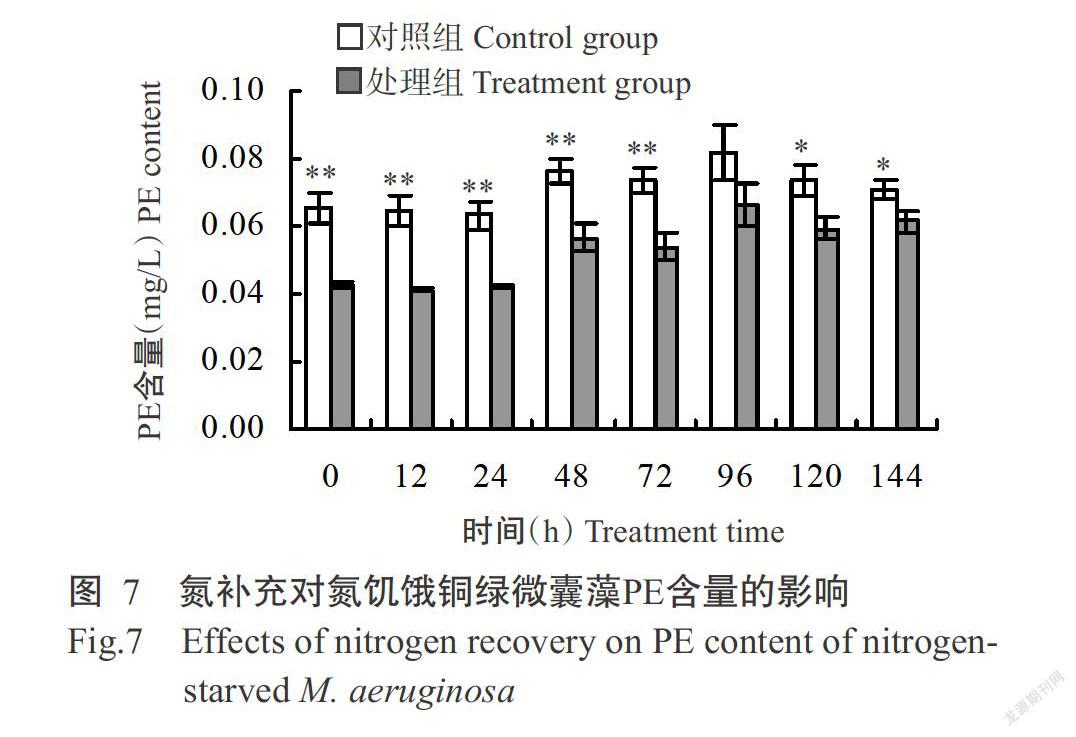
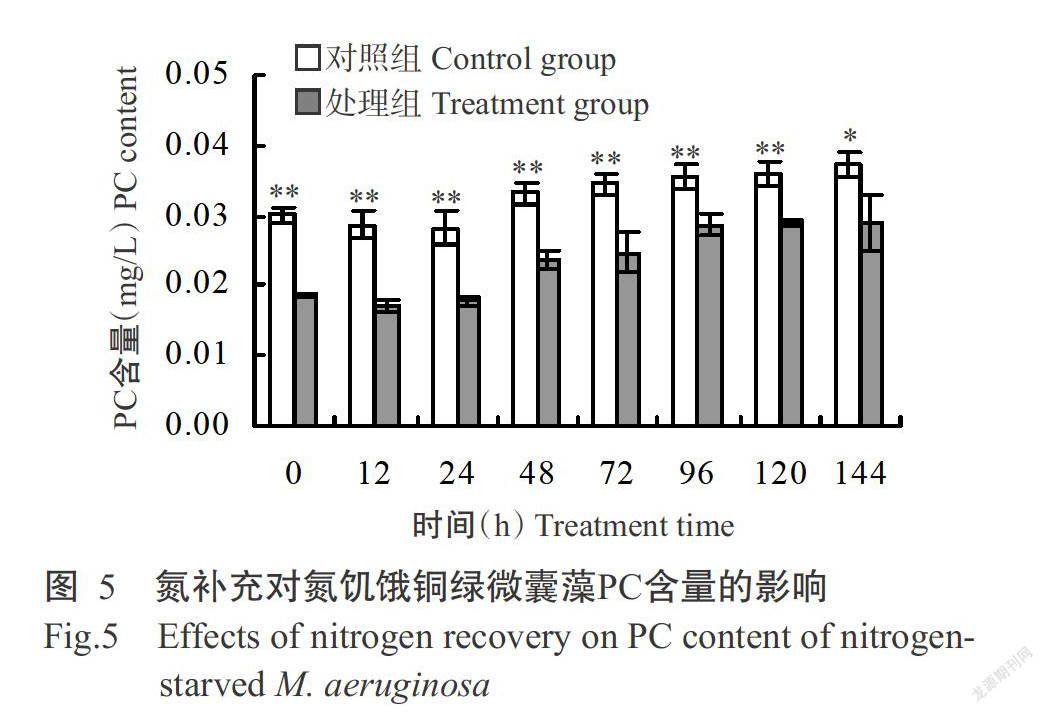
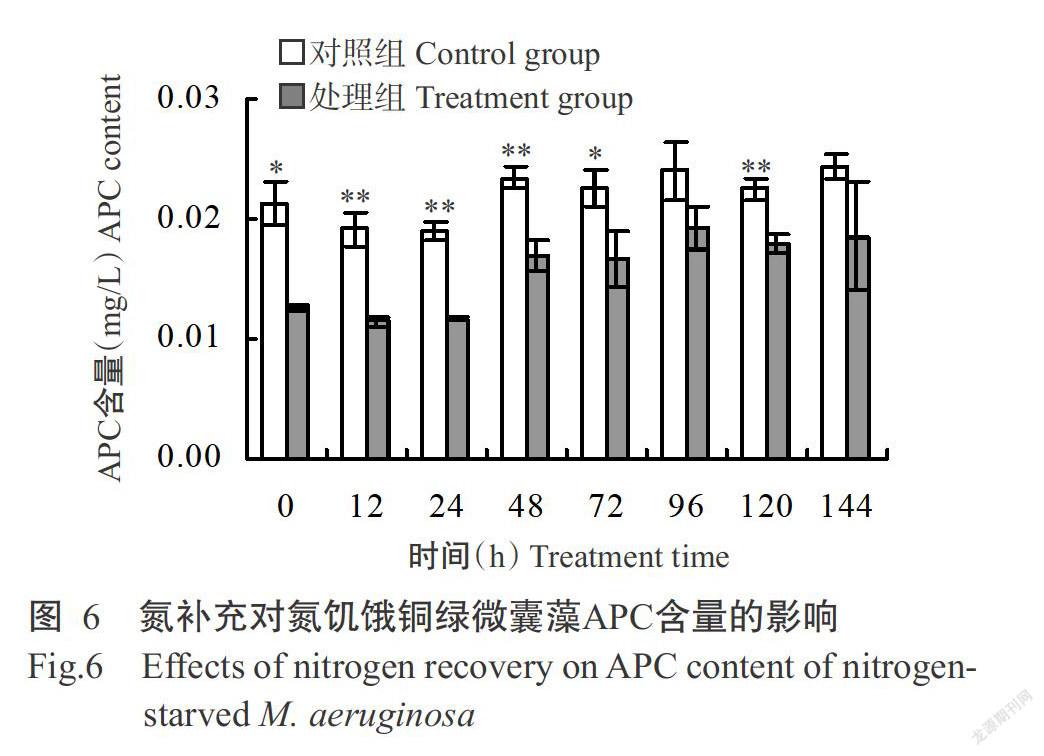
2. 2. 2 氮補充對氮饑餓銅綠微囊藻藻膽蛋白含量的影響 氮補充后銅綠微囊PC、APC和PE的含量變化趨勢基本一致(圖5~圖7)。氮饑餓7 d后,處理組銅綠微囊藻PC、APC和PE的含量均顯著或極顯著低于對照組;隨著氮的補充,處理組3種藻膽蛋白的含量均有所提高,至培養結束時PC和PE含量顯著低于未經氮饑餓的對照組,而APC含量與對照組無顯著差異(P>0.05,下同)。
2. 3 氮補充對氮饑餓銅綠微囊藻可溶性蛋白的影響
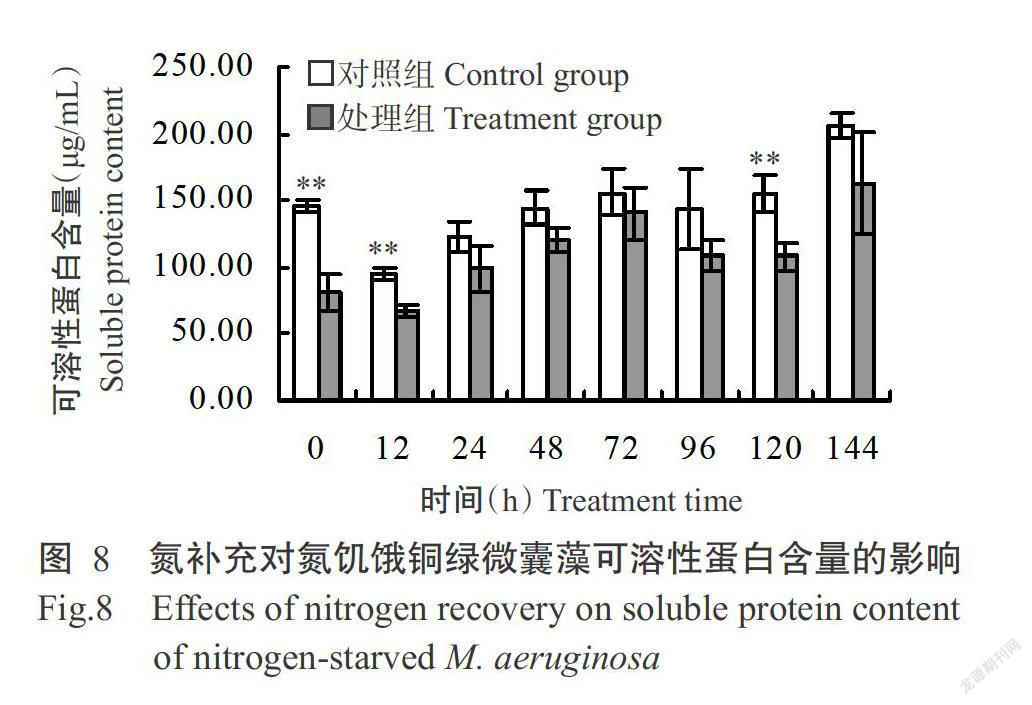
氮饑餓7 d后,對照組銅綠微囊藻可溶性蛋白的平均含量為146.39 μg/L,處理組為81.89 μg/L,二者間存在極顯著差異(圖8);隨著氮的補充,處理組銅綠微囊藻可溶性蛋白含量明顯增加,至培養結束時,對照組銅綠微囊藻可溶性蛋白平均含量為206.49 μg/L,處理組為162.39 μg/L,二者間差異不顯著。
2. 4 氮補充對氮饑餓銅綠微囊藻葉綠素熒光參數的影響
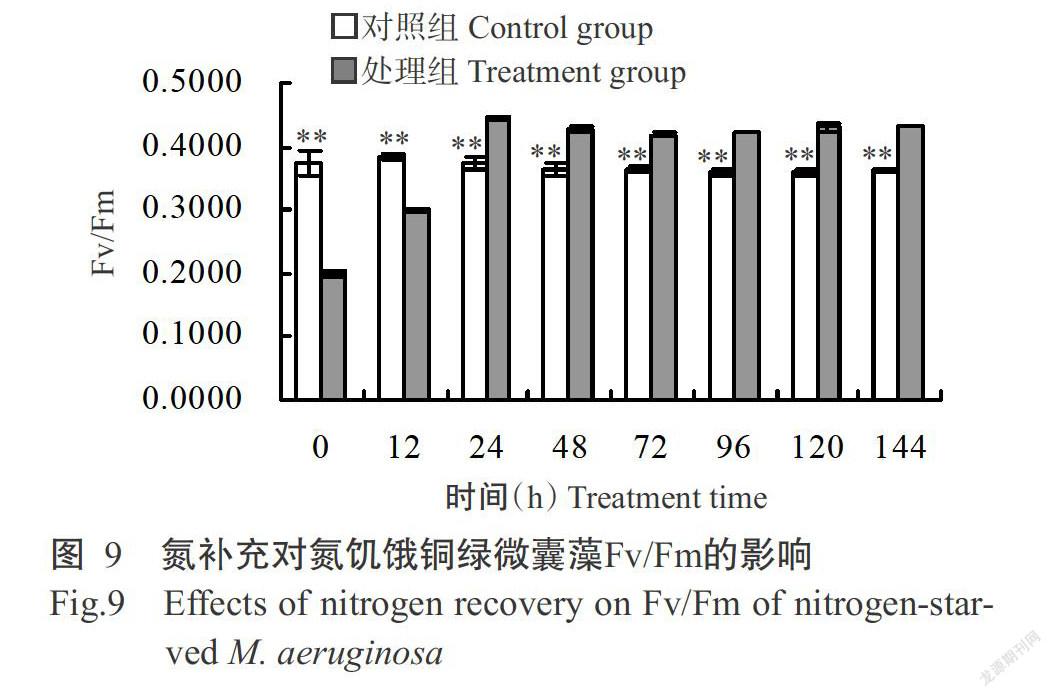
氮饑餓7 d后,處理組銅綠微囊藻的Fv/Fm為0.1999,極顯著低于對照組(圖9);在氮補充12 h后,對照組Fv/Fm處于一個相對穩定的變化趨勢,處理組則開始逐漸提高,至培養結束時,處理組Fv/Fm提升至0.4328,極顯著高于對照組(0.3618)。
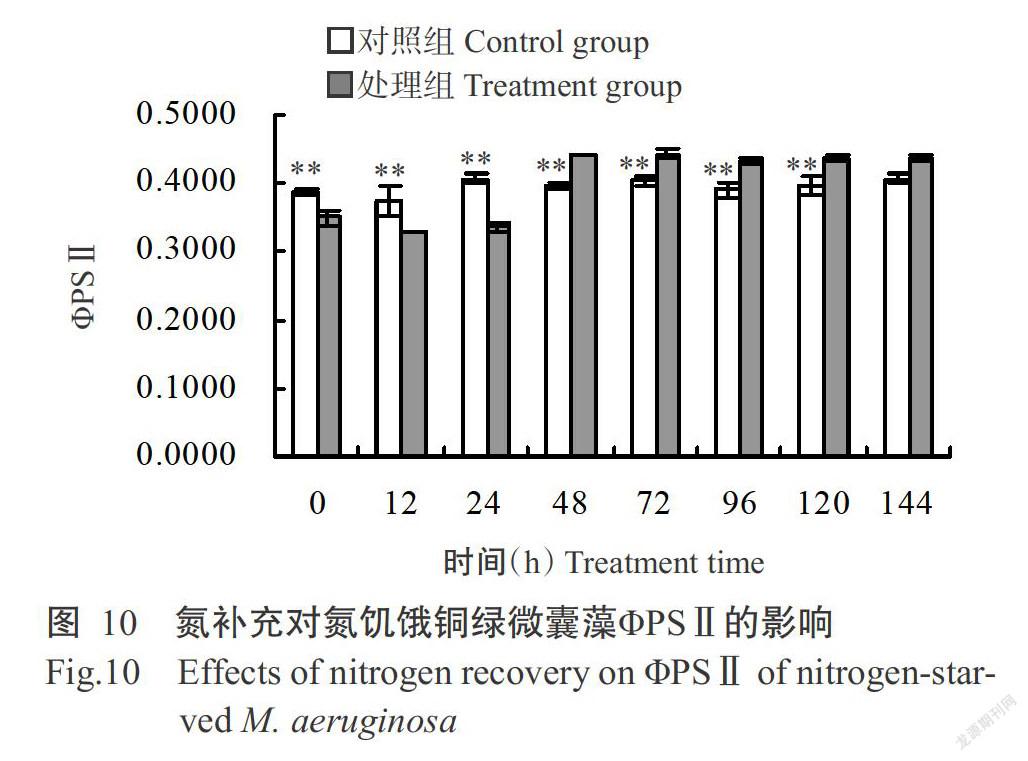
銅綠微囊藻在經過氮饑餓7 d后,其ΦPSⅡ為0.3500(圖10),極顯著低于對照組;隨著氮補充時間的延長,從培養48 h至結束時,處理組銅綠微囊藻的ΦPSⅡ逐漸升高至0.4367,高于對照組(0.4067)但差異不顯著。
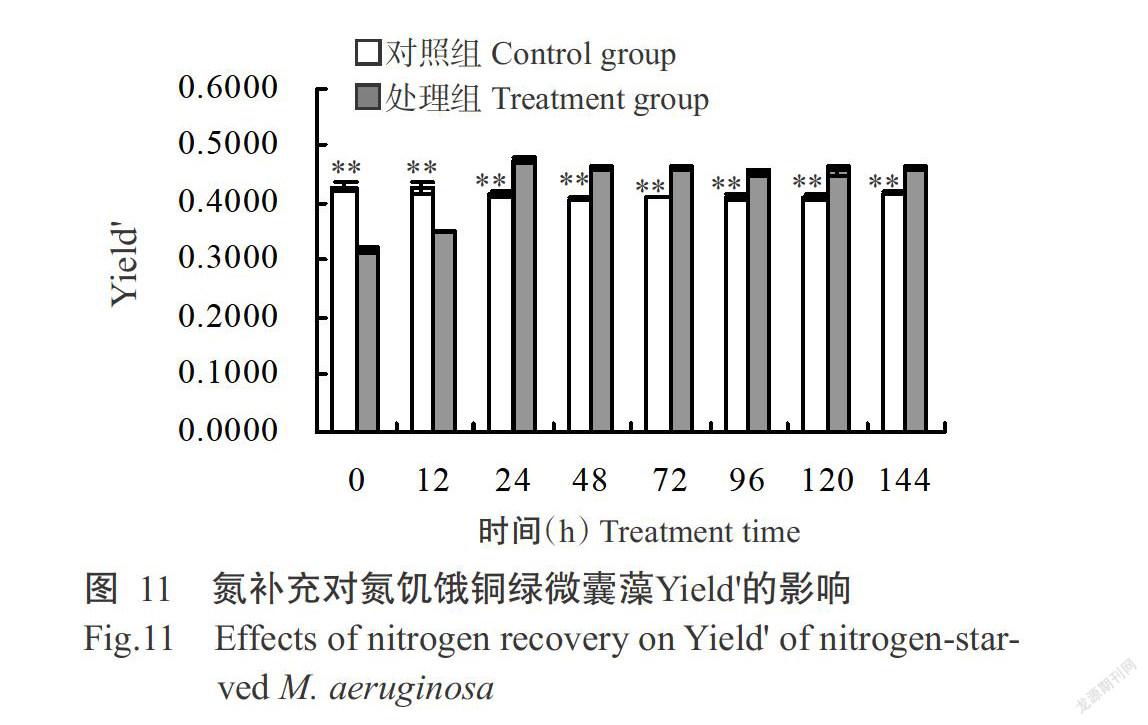
銅綠微囊藻Yield'的變化趨勢如圖11所示。氮補充后,對照組銅綠微囊藻的Yield'處于穩定狀態,處理組的Yield'隨補充時間的延長而上升后趨于穩定,至培養結束時銅綠微囊藻Yield'為0.4623,極顯著高于對照組。
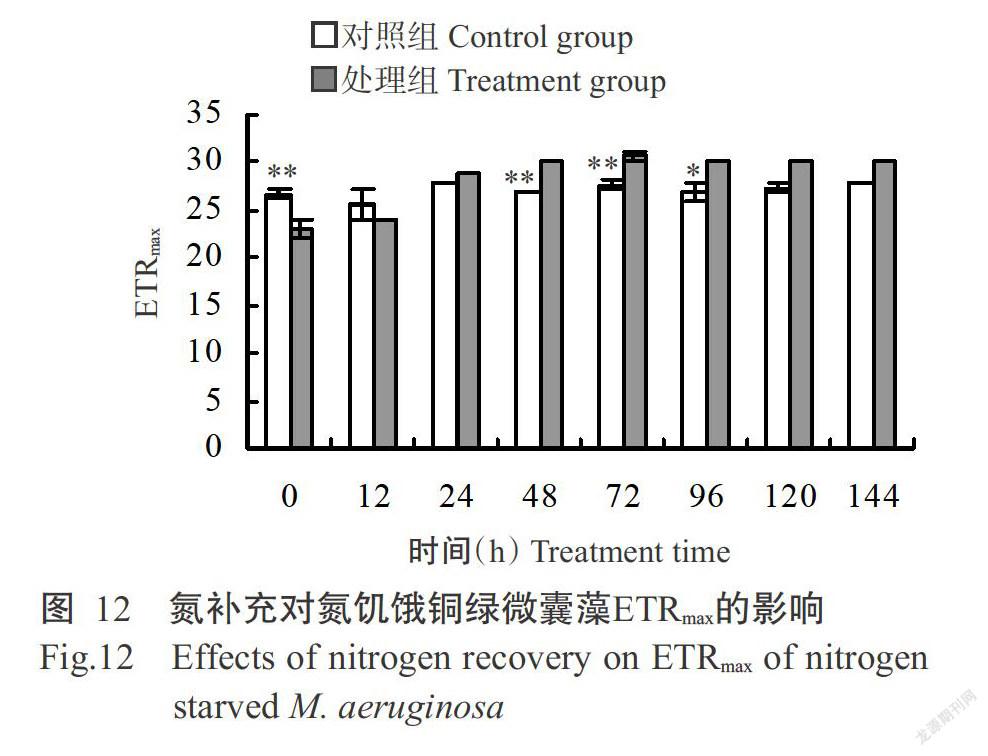
氮補充后,對照組銅綠微囊藻的ETRmax變化不明顯,處理組的ETRmax則呈逐漸上升趨勢,至培養結束時上升至30,與對照組(28)間無顯著差異(圖12)。
3 討論
水華藍藻對氮、磷等營養鹽缺乏的耐受能力對其種群的生長與繁殖具有重要意義,耐受能力較強的種類能在復雜的營養條件下維持一定規模,且可在適宜的環境條件下迅速發展成優勢種類。氮缺乏對銅綠微囊藻的生長具有一定抑制作用,氮饑餓處理7 d后,對照組藻細胞密度是處理組的1.5倍,說明氮缺乏能有效抑制銅綠微囊藻的生長。氮缺乏時,銅綠微囊藻蛋白合成停止,使得微藻細胞分裂減緩,導致生長速率下降甚至停止細胞分裂(曾玲等,2011)。不同藻類對氮、磷的耐受能力具有高度種類特異性,銅綠微囊藻對氮缺乏的耐受力遠低于斜生柵藻(S. obliquus),但對磷的耐受力較高(許海等,2014),也是其易形成水華的原因之一。一般認為,微藻生長適宜的氮/磷比為16∶1,超過或低于該比值,被認為存在磷或氮限制。當存在磷限制時,因銅綠微囊藻耐受力強而具有更高的競爭力。Smith(1986)研究認為當藍藻水華發生時,氮/磷比不會超過29∶1,即藍藻成為優勢種的臨界值,但隨著更多學者的深入研究,發現當氮/磷比高于29∶1時,微囊藻仍能維持優勢地位(Xie et al.,2003;Amano et al.,2010)。
氮營養鹽缺乏后再供給,可使微囊藻生長有一定恢復,但與對照組相比仍有差異。在相同的磷濃度下,按比例降低氮濃度,水華微囊藻(M. flosa-quae)1028藻種群體大小、比例及生長速率均呈明顯的降低趨勢,但隨氮濃度的增加其生長速率呈線性增長趨勢(許慧萍,2014)。王璐瑤等(2012)研究表明,氮限制與氮饑餓嚴重影響了金色奧杜藻(Odontella aurita)的色素合成,致使葉綠素合成受到抑制。在本研究中,銅綠微囊藻色素也受到氮缺乏的顯著抑制,但隨著氮的補充而得到緩解,合成量明顯提高。究其原因主要是在氮限制條件下,類囊體膜上捕光色素蛋白復合物和反應中心復合體受到一定損傷或部分降解,導致其轉能效率降低(梁英等,2006)。
葉綠素熒光參數是用于描述植物光合作用機理和光合生理狀況的變量或常數值,也是研究光合作用的有效探針,其中,Fv/Fm可反映植物體進行光化學反應的最大潛力,對營養鹽變化十分敏感。Kolber等(1988)研究認為,營養鹽充足時,Fv/Fm最大值為0.65,與微藻種類無關。一般認為,在實驗室條件下培養,浮游植物的Fv/Fm很難達到該水平。在本研究中,氮補充后處理組銅綠微囊藻各葉綠素熒光參數均高于對照組,表明其光合速率較高。王昭玉(2013)在缺氮條件下培養7種微藻,8 d后發現Fv/Fm均呈下降趨勢,補充氮源后,不同微藻的Fv/Fm迅速上升,并在一定時間后恢復到營養鹽充足時的水平,本研究也得出相似結論。大量研究表明,氮限制時,隨氮濃度的降低,Fv/Fm下降幅度逐漸增大,重新添補氮源后,Fv/Fm開始恢復,24 h后可恢復至原來水平(Steglich et al.,2001;Young and Beardall,2003;尹翠玲,2006)。這主要是因為氮元素是蛋白質、葉綠素與光合作用有關的酶的必要組成成分,當氮缺乏時,光系統Ⅱ(PSⅡ)吸收的光能大于需求光能,致使PSⅡ的活性反應中心部分損壞,光能轉化效率和電子傳遞效率降低,從而導致Fv/Fm下降(Steglich et al.,2001;Geider et al.,2010)。ΦPSⅡ是光照條件下光合反應中心的實際光化學量子產量,可用來衡量藻類的實際光合效率,添加營養鹽后ΦPSⅡ的升高表明光能轉化效率升高,可為暗反應的光合碳同化積累更多能量,促進碳同化的高效運轉和有機物積累(尹翠玲,2006),與Fv/Fm的變化規律相吻合。
4 結論
氮缺乏會抑制銅綠微囊藻的分裂增殖及其正常代謝過程,但這種抑制作用隨著氮補充時間的延長而減弱;在氮補充后,銅綠微囊藻葉綠素a、類胡蘿卜素和藻膽蛋白的含量雖然呈升高趨勢,但很難恢復至正常水平。Fv/Fm等葉綠素熒光參數對氮營養鹽缺乏后再補充具有良好的響應作用,可作為營養鹽監測的指示指標。
參考文獻:
陳衛民,戴樹桂,張清敏. 2010. 銅綠微囊藻競爭機制的探討[J]. 安全與環境學報,19(5):73-77. [Chen W M,Dai S G,Zhang Q M. 2010. Tracing the competition mechanism of Microcystis aeruginosa[J]. Journal of Safety and Environment,19(5):73-77.]
戴立洲,成小英,俞珊,雍佳君,李婉璐,張清春,慕亞南. 2015. 豆瓣菜有機提取物對銅綠微囊藻的抑制及成分初步分離[J]. 環境科學學報,35(12):4159-4168. [Dai L Z,Cheng X Y,Yu S,Yong J J,Li W L,Zhang Q C,Mu Y N. 2015. Inhibitory effects of organic solvent extract from Nasturtium officinale on Microcystis aeruginosa associated with isolation of the allelochemical ingredients[J]. Acta Scientiae Circumstantiae,35(12): 4159-4168.]
谷兵,張達娟,王沂,包志明,王雪瑩,余海軍. 2017. 鐵對紫球藻生長及可溶性蛋白和胞外多糖含量的影響[J]. 江蘇農業科學,45(1):159-162. [Gu B,Zhang D J,Wang Y,Bao Z M,Wang X Y,Yu H J. 2017. Effects of Fe on the growth,soluble protein and extracellular polysaccharose content of Porphyridium cruentum[J]. Jiangsu Agricultu-ral Sciences,45(1):159-162.]
顧崗. 1996. 太湖藍藻暴發成因及其富營養化控制[J]. 環境監測管理與技術,8(6):17-19. [Gu G. 1996. Reason and control on bluegreen algae fast growth of eutrophication in Taihu Lake[J]. The Administration and Technique of Environmental Monitoring,8(6):17-19.]
姜小玉,趙閃閃,褚一凡,陳艷,李杲光,靳同霞,馬建敏. 2019. 氮濃度對銅綠微囊藻、大型溞和金魚藻三者相互作用的影響[J]. 水生生物學報,43(2):439-447. [Jiang X Y,Zhao S S,Chu Y F,Chen Y,Li G G,Jin T X,Ma J M. 2019. Impacts of nitrogen concentration on the intera-ctions among Microcystis aeruginosa,Daphnia magna and Ceratophyllum demersum[J]. Acta Hydrobiologica Sinica,43(2):439-447.]
孔繁翔,曹煥生,譚嘯. 2010. 水華藍藻復蘇的研究進展與水華預測[J]. 環境監控與預警,2(1):1-4. [Kong F X,Cao H S,Tan X. 2010. Development of research on recruitment of bloom-forming cyanobacteria and blooms forecast[J].Environmental Monitoring and Forewarning,2(1):1-4.]
孔繁翔,高光. 2005. 大型淺水富營養化湖泊中藍藻水華形成機理的思考[J]. 生態學報,25(3):589-595. [Kong F X,Gao G. 2005. Hypothesis on cycanbacteria bloom-forming mechanism in large shallow eutraophic lakes[J]. Acta Ecologica Sinica,25(3):589-595.]
雷鵬,孫成渤. 2015. 不同氮磷比對水華微囊藻生長特性的影響[J]. 環境科學與技術,38(12):27-31. [Lei P,Sun C B. 2015. The Influence for growth characteristics of Miscrocystis flosaquae in different N/P ratios[J]. Environmental Science & Technology,38(12):27-31.]
李杰,歐丹云,宋立榮. 2008. 微囊藻衰亡過程研究——四種模擬脅迫條件下微囊藻的衰亡生力[J]. 湖泊科學,20(5):549-555. [Li J,Ou D Y,Song L R. 2008. Decline of Microcystis aeruginosa FACHB-905 under four stress conditions[J]. Journal of Lake Sciences,20(5):549-555.]
李小路,潘慧云,徐潔,鮮啟鳴,高士祥,尹大強,鄒慧仙. 2008. 金魚藻與銅綠微囊藻共生情況下的化感作用[J].環境科學學報,28(11):2243-2249. [Li X L,Pan H Y,Xu J,Xian Q M,Gao S X,Yin D Q,Zou H X. 2008. Allelopathic effects of Ceratophyllum demersum and Microcystis aeruginosa in co-cultivation[J]. Acta Scientiae Circumstantiae,28(11):2243-2249].
梁英,馮力霞,田傳遠,尹翠玲. 2006. 鹽脅迫對塔胞藻生長及葉綠素熒光動力學的影響[J]. 中國海洋大學學報,36(5):726-732. [Liang Y,Feng L X,Tian C Y,Yin C L. 2006. Effects of salt stress on the growth and chlorophyll fluorescence of Pyramidomonas sp.[J]. Periodical of Ocean University of China,36(5):726-732.]
孫凱峰,肖愛風,劉偉杰,何寧,段舜山. 2017. 氮磷濃度對惠氏微囊藻和斜生柵藻生長的影響[J]. 南方水產科學,13(2):69-76. [Sun K F,Xiao A F,Liu W J,He N,Duan S S. 2017. Effect of nitrate and phosphate concentration on growth of Microcystis wesenbergii and Scenedesmus obliquus[J]. South China Fisheries Science,13(2):69-76.]
孫穎穎,王長海,劉筱瀟. 2010. 滸苔提取物對4種赤潮微藻生長的抑制作用[J]. 環境科學,31(6):1662-1669. [Sun Y Y,Wang C H,Liu X X. 2010. Growth inhibition of the four species of red tide microalgae by extracts from Enteromorpha prolifera extracted with the five solvents[J]. Environmental Science,31(6):1662-1669.]
王璐瑤,桑敏,李愛芬,張成武. 2012. 不同缺氮營養水平對金色奧杜藻生長及光合生理的影響[J]. 中國生物工程雜志,32(6):48-56. [Wang L Y,Sang M,Li A F,Zhang C W. 2012. Effects of different nitrogen nutrition level on the growth and photosynthetic physiology of Odontella aurita[J].China Biotechnology,32(6):48-56.]
王曼. 2013. 浮游植物葉綠素a 4種提取方法的比較[J]. 中國實用醫藥,8(22):263-264. [Wang M. 2013. Comparison on the 4 extraction method for chlorophyll a in phytoplankton[J]. China Practical Medicine,8(22):263-264.]
王昭玉. 2013. 葉綠素熒光參數對氮、磷限制的響應及其在赤潮生消過程中的變化特征研究[D]. 青島:中國海洋大學. [Wang Z Y. 2013. Responses of chlorophyll a flurescence parameter to nitrogen or phosphorus limition and variation of chlorophyll a fluprescence parameter during the process of algal blooms[D]. Qingdao: Ocean University of China.]
許海,吳雅麗,楊桂軍,朱廣偉,秦伯強. 2014. 銅綠微囊藻、斜生柵藻對氮磷饑餓的耐受能力研究[J]. 生態科學,33(5):879-884. [Xu H,Wu Y L,Yang G J,Zhu G W,Qin B Q. 2014. Tolerance of Microcystis aeruginosa and Scendesmus obliquus to nitrogen and phosphorus deficiency[J]. Ecological Science,33(5):879-884.]
許慧萍. 2014. 氮磷營養鹽對水華微囊藻群體的影響研究[D]. 無錫:江南大學. [Xu H P. 2014. Study of effect of nitrogen and phosphorous on colony of Microcystis[J]. Wuxi: Jiangnan University.]
尹翠玲. 2006. 營養鹽限制對6株微藻葉綠素熒光特性的影響[D]. 青島:中國海洋大學. [Yin C L. 2006. Effects of nutrient limition on the chlorophyll fluorescence of 6 microalgal strains[D]. Qingdao: Ocean University of China.]
曾玲,文菁,徐春曼. 2011. 氮、磷對微藻生長和產毒的影響[J]. 湛江師范學院學報,32(6):103-108. [Zeng L,Wen J,Xu C M. 2011. Effects of nitrogen and phosphorus on the growth and toxin production of microalgae[J]. Journal of Zhanjiang Normal College,32(6):103-108.]
張媛媛,戴偉,張樹林,畢相東,張達娟. 2015. 光照歷史對小檗堿化感抑藻效應的影響[J]. 水生態學雜志,36(1):88-93. [Zhang Y Y,Dai W,Zhang S L,Bi X D,Zhang D J. 2015. Effects of light acclimation on allelopathic inhibition of Microcystis aeruginosa by berberine[J]. Journal of Hydroecology,36(1):88-93.]
周健,楊桂軍,秦伯強,張光生,許慧萍. 2014. 氮磷對銅綠微囊藻群體形態的影響[J]. 環境科學研究,27(11):1251-1257. [Zhou J,Yang G J,Qin B Q,Zhang G S,Xu H P. 2014. Effects of nitrogen and phosphorous on colony formation of Microcystis aeruginosa[J]. Research of Environmental Sciences,27(11):1251-1257.]
Amano Y,Sakai Y,Sekiya T,Takeya K. 2010. Effect of phosphorus fluctuation caused by river water dilution in eutrophic lake on competition between blue-green alga Microcystis aeruginosa and diatom Cyclotella sp.[J]. Journal of Environmental Sciences,22(11):1666-1673.
Codd G A. 2000. Cyanobacterial toxins,the perception of water quality,and the prioritisation of eutrophication control[J]. Ecological Engineering,16(1):51-60.
Geider R J,Roche J L,Greene R M,Olaizola M. 2010. Response of the photosynthetic apparatus of Phaeodactylum tricornutum(Bacillariophyceae) to nitrate,phosphate,or iron starvation[J]. Journal of Phycology,29(6):755-766.
Kolber Z,Zehr J,Falkowski P. 1988. Effects of growth irra-diance and nitrogen limitation on photosynthetic energy conversion in photosystemⅡ[J]. Plant Physiology,88(3): 923-929.
Schindler D W. 2006. Recent advances in the understanding and management of eutrophication[J]. Limnology and Oceanography,51(1): 356-363.
Smith V H. 1986. Light and nutrient effects on the relative biomass of blue-green algae in lake phytoplankton[J]. Canadian Journal of Fisheries and Aquatic Sciences,43:148-153.
Steglich C,Behrenfeld M,Koblizek M,Claustre H,Penno S,Prasil O,Partensky F,Hess W R. 2001. Nitrogen deprivation strongly affects Photosystem II but not phycoerythrin level in the divinyl-chlorophyll b-containing cyanobacterium Prochlorococcus marinus[J]. Biochimica et Biophysica Acta,1503(3):341-349.
Xie L,Xie P,Li T H,Liu H. 2003. The low TN∶TP ratio,a cause or a result of Microcystis blooms?[J]. Water Research,37(9): 2073-2080.
Young E B,Beardall J. 2003. Photosynthetic function in Dunaliella tertiolecta(Chlorophyta) during a nitrogen starvation and recovery cycle[J]. Journal of Phycology,39(5): 897-905.
(責任編輯 蘭宗寶)

