UV-B輻射對神農香菊萜類物質合成及其相關基因表達的影響
何淼 王霽佳 高文杰 劉洋 周蘊薇


摘 要: 該研究以神農香菊為材料,用強度為400 μw·cm-2的紫外光UV-B對其進行輻射處理,輻射時間分別為0、0.5、1、2、4 h,探討了UV-B輻射對神農香菊萜類物質合成及其相關基因表達的影響。結果表明:(1)較短時間的UV-B輻射對神農香菊萜類物質合成相關基因表達量有明顯的促進作用。與對照相比,0.5、1、2、4 h處理對相關基因表達量均有不同程度的提高;在2 h處理下HMGR、DXR、TPS、GPS基因的相對表達量達到最大值,在4 h處理下FPS和DXS的相對表達量達到最大值,其中FPS基因表達量變化最顯著,為對照的69倍。(2)MVA途徑中,去氫白菖烯、杜松萜烯的含量與FPS基因表達量4 h內持續上升的變化趨勢保持一致,1-石竹烯與HMGR的變化趨勢保持一致,表現為先升高后降低。(3)MEP合成途徑中,α-側柏酮、崖柏酮、β-側柏酮的含量呈現與DXR、GPS、TPS基因表達量相同的變化趨勢,桉樹腦在UV-B輻射4 h內持續上升,與DXS基因的變化一致。由此可以推斷,UV-B輻射通過影響各自途徑中一些關鍵基因的表達量,進而影響了神農香菊萜類物質的合成量。
關鍵詞: 神農香菊, UV-B輻射, 萜類物質, 基因表達
中圖分類號: S682.1 ?文獻標識碼: A ?文章編號: 1000-3142(2019)07-0933-07
Abstract: In this study, Chrysanthemum indicum var. aromaticum was used as material. We examined the changes of biosynthesis of terpenoid and expression of related genes in C. indicum var. aromaticum following the treatment of different durations (0, 0.5, 1, 2, 4 h) of 400 μw·cm-2 UV-B radiation. The results were as follows: (1) The short time of UV-B radiation could significantly promote the expression of related genes in C. indicum var. aromaticum. Compared with the control, 0.5, 1, 2, 4 h treatment of UV-B radiation increased the expression of related genes. Meanwhile, relative expressions of HMGR, DXR, TPS, GPS reached the peak after two hours’ treatment of UV-B radiation. As well as the relative expressions of FPS and DXS reached the maximum at four hours’ treatment. A significant increase in FPS gene expression was found when plant exposed to four hours of UV-B duration (69 times compared with control). (2) In mevalonate pathway(MVA), the contents of calamenene, cadinene increased following the change of FPS gene expression during four hours of UV-B radiation. The change of the content of 1-caryophyllene was consistent with the change of HMGR gene expression, which increased first and then decreased. (3) In the pathway of 2-methyl-D-erythritol-4-phosphate (MEP), the contents of α-thujone, thujone and β-thujone showed the same trend as the expressions of DXR, TPS and GPS. The content of cajuputole generally increased during four hours’ treatment responding to the change of DXS gene expression. In summary, the data indicate that UV-B radiation can change the regulation of terpenoid biosynthesis in C. indicum var. aromaticum by affecting some key genes’ expressions.
Key words: Chrysanthemum indicum var. aromaticum, UV-B radiation, terpenoid, gene expression
神農香菊(Chrysanthemum indicum var. aromaticum)是菊科菊屬植物,分布于湖北神農架地區(劉啟宏和張樹藩,1983),有清熱解毒、殺菌消炎、平肝明目、散風降壓的功效(劉啟紅等,1986)。神農香菊全株都具有特殊的香氣,因此成為菊科菊屬中重要的芳香型觀賞花卉。神農香菊這種自然香氣在菊科植物中十分罕見,不僅具有廣闊的園林應用前景,而且對研發具有濃香型菊科新品種具有重要的意義。在我們課題組前期的研究中已經發現神農香菊葉片、花瓣表面均密被腺毛。神農香菊植株的香氣與腺毛分泌物中的萜烯類等化合物有密切關系(何淼等,2015),而與萜類化合物合成相關的基因可以有效調控植物體內的萜類化合物的種類和含量。
萜類化合物是指由不同數量的異戊二稀(C5H8)單元所組成的化合物及其衍生物。目前已經發現了兩條主要的萜類物質生物合成途徑,甲羥戊酸途徑(mevalonate pathway, MVA)和甲基赤蘚糖醇-4-磷酸途徑(methylerythritol-4-phosphate pathway, MEP )(Dudareva et al., 2005)。植物萜類化合物生物合成途徑中的相關酶種類多種多樣,酶基因不僅決定了后續反應中合成萜類產物的種類,還對產物積累的量具有重要調控作用。目前研究較多的有位于MVA 途徑中的HMGR、FPS等(Chappell, 1995;嵇保中等,2007),以及位于MEP途徑的DXS、DXR、GPS等(Malhotra et al., 2014;張玲等,2013)。而TPS同時位于兩種途徑的下游,催化底物生成單萜、倍半萜或二萜(Martin et al., 2012)。這些關鍵酶基因可以催化形成萜類化合物的各種前體以及中間體(唐亮等,2014),它們位于合成途徑的重要分支點或者在產物形成的下游位置。若是能通過生物學手段來調節這些關鍵酶基因在植物體內的相對表達量,就可以不斷地來提高相關萜類物質的產量。植物萜類化合物的合成在受植物不同發育階段影響的同時,昆蟲、病原菌等生物以及光照、溫度、濕度等非生物因子也對植物萜類的生物合成產生影響(梁宗鎖等,2017)。在光生態因子中,UV-B輻射是極其重要的一類,它能直接或間接影響植物的形態、生物量、光合作用、生理代謝、蛋白質和核酸等,從而影響植物的生長發育(蒲曉宏等,2017)。受UV-B輻射后一些植物的基因表達、酶活性及次生代謝均會發生變化(Searles et al., 2001)。
本研究利用紫外線UV-B對引種于湖北神農架地區的神農香菊進行輻射處理,采用GC/MS和qRT-PCR技術對不同輻射時間下的神農香菊葉片萜類物質及其相關基因進行檢測分析,初步從UV-B輻射對神農香菊萜類物質合成及其相關基因表達方面進行相關影響的研究。
1 材料與方法
1.1 材料
神農香菊引自湖北神農架地區(110°23′57″ E, 31°28′07″ N),并成功培育于東北林業大學園林學院苗圃內。2017年5月選取長勢整齊一致的神農香菊健壯莖尖進行扦插,待扦插苗生根后,換土上盆,在東北林業大學園林學院溫室中培養。植株培養35 d左右,待長出7~8片功能葉時,取生長健壯、整齊一致、無病蟲害的植株進行試驗。
1.2 方法
1.2.1 UV-B輻射處理 選擇長勢一致的神農香菊植株,用UV-B 紫外燈(南京華強電子有限公司)進行輻射處理。以植株上數第3片功能葉輻射強度為400 μw·cm-2(由深圳欣寶瑞儀器有限公司生產的UV340B紫外線輻照計測定)設置UV-B 紫外燈輻射強度。將用于試驗的神農香菊植株分為5個組,每組5棵,3次重復。分別輻射0、0.5、1、2、4 h。在5個不同UV-B輻射時間內取樣,5個分組各取3 g植株的第3片功能葉片(12~15片葉),使用液氮速凍保存到-80 ℃冰箱備用。
1.2.2 神農香菊萜類物質合成相關基因分析 按照TRNzoI Universal總RNA提取試劑(TIANGEN)說明書提取不同處理后神農香菊葉片總RNA,ReverTra Ace qPCR RT Master Mix with gDNA Remover反轉錄試劑盒合成cDNA,樣品保存于-20 ℃冰箱。依據神農香菊轉錄組數據中 HMGR、DXR、TPS、GPS、FPS、DXS基因序列,用Primer Premier 5.0軟件設計相應引物。根據熒光定量試劑盒(TransStart Top Green qPCRSuperMix)以CmEF1α為內參基因進行熒光定量PCR,每個樣品做3個重復。用于qRT-PCR檢測的引物序列見表1。利用公式2-△△Ct進行基因相對表達量的計算(Livak & Schmittgen, 2001)。
1.2.3 神農香菊葉片萜類物質提取與分析 將保存于-80 ℃冰箱的神農香菊葉片材料放入研缽中充分研磨至粉末狀,先后在3個裝有100 mL二氯甲烷的燒杯中浸提,分別浸提3次,每次浸提2 s,用裝有20 g無水硫酸鈉的漏斗將浸提液過濾至圓底燒瓶中,接著置于旋轉蒸發儀中40 ℃濃縮,隨后將濃縮液移至棕色進樣瓶中,并定容至0.5 mL,保存于0 ℃冰箱中備用(Hu et al., 2012)。
采用GC-MS氣質聯用儀(美國Hewlett-Packard公司)對葉片表面分泌物進行分析。GC條件:色譜柱HP-5MS(30 m×0.25 mm×0.25 μm)彈性石英毛細管柱;進樣量1 μL;分流比5∶1;程序升溫,首先設定50 ℃時間30 min,隨后以5 ℃·min-1的速率升溫至160 ℃,最終設定溫度升高的速率為10 ℃·min-1,升至270 ℃,溶劑延遲時間設為3.5 min。MS條件:以EI源為電離方式,設置儀器四極桿的溫度為150 ℃,離子源的溫度為230 ℃,接口的溫度為280 ℃,電離能量設為70 eV,電子倍增器的電壓設置2 100 V,掃描范疇(m/z)4~500,標準質譜圖庫NIST08L。
鑒定方法:采用Turbo Mass 5.4.2 GC/MS軟件對神農香菊的萜類物質進行分析。利用峰面積歸一法對每種組分的相對含量進行計算。
1.3 數據處理與分析
所得數據使用SPASS17.0進行相關性分析,采用Excel 2003進行計算和繪制圖表。
2 結果與分析
2.1 UV-B輻射對神農香菊萜類物質合成相關基因表達量的影響
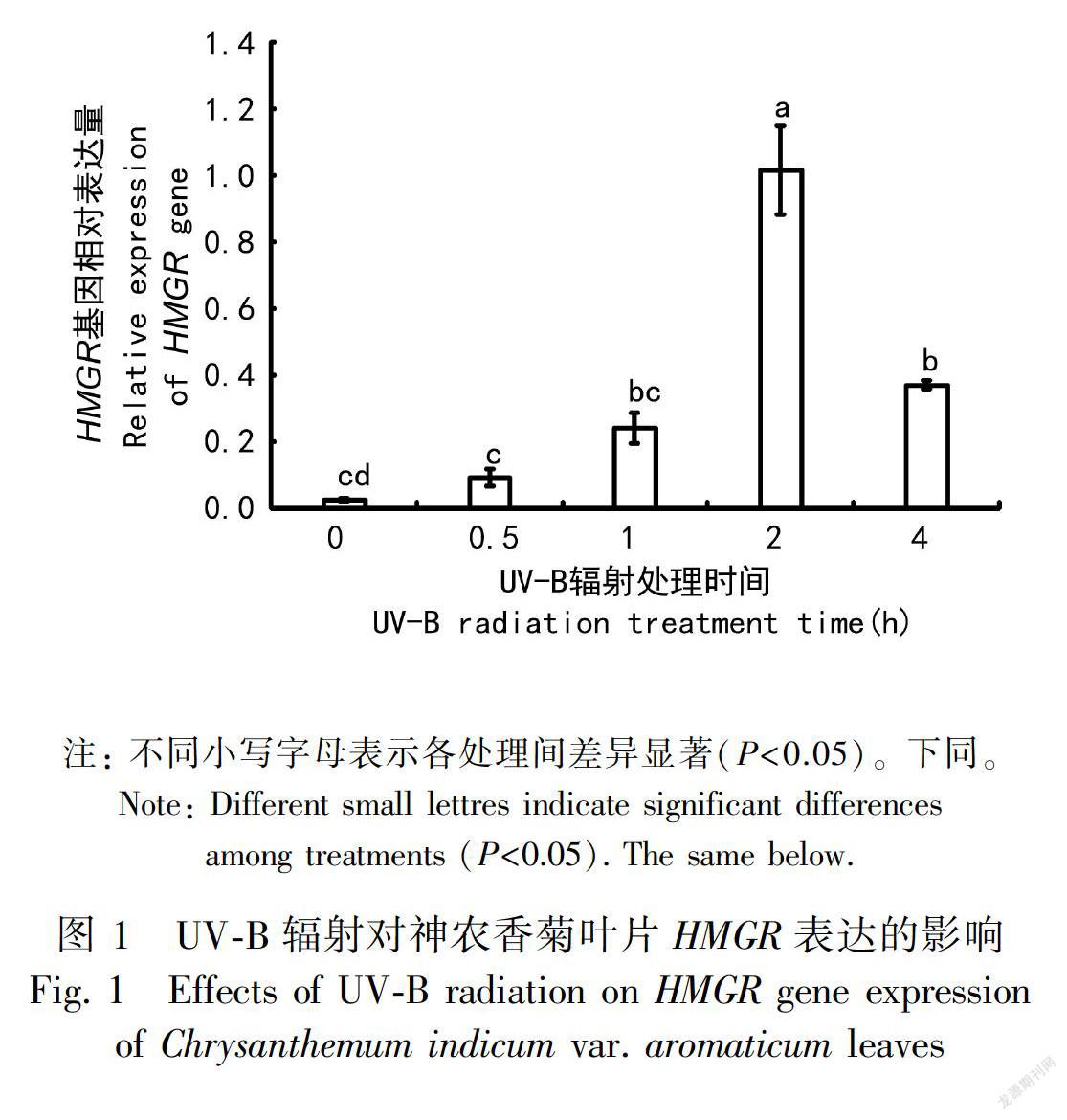
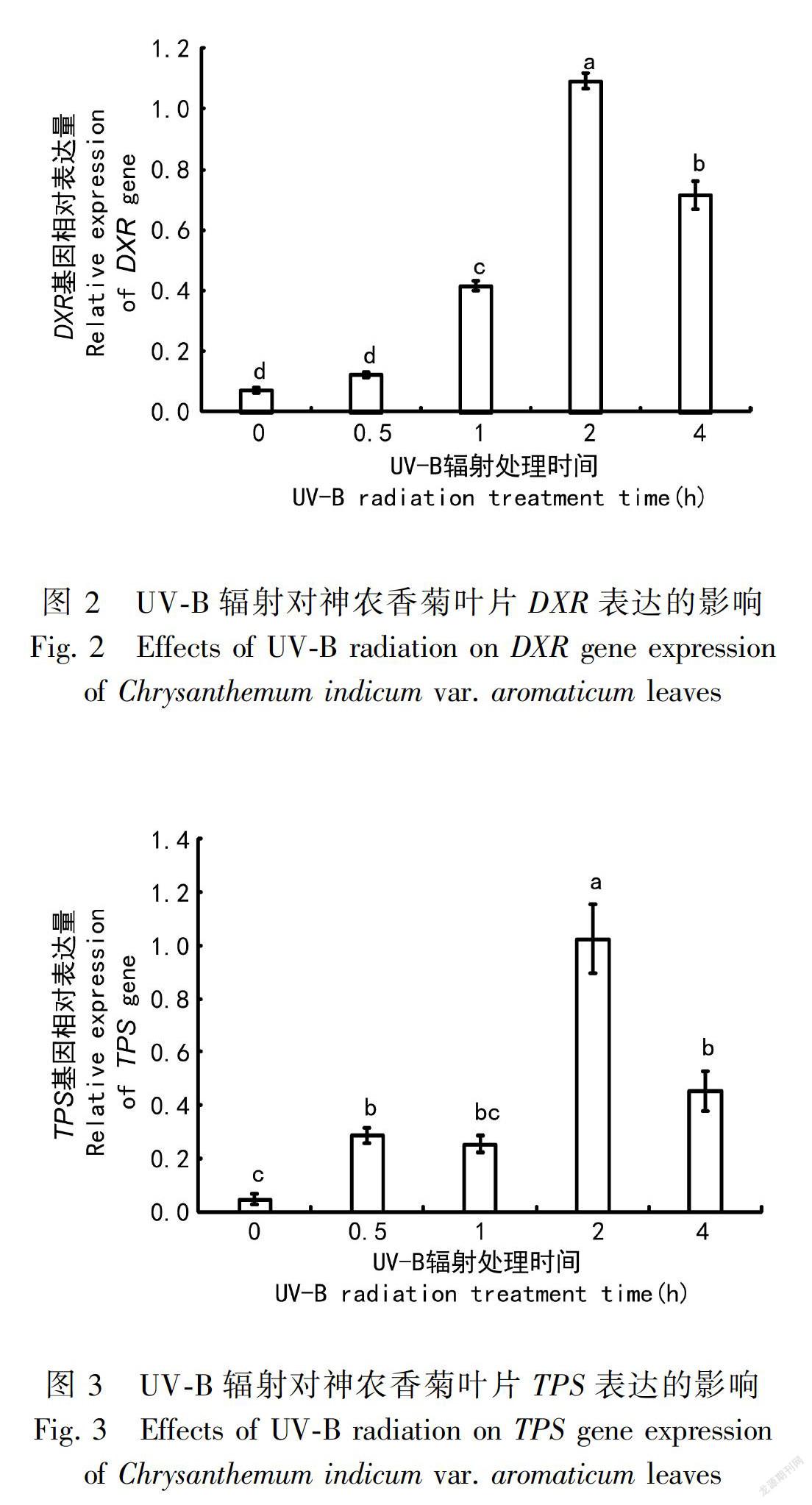
以神農香菊CmEF1α為內參基因,在UV-B輻射4 h內采用qRT-PCR技術對HMGR、DXR、TPS、GPS、FPS、DXS的表達強度情況進行檢測,圖1至圖4的結果顯示如下:隨著UV-B輻射處理時間的延長,HMGR、DXR、TPS、GPS基因表達量先升高后降低。HMGR、DXR、TPS、GPS基因表達量在UV-B輻射期間的前0~1 h平穩增長,在輻射的第2小時相對表達量出現明顯升高,均達到輻射處理期間的最大值,對比0 h的相對表達量差異性顯著,變化幅度也最高,但在隨后的第4小時卻出現明顯下降趨勢。
FPS和DXS的相對表達量在UV-B輻射處理期間出現明顯變化(圖5,圖6),具體表現為FPS基因的相對表達量在0.5 h內急劇上升后在2 h內變化較小,相對表達量在第4小時達到最大值,此時FPS基因的相對表達量較UV-B輻射處理0 h有顯著性差異,總體上呈現一直上升的趨勢;DXS基因的相對表達量在0.5 h內變化不明顯,在第1小時和第2小時內上升迅速,在第4小時達到最大值,這時DXS基因的相對表達量較0 h有顯著性差異,總體上呈現一直上升的趨勢。FPS和DXS的相對表達量在UV-B輻射處理期間隨著時間的延長而一直上升,在第4小時時達到最大值。其中FPS基因表達量變化最顯著,在4 h為對照的69倍。
2.2 UV-B輻射對神農香菊萜類物質合成的影響
MVA途徑參與植物萜類物質中倍半萜、三萜及多萜合成,而MEP途徑參與單萜、二萜和四萜的生物合成。本研究主要研究位于MVA合成途徑的倍半萜α-蓽澄茄油烯、1-石竹烯、去氫白菖烯、杜松萜烯和位于MEP合成途徑的單萜桉樹腦、左旋樟腦、α-側柏酮、崖柏酮和β-側柏酮。對HMGR、DXR、TPS、GPS、FPS、DXS表達量進行分析后,本研究選擇變化較顯著的2 h和4 h進行神農香菊次生代謝產物中的萜類物質合成量的檢測。
由表2可知,位于MVA合成途徑的烯萜類物質的相對含量隨著UV-B輻射時間的延長呈現不同趨勢的變化。α-蓽澄茄油烯呈現先降低后升高的變化趨勢,在0、2、4 h的相對含量分別為17.04%、15.37%、18.05%;1-石竹烯呈先顯著增加后再減少的趨勢,0、2、4 h的相對含量分別為2.61%、28.36%、21.32%。去氫白菖烯和杜松萜烯呈持續增長的趨勢。去氫白菖烯在0、2、4 h的相對含量分別為4.51%、5.32%、7.97%;杜松萜烯在0、2、4 h的相對含量分別為0.7%、1.65%、3.16%。
隨著UV-B輻射時間的延長,位于MEP合成途徑的樟腦類桉樹腦的相對百分含量呈持續升高的趨勢,其0、2、4 h分別為4.76%、5.93%、10.63%;左旋樟腦的相對含量呈持續降低的趨勢,在0、2、4 h分別為6.04%、4.1%、2.1%。
MEP合成途徑中醇酮類物質α-側柏酮、崖柏酮和β-側柏酮的相對百分含量隨著UV-B輻射時間的延長呈現先升高后降低的趨勢,除α-側柏酮外4 h時的相對含量均高于0 h。α-側柏酮在處理0、2、4 h時的相對含量分別為1.9%、2.63%、1.31%;崖柏酮在0、2、4 h時的相對含量分別為0.68%、1.01%、0.97%;β-側柏酮在0、2、4 h時的相對含量分別為6.34%、10.36%、8.36%。
3 討論
UV-B輻射對植物的遺傳物質造成影響,包括對植物基因表達的影響(Hartmann et al., 1998;Safrany et al., 2008)。Dolzhenko et al.(2010)研究發現UV-B輻射會改變胡椒薄荷(Mentha piperita)萜類物質生物合成基因的表達。本研究同樣也發現UV-B輻射對神農香菊萜類物質合成相關基因HMGR、DXR、TPS、GPS、FPS、DXS的表達量均產生影響,并且不同的UV-B輻射時間對基因表達量產生不同程度的影響(齊艷等,2014)。MVA途徑中HMGR基因的表達量在UV-B輻射4 h內先升高后降低,而FPS持續上升。MEP途徑中的DXR、GPS和TPS基因在處理期間先升高后降低,DXS卻持續上升。根據這一結果推測UV-B輻射對分屬于同一途徑不同基因的表達量產生的影響也不完全相同。
植物次生代謝產物的合成主要受合成途徑中的一系列合成酶的活性和基因的表達量所決定(Broun, 2004)。本研究發現MVA途徑中,去氫白菖烯、杜松萜烯的相對含量與FPS基因表達量的變化趨勢保持一致。1-石竹烯與HMGR的變化保持一致。MEP合成途徑中,α-側柏酮、崖柏酮、β-側柏酮的相對含量呈現與DXR、GPS、TPS基因表達量相同的變化。桉樹腦與DXS基因的變化一致。這些結果表明,UV-B輻射通過影響各自途徑中一些關鍵基因的表達量,進而在一定程度上影響了神農香菊萜類物質的合成量。在植物萜類物質代謝途徑中,改變MVA和MEP兩條萜類代謝途徑的關鍵酶的表達量,可以影響下游代謝產物的合成量發生變化(Enfissi et al., 2005;Morris et al., 2006)。
本研究結果發現,UV-B輻射對神農香菊萜類物質合成的相關基因表達量可產生一定的影響,而且在較短的輻射時間內對本研究中的酶基因表達量都有明顯的促進作用,在研究的4 h內萜類合成相關基因的表達量均高于對照,但對不同種酶基因的促進程度不完全相同。在各自的合成途徑中,本研究中的萜類物質大都呈現與該途徑中的關鍵基因相同的變化趨勢,在短期UV-B輻射下化合物合成量高于對照,呈現不同程度的促進作用。而位于MVA途徑的α-蓽澄茄油烯在4 h內先降低后升高不同于HMGR、FPS這兩個關鍵基因的變化趨勢,位于MEP合成途徑的左旋樟腦相對含量在4 h內持續降低不同于DXR、GPS、TPS和DXS的變化趨勢。這一結果說明萜類物質在各自的合成途徑中不只是受一些關鍵基因的調控,而是有著更為復雜的分子機制,有關這一機制有待深入研究。
參考文獻:
BROUN P, 2004. Transcription factors as tools for metabolic engineering in plants [J]. Curr Opin Plant Biol, 7(2): 202-209.
CHAPPELL J, 1995. The biochemistry and molecular biology of isoprenoid metabolism [J]. Plant Physiol, 107(1): 1-6.
DOLZHENKO Y, BERTEA CM, OCCHIPINTI A, et al., 2010. UV-B modulates the interplay between terpenoids and flavonoids in peppermint (Mentha × piperita L.) [J]. J Photochem Photobiol B-Biol,100(2): 67-75.
DUDAREVA N, ANDERSSON S, ORLOVA I, et al., 2005. The nonmevalonate pathway supports both monoterpene and sesquiterpene formation in snapdragon flowers [J]. Proc Natl Acad Sci USA, 102(3): 933-938.
ENFISSI EMA, FRASER PD, LOIS LM, et al., 2005. Metabolic engineering of the mevalonate and non-mevalonate isopentenyl diphosphate-forming path ways for the production of health-promoting isoprenoids in tomato [J]. Plant Biotechnol J, 3(1): 17-27.
HARTMANN U, VALENTINE WJ, CHRISTIE JM, et al.,1998. Identification of UV/blue light-response elements in the Arabidopsis thaliana chalcone synthase promoter using a homologous protoplast transient expression system [J]. Plant Mol Biol, 36(5): 741-754.
HE M, LIU YZ, ZHANG R, et al., 2015. Dendranthema indicum var. aromaticum epidermal hairs and glandular hair secretions [J]. J NE For Univ, 43(9): 117-120. [何淼, 劉穎竹, 張蕊, 等, 2015. 神農香菊表皮毛特征及腺毛分泌物成分 [J]. 東北林業大學學報, 43(9): 117-120.]
HU B, HONG L, LIU X, et al., 2012. Comparative study of the tissue-specific distribution of ABA from Arachis hypogaea L. and expression of the 9-CIS epoxycarotenoid dioxygenase 1 (AhNCED1) during plant development [J]. Biotechnol Biotechnol Equip, 26(5): 3201-3205.
JI BZ, LIU SW, TIAN L, et al., 2007. Advances in studies on juvenile hormone biosynthesis [J]. Chin Bull Life Sci, 19(1): 90-96. [嵇保中, 劉曙雯, 田鈴, 等, 2007. 保幼激素生物合成研究進展 [J]. 生命科學, 19(1): 90-96.]
LIANG ZS, FANG YM, YANG DF,2017. Biosynthesis segulation and metabolic engineering of terpenoids in plants [J]. J Zhejiang Sci-Technol Univ (Nat Sci Ed), 37(2): 255-264. [梁宗鎖, 方譽民, 楊東風, 2017. 植物萜類化合物生物合成與調控及其代謝工程研究進展 [J]. 浙江理工大學學報(自然科學版), 37(2): 255-264.]
LIVAK KJ, SCHMITTGEN TD, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J]. Methods, 25(4): 402-408.
LIU QH, CHEN YL, LI GY, 1986. The research of introduction and propagation of Dendranthema indicum var. aromaticum [J]. J Wuhan Bot Res,4(1):105-106. [劉啟紅, 陳英蘭, 李廣彥, 1986. 神農香菊引種和繁殖研究 [J]. 武漢植物學研究, 4(1): 105-106.]
LIU QH, ZHANG SP, 1983. A new variety of Dendranthema Gaertn from Shennongjia of Hubei [J]. J Wuhan Bot Res, 1(2): 237-238. [劉啟宏, 張樹藩, 1983. 神農架菊屬一新變種 [J]. 武漢植物學研究, 1(2): 237-238.]
MALHOTRA N, KUMAR V, SOOD H, et al., 2014. Multiple genes of mevalonate and non-mevalonate pathways contribute to high aconites content in an endangered medicinal herb, Aconitum heterophyllum Wall [J]. Phytochemistry, 108(12): 26-34.
MARTIN DM, CHIANG A, LUND ST, et al., 2012. Biosynthesis of wine aroma: Transcript profiles of hydroxymethylbutenyl diphosphate reductase, geranyl diphosphate synthase, and linalool/nerolidol synthase parallel monoterpenol glycoside accumulation in Gewürztraminer grapes [J]. Planta, 236(3): 919-929.
MORRIS WL, DUCREUX LJM, HEDDEN P, et al., 2006. Overexpression of a bacterial 1-deoxy-D-xylulose-5-phosphate synthase gene in potato tubers perturbs the isoprenoid metabolic network: Implication for the control of the tuber life cycle [J]. J Exp Bot, 57(12): 3007-3018.
PU XH, YUE XL, AN LZ, 2017. The response of plant to UV-B radiation [J]. Sci Sin (Vitae), 47(8): 818-828. [蒲曉宏, 岳修樂, 安黎哲, 2017. 植物對UV-B輻射的響應與調控機制 [J]. 中國科學:生命科學, 47(8):818-828.]
QI Y, XING YY, ZHENG H, et al., 2014. UV-A and UV-B involved in induction and regulation of anthocyanin biosynthesis in cabbage [J]. J Chin Agric Univ, 19(2):86-94. [齊艷, 邢燕霞, 鄭禾, 等, 2014. UV-A和UV-B提高甘藍幼苗花青素含量以及調控基因表達分析 [J]. 中國農業大學學報, 19(2):86-94.]
SAFRANY J, HAASZ V, MATE Z, et al., 2008. Identification of a novel cis-regulatory element for UV-B-induced transcription in Arabidopsis [J]. Plant J, 54(3): 402-414.
SEARLES PS, FLINT SD, CALDWELL MM, 2001. A meta-analysis of plant field studies simulating stratospheric ozone depletion [J]. Oecologia, 127(1): 1-10.
TANG L, MA X, ZHOU ZQ, 2014. An evolutionary study of plant terpene synthases [J]. J SW Univ (Nat Sci Ed), 36(4): 89-96. [唐亮, 馬香, 周志欽, 2014. 植物萜類合成酶的進化研究 [J]. 西南大學學報(自然科學版), 36(4): 89-96.]
ZHANG L, LIN SQ, HU YL, et al., 2013. Cloning of DXR gene and its expression analysis during fruit ripening in loquat [J]. J Fruit Sci, 30(4): 563-566. [張玲, 林順權, 胡又厘, 等, 2013. 枇杷DXR基因的克隆及其在果實成熟過程中的表達分析 [J]. 果樹學報, 30(4): 563-566.]

