端粒酶基因的腺病毒包裝條件優化及其活性功能驗證
賀小英 荊乾鴿 姜欣穎 袁婷 吳憲 佟瑞瑩 王晶妍 馬利兵
摘要:【目的】構建攜帶人類端粒酶催化亞基基因(hTERT)的腺病毒載體并優化其包裝條件,為進一步探究端粒酶與細胞重編程調控間的作用機理提供參考依據。【方法】利用腺病毒載體pAdEasy-1構建攜帶hTERT基因的重組腺病毒載體,分別采用脂質體法和電轉法及不同濃度胎牛血清在HKE293A細胞中進行包裝,篩選出最佳病毒包裝條件,收集重組腺病毒rAd-hTERT并體外感染小鼠胎兒成纖維細胞,驗證重組腺病毒rAd-hTERT的活性功能。【結果】以腺病毒載體pAdEasy-1為骨架質粒,成功構建獲得攜帶hTERT基因的重組腺病毒載體(pAd-hTERT),其最佳病毒包裝條件是采用脂質體法結合15%胎牛血清,此條件下收集獲得的病毒滴度最高(1×1011 IFU/mL)。以攜帶hTERT基因的腺病毒rAd-hTERT感染小鼠胎兒成纖維細胞72 h后,可擴增出片段大小約3450 bp的目的基因條帶,即hTERT基因在小鼠胎兒成纖維細胞中成功表達。【結論】采用脂質體法結合15%胎牛血清包裝獲得的攜帶hTERT基因重組腺病毒具有較高病毒滴度,感染小鼠胎兒成纖維細胞能成功表達hTERT基因,進一步證實端粒酶具有蛋白功能的生物學活性。
關鍵詞: 端粒酶;腺病毒;細胞重編程;載體構建;病毒包裝;功能驗證
中圖分類號: S814.8? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2019)06-1356-06
Abstract:【Objective】The aim of the study was to construct an adenoviral vector containing the telomerase catalytic subunit(hTERT) gene, optimize its packaging conditions and lay a foundation for further study of the interaction mechanism between telomerase and cell reprogramming. 【Method】The adenoviral vector containing the hTERT gene was constructed by using the AdEasy-1 system of recombinant adenovirus, and then it was packaged in HKE293A cells by liposome, electroporation and different serum concentrations of fetal bovine. The optimal packaging condition was selected. Recombinant adenovirus rAd-hTERT was collected and infected mouse fetal fibroblasts in vitro, and activity function of recombinant adenovirus rAd-hTERT was verified. 【Result】The recombinant adenoviral vector(pAd-hTERT) carrying hTERT gene was successfully constructed with recombinant adenovirus rAd-hTERT as skeleton plasmid. The optimal packaging condition was liposome method combining with 15% serum of fetal bovine. The titer of virus obtained under such condition was the highest(1×1011 IFU/mL). After 72 h of adenovirus(rAd-hTERT) carrying hTERT gene infected mouse fetal fibroblasts, target gene bands of 3450 bp was amplified, which meaned that hTERT gene was successfully expressed in mouse fetal fibroblasts. 【Conclusion】The recombinant adenovirus carrying hTERT gene has been successfully prepared by liposome method combining with 15% serum of fetal bovine. It has high virus titer. Infecting mouse fetal fibroblasts can successfully express hTERT gene, which further verifies that telomerase has biological activity of functional protein.
Key words: telomerase; adenovirus; cell reprogramming; vector construction; virus packaging; functional verification
收稿日期:2019-04-04
基金項目:國家自然科學基金項目(31560331,31660340);內蒙古自然科學基金項目[2017MS(LH)0213,2017MS0337]
作者簡介:賀小英(1978-),博士,副教授,主要從事動物細胞重編程及轉基因技術研究工作,E-mail:hxy1124@163.com
0 引言
【研究意義】端粒酶(Telomerase)是一種特殊的逆轉錄酶,能通過延長端粒進而參與細胞周期調控,而端粒酶基因是研究細胞衰老、癌癥致病機理及制備永生化細胞系的關鍵基因(Le?o et al.,2018;Spiegl-Kreinecker et al.,2018)。此外,端粒酶與細胞重編程密切相關,在細胞重編程過程中端粒酶主要調控端粒發生重編程(Shin et al.,2018),同時參與轉錄調控和代謝重編程(Zvereva et al.,2010)。因此,開展端粒酶基因研究是揭示細胞衰老、癌變及其重編程機制的關鍵。【前人研究進展】自2009年美國科學家伊麗莎白·布萊克本(Elizabeth H. Blackburn)、卡蘿爾·格雷德(Carol W. Greider)和杰克·紹斯塔克(Jack W. Szostak)因發現端粒和端粒酶是如何保護染色體而獲得諾貝爾生理學及醫學獎以來,端粒和端粒酶便成為生物學研究的熱門領域之一(鐘天映等,2009)。端粒酶不僅具有延長端粒長度的功能,還在調控細胞重編程的過程中發揮重要作用(Takasawa et al.,2018;賀小英等,2019)。Kinoshita等(2014)研究發現,當敲除供體細胞端粒酶催化亞基基因(TERT)使端粒酶失活后,細胞重編程中有75個基因表達上調,1571個基因表達下調,且多數與轉錄和表觀修飾有關。Nishino和Umezawa(2016)研究發現,人類誘導多能干細胞(iPSC)與親代細胞的TERT啟動子存在差異甲基化區域(DMR),進一步證實端粒酶可通過改變甲基化修飾水平而調控細胞重編程進程。Takasawa等(2018)研究發現,在重編程人類iPSC的過程中,iPSC的TERT呈高度甲基化修飾,但供體細胞甲基化修飾水平較低,說明甲基化TERT-DMR能上調iPSC的啟動子活性,從而調控細胞重編程進程。此外,Lanza等(2000)、Jeon等(2005)也曾研究發現克隆牛和克隆豬的端粒均發生重編程現象,這些研究結果進一步證實在體細胞核重編程過程中端粒酶調控端粒發生了重編程。至今,已在羊(Kishigami et al.,2008)、牛(Niemann et al.,2008)、豬(Cheng et al.,2012)和小鼠(Hidema et al.,2016)等不同物種上發現并證實端粒酶能有效提高細胞重編程效率。【本研究切入點】目前,有關端粒酶功能的研究主要集中在癌癥和細胞衰老方面,而與細胞重編程結合相關的研究較少。腺病毒載體具有感染效率高、不整合宿主染色體等優點,是研究端粒酶基因體外表達的最佳系統,其包裝效率則決定了目的基因表達的效果,因此非常有必要對腺病毒載體的包裝條件進行優化。【擬解決的關鍵問題】構建攜帶人類TERT基因(hTERT)的腺病毒載體,優化其包裝條件并鑒定端粒酶基因在小鼠胎兒成纖維細胞中的表達情況,為進一步探究端粒酶與細胞重編程調控間的作用機理提供參考依據。
1 材料與方法
1. 1 試驗材料
大腸桿菌BJ5183菌株和DH5α感受態細胞、腺病毒載體pAdEasy-1、pCI-neo-hTERT及HKE293A細胞系均由內蒙古科技大學細胞工程實驗室保存提供。DMEM培養、澳洲胎牛血清及0.25%胰酶等購自美國Gbico公司;脂質體2000購自Life公司;限制性內切酶Pac I和Pme I購自NEB公司;RT-PCR試劑盒及反轉錄試劑盒等購自北京全式金生物技術有限公司。
1. 2 重組腺病毒載體構建
參照He等(2011)的方法構建重組腺病毒載體。hTERT基因片段由pCI-neo-hTERT經Sal I和EcoR I雙酶切獲得,然后與pAdTrack-CMV穿梭載體連接,以獲得重組質粒pAdTrack-hTERT。經Pme I線性化處理后,共轉染pAdEasy-1骨架質粒,再通過轉化DH5α感受態細胞篩選陽性克隆,重組腺病毒載體命名為pAd-hTERT。
1. 3 病毒包裝及其滴度測定
以pAd-hTERT感染HKE293A細胞,熒光顯微鏡下監測病毒包裝效率,感染7~10 d收集病毒,經3次反復凍融獲得的病毒,命名為rAd-hTERT。用感染復數(MOI)測定法確定病毒量:將HKE293A細胞接種在6孔板中,每孔細胞量為106個,分別以2、5、10、25和50 μL病毒液感染HKE293A細胞,72 h后通過熒光及細胞形態觀察是否產生病理學效應(CPE),病毒MOI為10~20 PFU/細胞時估算上清液中的病毒量。
1. 4 包裝條件優化
為提高病毒滴度,采用不同方法和不同條件對病毒進行包裝,通過病毒滴度及熒光鑒定對比脂質體法和電轉法的包裝效率。脂質體法是DNA與脂質體2000按1∶3比例進行轉染;電轉法(BTX電轉儀)是參照周磊等(2015)研究得出的最優條件(300 V,75 μs,3次)。不同包裝條件:在脂質體2000轉染后的包裝過程分別添加不同濃度(10%、12%、15%和20%)澳洲胎牛血清。通過流式細胞儀轉染效率檢測及病毒MOI估算確定最佳病毒包裝條件。
1. 5 rAd-hTERT感染小鼠胎兒成纖維細胞
采用組織塊貼壁法體外分離培養小鼠胎兒成纖維細胞,同時解凍rAd-hTERT病毒滴液,分別以MOI為10~20 PFU/細胞感染小鼠胎兒成纖維細胞,2 d后熒光顯微鏡下觀察統計感染效率。
1. 6 RT-PCR鑒定rAd-hTERT活性功能
采用RT-PCR試劑盒提取陽性細胞mRNA:取3×105~5×105待測細胞加入500.0 μL TRIzol試劑,再加入100.0 μL氯仿,吸取水相層,加入0.25 mL異丙醇,取沉淀洗滌晾干后采用50.0 μL TE Buffer(RNase free)進行溶解并反轉錄合成cDNA。鑒定引物(5'-CCTGGAATCGGTCTGCTGCGC-3'和5'-CCCCCTA GCTGATCATCAGTCC-3')由上海捷瑞生物工程有限公司合成。PCR反應體系50.0 μL:10×LAGC Bu-ffer 25.0 μL,dNTP(2.5 mmol/L)8.0 μL,上、下游引物各1.0 μL,cDNA模板1.5 μL,LA Taq DNA聚合酶(5 U/μL)0.5 μL,以超純水補足至50.0 μL。擴增程序:95 ℃預變性5 min;95 ℃ 30 s,55 ℃ 45 s,72 ℃ 30 s,進行40個循環;72 ℃延伸5 min。DNA序列測定由TaKaRa公司完成。
2 結果與分析
2. 1 重組腺病毒載體的構建
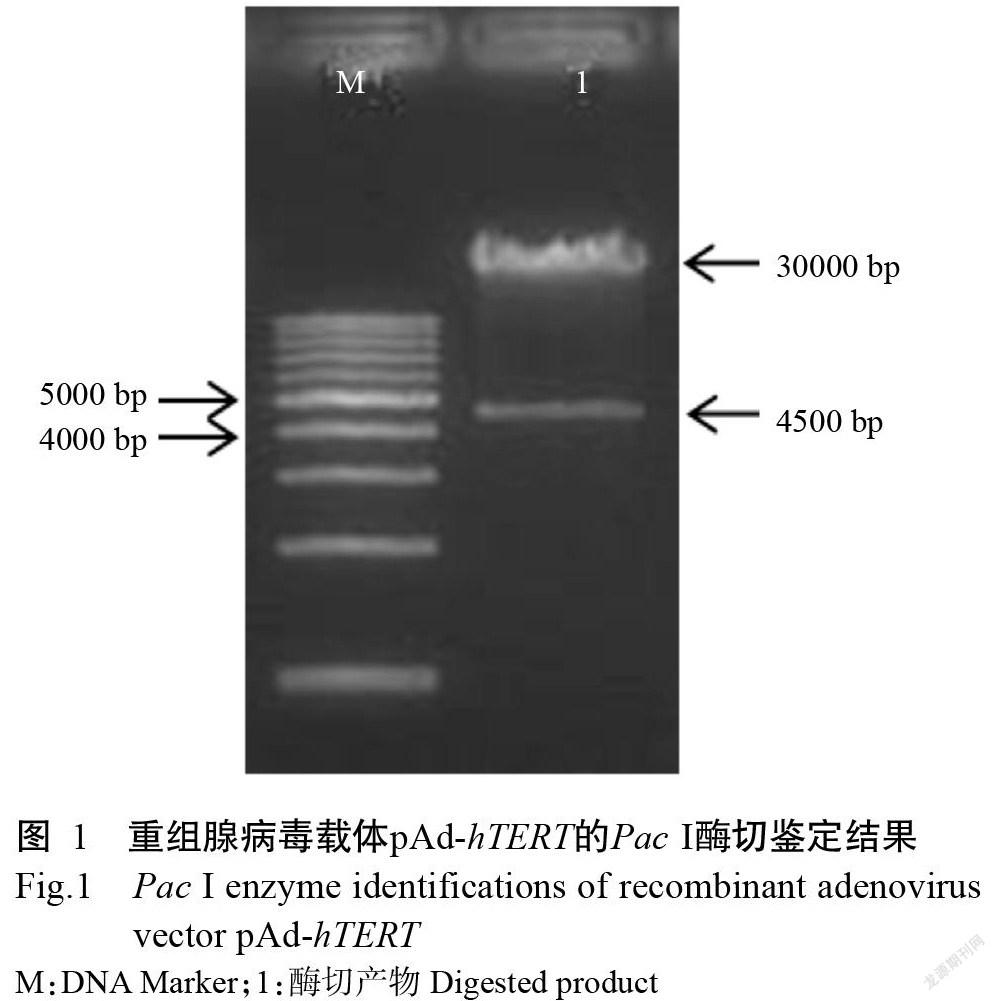
重組腺病毒載體pAd-hTERT經Pac I酶切后,瓊脂糖凝膠電泳檢測獲得2條大小分別為4500和30000 bp的目的片段(圖1),與預期結果一致,表明重組腺病毒載體pAd-hTERT構建成功。
2. 2 重組腺病毒包裝結果
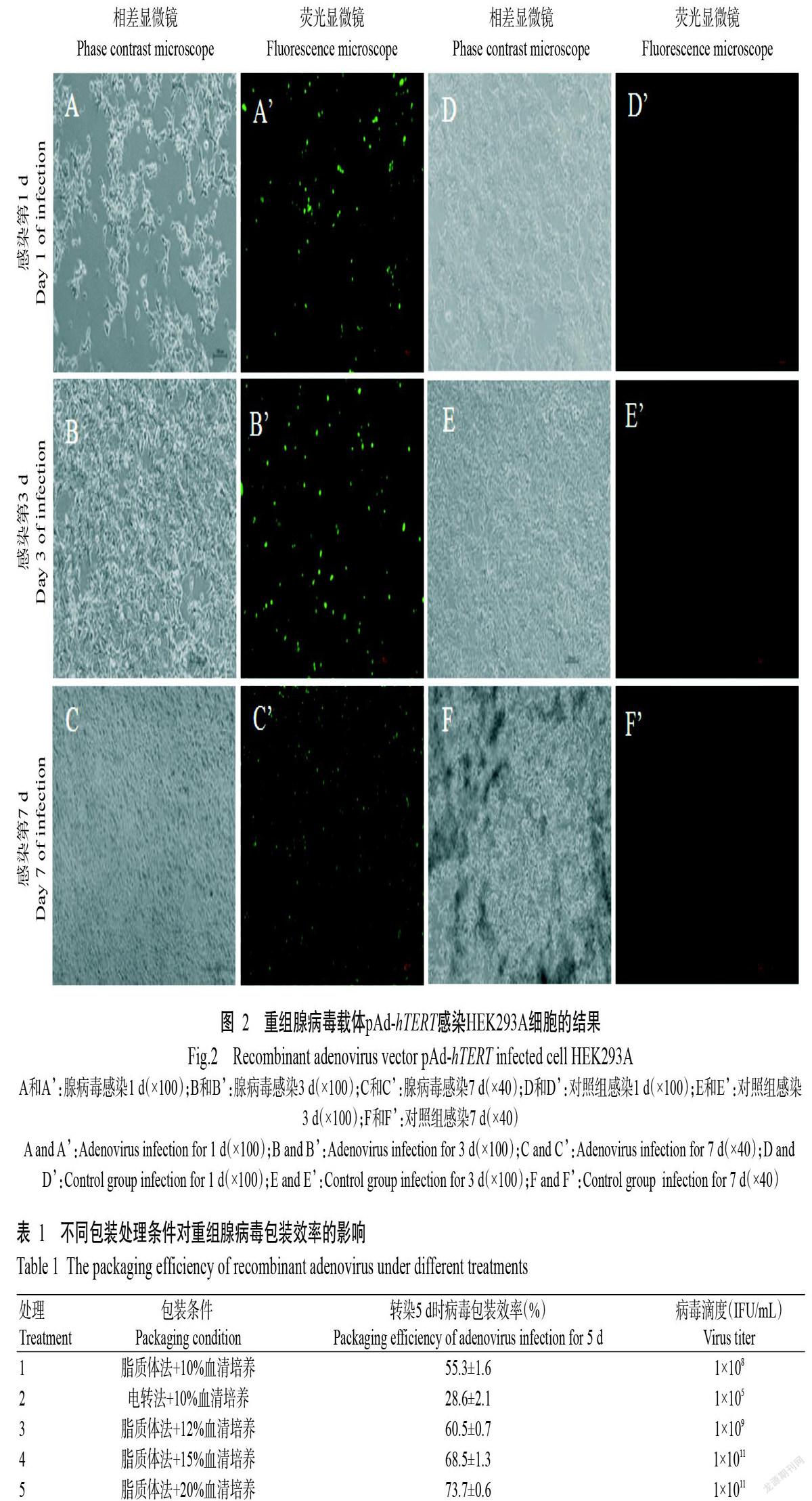
HKE293A細胞可為重組腺病毒載體pAd-hTERT提供所缺失的E1區,使其成為完整的腺病毒顆粒。重組腺病毒載體pAd-hTERT具有綠色熒光基因,在感染HKE293A細胞早期(第1 d和第3 d)觀察到的熒光表達量較低(圖2),說明此時病毒顆粒形成較少;至第7 d后可獲得大量懸浮細胞,熒光表達量較高,且出現明顯的CPE(圖2),故選擇此時收集重組腺病毒rAd-hTERT。
2. 3 重組腺病毒包裝條件的優化
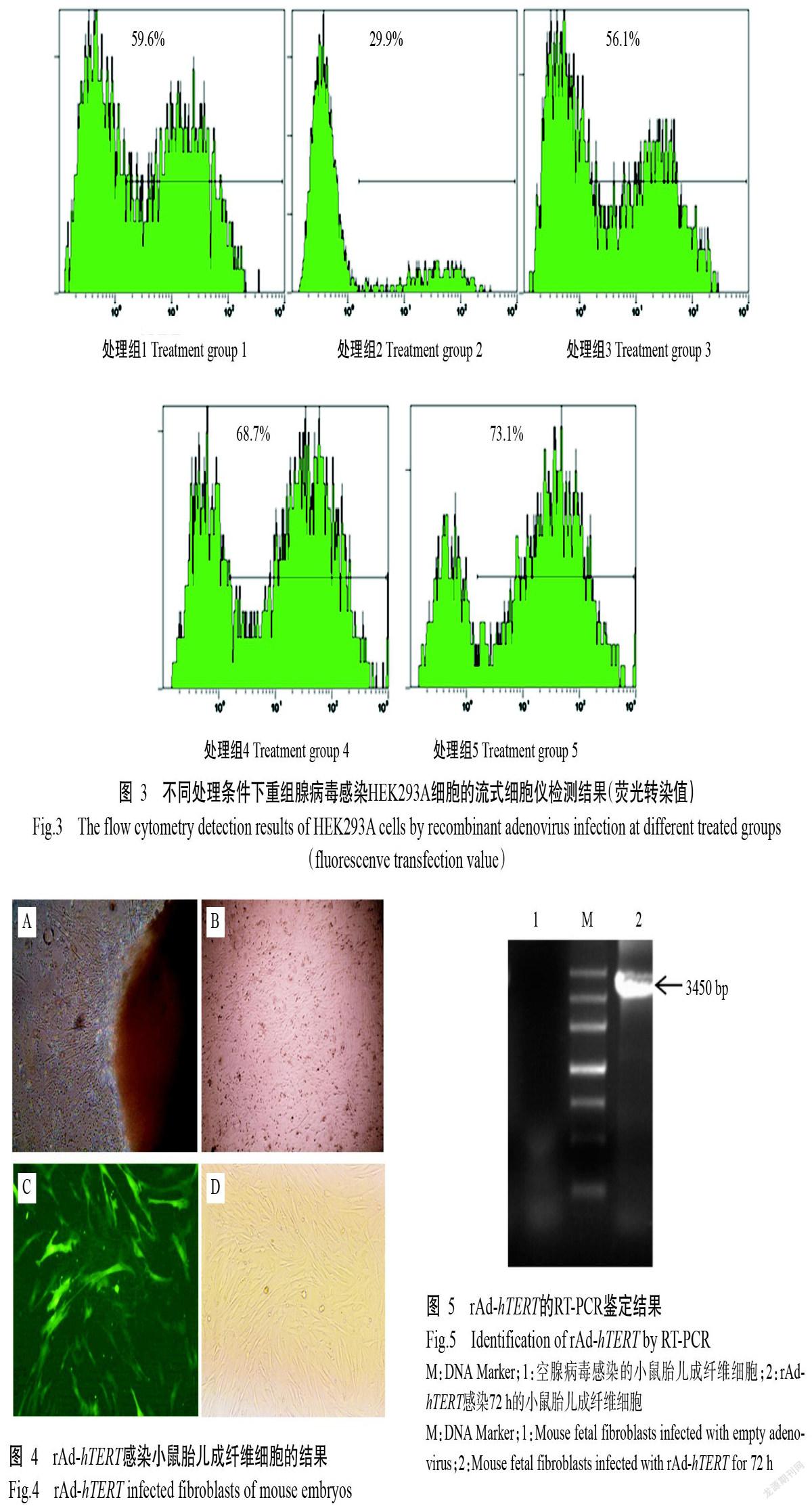
通過流式細胞儀檢測不同包裝處理條件下的病毒感染效率,并計算感染7~10 d后收集的病毒滴度,以此評價重組腺病毒包裝效率。結果表明,脂質體法優于電轉法,且胎牛血清對重組腺病毒的包裝效率有一定影響,隨胎牛血清濃度的增加,病毒包裝效率及病毒滴度均呈增長趨勢(表1和圖3)。處理4與處理5相比,盡管病毒包裝效率在高濃度胎牛血清中較高,但病毒滴度基本一致。綜合考慮試驗成本,因此確定處理4為最佳病毒包裝條件,即脂質體法轉染HEK293A細胞后采用15%胎牛血清進行病毒包裝,該條件下收集獲得的病毒滴度最高。
2. 4? rAd-hTERT感染小鼠胎兒成纖維細胞的特征
采用組織塊貼壁法獲取小鼠胎兒成纖維細胞,2 d后周邊遷出長梭狀細胞(圖4-A),繼續擴大培養至匯合度達90%以上(圖4-B)時即可進行后續的感染試驗。以攜帶hTERT基因的腺病毒(rAd-hTERT)感染小鼠胎兒成纖維細胞72 h后,發現其感染效率較高(圖4-C和圖4-D)。
2. 5 rAd-hTERT活性功能鑒定結果
采用RT-PCR鑒定hTERT基因在小鼠胎兒成纖維細胞中的表達情況,結果顯示,從rAd-hTERT感染72 h的小鼠胎兒成纖維細胞中可擴增出預期的目的基因條帶,片段大小約3450 bp(圖5);而以空腺病毒載體感染的小鼠胎兒成纖維細胞未擴增出任何條帶。
3 討論
以腺病毒作為載體工具有諸多優點,包括生物安全性高、宿主范圍較廣、可搭載大多數蛋白基因等,已被廣泛應用于基因功能研究及疾病模型構建等方面(劉玉玲和鐘柏茂,2018)。重組腺病毒載體包裝效率決定了目的基因表達的效果,而病毒包裝效率主要取決于包裝的方法及血清濃度、細胞狀態等因素。本研究結果表明,采用脂質體包裝腺病毒的效果明顯優于電轉法,雖然采用的電轉法是參照周磊等(2015)研究得出的最優條件(300 V,75 μs,3次),但無論是包裝熒光檢測效果還是病毒滴度均不理想,可能與HEK293A細胞性質有關,其貼壁率較低,電刺激易使細胞成簇漂起且出現較多死亡細胞,因此包裝不穩定。至今,有關腺病毒包裝過程中胎牛血清濃度影響的研究鮮見報道。本研究發現,胎牛血清濃度在重組腺病毒包裝過程中發揮較大作用,濃度越高其病毒包裝效率及獲得的病毒滴度也越高,可能與胎牛血清中含有的生長因子和活性蛋白有利于維持細胞體外活力有關,但胎牛血清的成本較高,因此最終確定重組腺病毒的最佳包裝條件為:以脂質體法轉染HEK293A細胞后采用15%胎牛血清進行病毒包裝,該條件下病毒收集獲得的滴度最高。
目前,有關端粒酶與細胞重編程互作方面的研究報道較少。Marion等(2009)研究認為只有供體細胞中具有端粒酶活性才能有效誘導產生細胞重編程;Huang等(2011)研究證實供體細胞缺乏端粒酶活性會引起DNA受損,進而阻礙細胞重編程。Pech等(2015)的研究結果也表明,端粒酶活性在胚胎發育和體細胞重編程過程中發揮著重要作用。本研究通過重組包裝獲得攜帶端粒酶基因的腺病毒(rAd-hTERT),并以其感染小鼠胎兒成纖維細胞,經RT-PCR鑒定證實,hTERT基因能在小鼠胎兒成纖維細胞中成功表達,且具有明顯的生物學活性功能,但后續研究需利用免疫印跡試驗及端粒酶活性檢測試劑盒進一步檢測驗證端粒酶活性表達情況,為探究端粒酶與細胞重編程互作機制提供基礎數據,進而有效提高細胞重編程效率,最終為哺乳動物體細胞核移植技術提供保障。
4 結論
采用脂質體法結合15%胎牛血清包裝獲得的攜帶hTERT基因重組腺病毒具有較高病毒滴度,感染小鼠胎兒成纖維細胞能成功表達hTERT基因,進一步證實端粒酶具有蛋白功能的生物學活性。
參考文獻:
賀小英,荊乾鴿,姜欣穎,吳憲,蘭宗寶,馬利兵. 2019. 端粒酶與體細胞重編程的最新研究進展[J]. 南方農業學報,50(5):1133-1140. [He X Y,Jing Q G,Jiang X Y,Wu X,Lan Z B,Ma L B. 2019. Research progress of telomerase and somatic cell reprogramming[J]. Journal of Southern Agriculture,50(5):1133-1140.]
劉玉玲,鐘柏茂. 2018. 腺病毒載體構建研究進展[J]. 國際兒科學雜志,(3):163-166. [Liu Y L,Zhong B M. 2018. Pro-gress on the construction of adenovirus vectors[J]. International Journal of Pediatrics,(3):163-166.]
鐘天映,陳媛媛,畢利軍. 2009. 端粒與端粒酶的研究——解讀2009年諾貝爾生理學或醫學獎[J]. 生物化學與生物物理進展,36(10):1233-1238. [Zhong T Y,Chen Y Y,Bi L J. 2009. Telomere and telomerase:To decode 2009 Nobel Prize in Physiology or Medicine[J]. Progress in Biochemistry and Biophysics,36(10):1233-1238.]
周磊,李強,李一星. 2015. 人胚腎細胞HEK293T電轉染的方法:CN104846016A[P]. 2015-08-19. [Zhong L,Li Q,Li Y X. 2015. Method for electrotransfection of human embryonic kidney cell HEK293T:CN104846016A[P]. 2015-08-19.]
Cheng D,Li Z,Liu Y,Gao Y,Wang H. 2012. Kinetic analysis of porcine fibroblast reprogramming toward pluripotency by defined factors[J]. Cellular Reprogrammining,14(4):312-323.
He X Y,Zheng Y M,Lan J,Wu Y H,Yan J,He X N,Zhang T,He Y L,Zheng Y L,Zhang Y. 2011. Recombinant adenovirus-mediated human telomerase reverse transcriptase gene can stimulate cell proliferation and maintain primitive characteristics in bovine mammary gland epithelial cells[J]. Development,Growth & Differentiation,53(3):312-322.
Hidema S,Fukuda T,Date S,Tokitake Y,Matsui Y,Sasaki H,Nishimori K. 2016. Transgenic expression of Telomerase reverse transcriptase(Tert) improves cell proliferation of primary cells and enhances reprogramming efficiency into the induced pluripotent stem cell[J]. Bioscience,Biotechnology,and Biochemistry,80(10):1925-1933.
Huang J,Wang F,Okuka M,Liu N,Ji G,Ye X,Zuo B,Li M,Liang P,Ge W W,Tsibris J C,Keefe D L,Liu L. 2011. Association of telomere length with authentic pluripotency of ES/iPS cells[J]. Cell Research,21(5):779-792.
Jeon H Y,Hyun S H,Lee G S,Kim H S,Kim S,Jeong Y W,Kang S K,Lee B C,Han J Y,Ahn C,Hwang W S. 2005. The analysis of telomere length and telomerase activity in cloned pigs and cows[J]. Molecular Reproduction and Development,71(3):315-320.
Kinoshita T,Nagamatsu G,Saito S,Takubo K,Horimoto K,Suda T. 2014. Telomerase reverse transcriptase has an extratelomeric function in somatic cell reprogramming[J]. The Journal of Biological Chemistry,289(22):15776-15787.
Kishigami S,Wakayama S,Hosoi Y,Iritani A,Wakayama T. 2008. Somatic cell nuclear transfer:Infinite reproduction of a unique diploid genome[J]. Experimental Cell Research,314(9):1945-1950.
Lanza R P,Cibelli J B,Blackwell C,Cristofalo V J,Francis M K,Baerlocher G M,Mak J,Schertzer M,Chavez E A,Sawyer N,Lansdorp P M,West M D. 2000. Extension of cell life-span and telomere length in animals cloned from senescent somatic cells[J]. Science,288(5466):665-669.
Le?o R,Apolónio J D,Lee D,Figueiredo A,Tabori U,Castelo-Branco P. 2018. Mechanisms of human telomerase reverse transcriptase (hTERT) regulation:Clinical impacts in cancer[J]. Journal of Biomedical Science,25(1):22. doi: 10.1186/s12929-018-0422-8.
Marion R M,Strati K,Li H,Tejera A,Schoeftner S,Ortega S,Serrano M,Blasco M A. 2009. Telomeres acquire embryonic stem cell characteristics in induced pluripotent stem cells[J]. Cell Stem Cell,4(2):141-154.
Niemann H,Tian X C,King W A,Lee R S. 2008. Epigenetic reprogramming in embryonic and foetal development upon somatic cell nuclear transfer cloning[J]. Reproduction,135(2):151-163.
Nishino K,Umezawa A. 2016. DNA methylation dynamics in human induced pluripotent stem cells[J]. Human Cell,29(3):97-100.
Pech M F,Garbuzov A,Hasegawa K,Sukhwani M,Zhang R J,Benayoun B A,Brockman S A,Lin S,Brunet A,Orwig K E,Artandi S E. 2015. High telomerase is a hallmark of undifferentiated spermatogonia and is required for maintenance of male germline stem cells[J]. Genes & Development,29(23):2420-2434.
Shin J,Kim J,Park H,Kim J. 2018. Investigating the role of Sirtuins in cell reprogramming[J]. BMB Reports,51(10):500-507.
Spiegl-Kreinecker S,L?tsch D,Neumayer K,Kastler L,Gojo J,Pirker C,Pichler J,Weis S,Kumar R,Webersinke G,Gruber A,Berger W. 2018. TERT promoter mutations are associated with poor prognosis and cell immortalization in meningioma[J]. Neuro-Oncology,20(12):1584-1593.
Takasawa K,Arai Y,Yamazaki-Inoue M,Toyoda M,Akutsu H,Umezawa A,Nishino K. 2018. DNA hypermethylation enhanced telomerase reverse transcriptase expression in human-induced pluripotent stem cells[J]. Human Cell,31(1):78-86.
Zvereva M I,Shcherbakova D M,Dontsova O A. 2010. Telomerase:Structure,functions,and activity regulation[J]. Biochemistry,75(13):1563-1583.
(責任編輯 蘭宗寶)

