分子蒸餾富集亞麻籽油中α-亞麻酸的研究
劉金菊 楊震發 白巧霞 楊順義



摘要:亞麻籽油經甲酯化后,采用分子蒸餾技術對其中α-亞麻酸進行分離純化,以α-亞麻酸質量分數和提取率作為衡量純化效果的指標。經單因素試驗確定蒸餾溫度、蒸餾壓力、進料速度、刮膜轉速的操作范圍,并利用響應曲面法Box-Behnken試驗設計,確定了亞麻籽油中α-亞麻酸分離純化的工藝條件,即蒸餾溫度90 ℃、蒸餾壓力0.8 Pa、進料速度0.87 mL/min、刮膜轉速287 r/min。在該工藝條件下,得到α-亞麻酸含量為81.15%,提取率為78.20%。
關鍵詞:亞麻籽油;α-亞麻酸;響應曲面法;分子蒸餾;富集
中圖分類號:TS222? ? ? 文獻標志碼:A? ? ? 文章編號:1001-1463(2019)05-0016-06
Abstract:After linseed oil was methylated, the α-linolenic acid was separated and purified by molecular distillation technology. The content of α-linolenic acid and extraction rate were used as indicators to measure the purification effect. The operating range of distillation temperature, distillation pressure, feed rate and scraping speed was determined by single factor experiment. The optimized process conditions for purification of α-linolenic acid were obtained by Box-Behnken experimental design of response surface method: distillation temperature was 90 ℃, the distillation pressure was 0.8 Pa, the feed rate was 0.87 mL/min, and the scraping speed was 287 r/min. Under this process condition, the content of α-linolenic acid was 81.15%, and the extraction rate was 78.20%.
Key words:Flaxseed oil;α-linolenic acid;Response surface methodology;Molecular distillation; Enrichment
α-亞麻酸(全順-9,12,15-十二碳三烯酸)屬ω-3系列不飽和脂肪酸,為人體必需脂肪酸[1 ],是人體轉化合成EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)的前體物質。EPA在體內通過酶促反應生成包括前列腺素在內的多種活性物質,DHA是構成神經、大腦、視網膜等組織膜磷脂的重要物 質[2 ]。EPA、DHA具有開發智力、保護視力、降血壓、降血脂[3 ],預防腫瘤[4 ]、乳腺癌[5 - 6 ]、動脈粥樣硬化[7 ]等作用。目前富集α-亞麻酸常見方法有尿素包合法[8 - 9 ]、銀離子絡合法[10 ]、低溫冷凍結晶法[11 ]、分子蒸餾法[12 ]等。尿素包合法主要利用脂肪酸的不飽和程度和碳鏈長度分子純化脂肪酸。由于α-亞麻酸為多不飽和脂肪酸,含3個不飽和雙鍵,碳鏈具有一定的空間構型,不易被尿素分子包合,尿素分子能夠與飽和脂肪酸、單不飽和脂肪酸形成較穩定的晶體包合物,在低溫條件下包合物結晶析出。該方法的缺點是提取純度不高、有機溶劑殘留、包合時間長等[13 ]。銀離子絡合法即根據脂肪酸雙鍵數目的不同而達到分離的效果。絡合作用的強弱與不飽和鍵的多少成正比,α-亞麻酸的3個雙鍵可與銀離子以配位共價鍵鍵合,形成穩定的親水絡合物,甲酯化法常作為銀離子絡合法的前處理法,其缺點是產品中有銀離子殘留,選擇性強,生產量小。冷凍結晶法即利用中短鏈脂肪酸較長鏈脂肪酸在同一溶劑中溶解度低,飽和脂肪酸較不飽和脂肪酸在同一溶劑中溶解度低的特性進行不飽和脂肪酸的富集,其缺點是產品中有溶劑殘留,需回收大量有機溶劑。分子蒸餾技術依據混合物組分中不同分子運動的平均自由程的差異來進行分離[14 ],廣泛應用于純化分離高熱敏性、高沸點、高粘度、低揮發度的物質[15 - 16 ],工序簡單,分離效率高;其缺點是生產成本較高。根據不同純化方法有缺點互補的原則,我們將甲酯化法與多級分子蒸餾相結合,α-亞麻酸甲酯化后,蒸餾溫度降低至90 ℃左右,能耗降低,也減少了α-亞麻酸的氧化分解。試驗過程不用溶劑做分離劑,無溶劑殘留,多級蒸餾提高α-亞麻酸的純度,研究確定掛模式分子蒸餾裝置提純α-亞麻酸的工藝條件,為高純度α-亞麻酸工業化生產提供依據。
1? ?材料與方法
1.1? ?供試材料與儀器
亞麻籽油[酸價0.89(KOH)/(mg/g),水分含量0.072%,α-亞麻酸含量57.11%],青海福來喜得生物科技股份有限公司α-亞麻酸工程研究中心提供。α-亞麻酸甲酯標準品(純度≥99%),中國食品藥品鑒定研究所提供。甲醇、氫氧化鉀、無水硫酸鈉均為分析純。正己烷為色譜純。GC7890B,安捷倫科技(中國)有限公司;FZL刮膜式分子蒸餾設備,天津君歌分子蒸餾設備有限公司。
1.2? ?試驗方法
1.2.1? ? 亞麻籽油甲酯化? ? 稱取50 g經檢驗合格的亞麻籽油置于250 mL容量瓶中,加入定量正己烷輕搖使其完全溶解后定容,加入0.5 mol/L的KOH-甲醇溶液作催化劑,常溫下反應30 min,靜置40 min,加入蒸餾水振搖、靜置分層,棄去下層液,沖洗至中性,再經無水硫酸鈉脫水處理,得α-亞麻酸甲酯粗產品。
1.2.2? ? 單因素試驗? ? 在冷凝循環水5 ℃,預熱溫度60 ℃,進料時間30 min的條件下,依次研究蒸餾壓力(蒸餾溫度85 ℃、刮膜轉速200 r/min、進料速度0.8 mL/min)、蒸餾溫度(蒸餾壓力0.8 Pa、刮膜轉速200 r/min、進料速度0.8 mL/min)、刮膜轉速(蒸餾溫度85 ℃、蒸餾壓力0.8 Pa、進料速度0.8 mL/min)、進料速度(蒸餾溫度85 ℃、蒸餾壓力0.8 Pa、刮膜轉速200 r/min)4個因素對α-亞麻酸富集效果的影響,以確定蒸餾工藝參數。
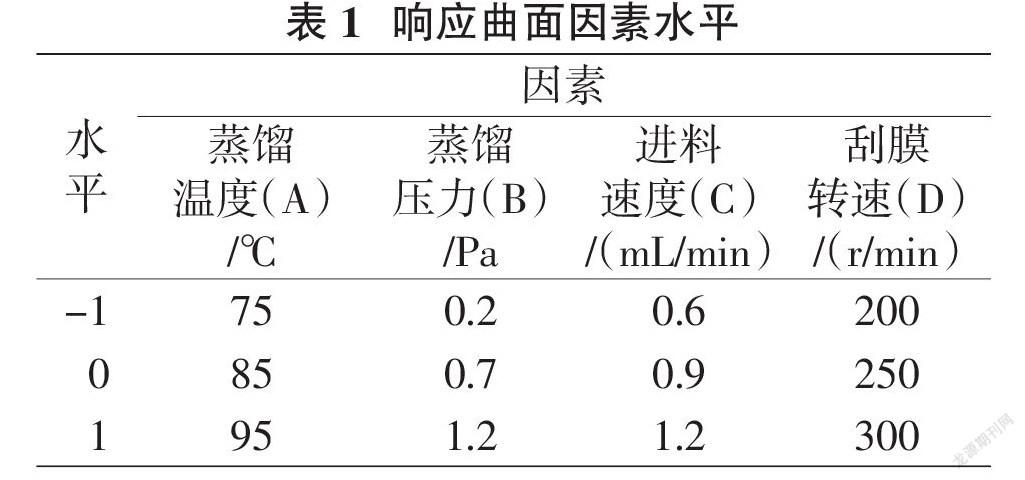
1.2.3? ? Box-Behnken設計優化試驗? ? 在單因素試驗的基礎上,選取蒸餾溫度、蒸餾壓力、進料速度、刮膜轉速4個因素,進行通用旋轉組合設計實驗。以α-亞麻酸含量為指標,利用Desigh Expert7.0軟件對數據進行處理分析,篩選出富集α-亞麻酸的分子蒸餾優化工藝條件,并進行驗證。因素水平設計見表1。
1.3? ?分析方法
1.3.1? ? 色譜條件? ? 色譜柱為DB-FFAP毛細管柱(30 m×0.25 mm×0.25 μm);進樣口溫度為250 ℃;柱溫的起始溫度180 ℃,10 ℃/ min升溫至220 ℃,再以8 ℃/min升溫至250 ℃,保持13 min;檢測器溫度270 ℃;進樣量1 μL,分流比20∶1;載氣為氮氣、氫氣。
1.3.2? ?α-亞麻酸甲酯的含量和提取率測定
將α-亞麻酸甲酯標準品與α-亞麻酸乙酯標準品分別配置成1 mg/mL的正己烷溶液,各取1 mL充分混合后取樣進行色譜分析。相對質量校正因子按下式得出[17 ]。
式中,f為相對質量矯正因子;As、Ar分別為內標物和對照品的峰面積;ms、mr分別為加入內標物和對照品的量。
將脂肪酸甲酯粗品和輕組分中樣品分別配制成2 mg/mL的正己烷溶液,各取1 mL上述溶液與1 mL的α-亞麻酸乙酯內標溶液(1 mg/mL)混合,取樣進氣相色譜分析。α-亞麻酸甲酯含量和提取率按下式計算。
式中,w為α-亞麻酸甲酯的含量(總),w(i)為α-亞麻酸甲酯的含量,Y為α-亞麻酸甲酯提取率,f為相對質量矯正因子,A(l)為粗品峰面積,A(i)為輕組分樣品面積,A(s)為內標物峰面積;m(l)為輕組分質量(g); m(h)為重組分質量(g)。
2? ?結果與分析
2.1? ?單因素試驗
2.2.1? ? 蒸餾溫度對α-亞麻酸甲酯富集效果的影響? ? 圖1表明,由于溫度逐漸升高,輕組分不斷溢出,α-亞麻酸甲酯在輕組分中的含量隨著溫度的升高呈先增大后減小的趨勢,99 ℃時達到最大值。但隨著蒸餾溫度繼續升高,重組分也會被帶出,從而使輕組分中α-亞麻酸甲酯的含量降低。α-亞麻酸甲酯的提取率隨著溫度升高一直呈現上升趨勢,溫度越高,提取率越來越高。試驗過程中發現,當蒸餾溫度高于90 ℃時,輕組分顏色變暗,且變暗程度與溫度成向關系。綜合分析,蒸餾溫度應該控制在90~95 ℃較為適宜。
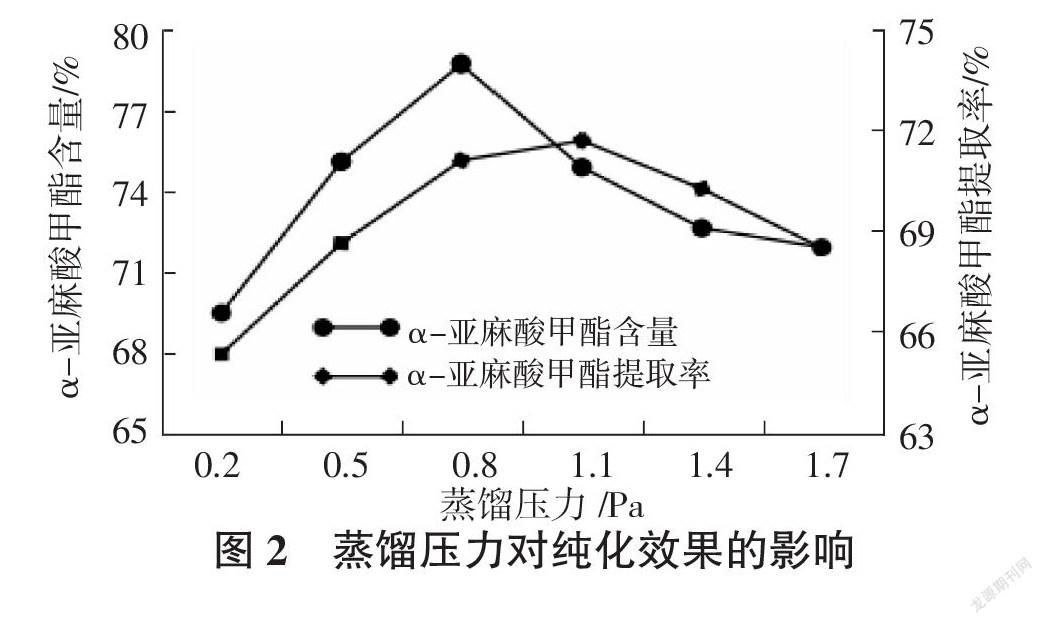
2.2.2? ? 蒸餾壓力對α-亞麻酸甲酯富集效果的影響? ? 如圖2所示,隨著壓力的增大,α-亞麻酸甲酯的含量迅速增大,后呈緩慢增長趨勢,在0.8 Pa時達到最大值。α-亞麻酸甲酯的提取率隨著壓力的增大持續增大。綜合分析,蒸餾壓力應該控制在0.8 Pa比較合適。
2.2.3? ? 進料速度對α-亞麻酸甲酯富集效果的影響? ? 圖3表明,輕組分中α-亞麻酸甲酯的含量和提取率隨著進料速度的增加先增大后減小,在1.1 mg/min時含量達到最大,提取率相應的最高。這是由加熱器傳熱量與α-亞麻酸甲酯汽化熱之間平衡所決定的,低流量時加熱器傳熱量大于α-亞麻酸甲酯汽化熱,多余熱量用于重組分蒸出。在進料速度為1.1 mL/min時兩者達到平衡,含量處于平衡狀態。隨著進料速度加大,加熱器已不能夠提供足夠的熱量供α-亞麻酸甲酯揮發,因此質量分數和提取率開始降低。綜合來看,1.1 mL/min為比較適宜的進料速度。
2.2.4? ? 刮膜轉速對α-亞麻酸甲酯富集效果的影響? ? 圖4表明,輕組分中α-亞麻酸甲酯的質量分數和提取率均隨著刮膜轉速的提高先增大后減小,在280 r/min時達到最大值。在低轉速時,轉速提高,引起液膜湍動加強,對流傳熱速度也隨之增大,傳熱的改善使得更多輕組分逸出。但隨著轉速進一步提高,熱量傳遞越多,重組分逸出也越多,加上料液被甩到冷凝管上幾率加大,導致質量分數和提取率下降。因此,刮膜轉速選擇280 r/min比較合適。
2.3? ?響應面試驗
2.3.1? ?響應面回歸模型的建立及顯著性檢驗
在單因素試驗的前提下,根據Box- Benhnken試驗設計方案進行試驗,結果見表2。
根據表2的數據,對自變量A、B、C、D進行回歸分析,由Design-Expert7.0擬合出二次多項式方程為:Y=79.59+4.44A+1.37B+1.43C+1.30D-0.95AB+0.30AC-0.17AD+0.10BC+0.15BD-0.30CD-5.98A2-2.89B2-3.88C2-2.10D2
由表3的方差分析結果看出,方程中的因素A、B、C、D、A2、B2、C2、D2對亞麻籽油中α-亞麻酸含量影響極顯著(P < 0.01);AC、AD、BC、BD、CD對α-亞麻酸含量影響不顯著;AB對α-亞麻酸含量影響顯著。根據二次多項式回歸方程的一次項系數大小,可以判斷出對提取亞麻籽油α-亞麻酸影響最大的因素是蒸餾溫度。復相關系數R2=0.988 3,說明響應值的變化有98.83%來源于所選變量,且模型P值遠小于0.01,表示模型方程極顯著,失擬性在0.05水平上不顯著(P = 0.1381 > 0.05),故模型的選取是適合的。RAdj2為0.976 7,說明建立模型能夠解決97.67%的響應值變化,能較好的描述分子蒸餾提取α-亞麻酸工藝條件的變化規律。
2.3.2? ? 模型的驗證性? ?利用Design-Expert7.0軟件對模型進行最優化預測,得到最優化工藝組合A為90.98 ℃、B為0.79 Pa、C為0.87 mL/min、D為287.13 r/min,此時可得到最大響應值為81.00%。為了檢驗此方法的可靠性,同時考慮操作的便利性,將α-亞麻酸提取最佳條件修正為蒸餾溫度A為90 ℃、蒸餾壓力B為0.8 Pa、進料速度C為0.87 mL/min、刮膜轉速D為287 r/min。按修正后的條件進行3次平行實驗,得到α-亞麻酸的含量為81.15%,與理論值相差0.15%;提取率3次平行試驗平均值為78.2%。此結果與模型的預測值相近,說明建立的模型能較好地反映實際的純化過程。雖然優化后的工藝明顯提高α-亞麻酸的純度,但要工業化生產還需做大量中試試驗,同時也需要改進。
3? ?結論與討論
將α-亞麻酸甲酯化后從甘油三酯中解離出來,然后采用分子蒸餾技術進一步純化,通過Box-Benhnken試驗設計篩選出分子蒸餾純化α-亞麻酸的最佳工藝條件為蒸餾溫度90 ℃、蒸餾壓力0.8 Pa、進料速度0.87 mL/min、刮膜轉速287 r/min。在此工藝條件下,得到α-亞麻酸質量分數為81.15%,提取率為78.20%。
陳樂清等[12 ]利用分子蒸餾技術純化亞麻籽α-亞麻酸,分析了蒸餾溫度、刮膜轉速、預熱溫度、進料速度4個因素對純化結果的影響,并利用響應曲面法的Box- Behnken實驗設計,得到提純α-亞麻酸的優化工藝條件,在該工藝條件下,α-亞麻酸質量分數從53.36%提高至80.27%,提取率為76.20%。張運暉[18 ]采用四級分子蒸餾技術,將原料中的α-亞麻酸由原來的67.5%提純至82.3%。本試驗首次將蒸餾壓力作為考察因素進行試驗,所得最佳工藝條件均為考慮接近工業化生產的基礎上得到,對工業生產具有一定的指導價值。
參考文獻:
[1] 吳素萍.? 亞麻籽中α-亞麻酸的健功能及提取技[J].? 中國釀造,2010(2):7-11.
[2] LUCAS,JAMES M. Response surface methodology:process and product optimization using designed experiments,3rd edition[J].? Journal of Quality Technology,2010,42(2):166-172.[3]K. VIJAIMOHAN,MALLIKA JAINU,K E? SABITHA,et al. Beneficial effects of alpha linolenic acid rich flaxseed oil on growth performance and hepatic cholesterol metabolism in high fat diet fed rats[J].? Life Sciences,2006,79(5):448-454.
[4] CHANDRADHAR DWIVEDI,KARTHIKA NATARAJAN,DUANE P. Matthees. Chemopreventive effects of dietary flaxseed pil on colon tumor development[J].? Nutrition and Cancer,2005,51(1):52-58.
[5] WANG LINDA,CHEN JIANMIN,THOMPSON LILIAN U.? The inhibitory effect of flaxseed on the growth and metastasis of estrogen receptor negative human breast cancer xenograftsis attributed to both its lignan and oil components[J].? International Journal of Cancer,2005,116(5):168-175.
[6] JIANMIN CHEN,LINDA WANG,LILIAN U THOMPSON. Flaxseed and its components reduce metastasis after surgical excision of solid human breast tumor in nude mice[J].? Cancer Letters,2005,234(2):168-175.
[7] 韓? ?浩.? α-亞麻酸植物甾醇酯對動脈粥樣硬化的保護作用及其機制研究[D].? 武漢:華中科技大學,2015.
[8] 陳? ?潔.? 油脂化學[M].? 北京:化學工業出版社,2004:190-196.
[9] 宮宇嘉,王? ?鑫,徐麗萍.? 尿素包合法純化α-亞麻酸方法的研究[J].? 哈爾濱商業大學學報(自然科學版),2014,30(4):500-505.
[10] 靳? ?革,孫? ?凱,崔新宇,等.? 銀離子絡合法提取核桃油中不飽和脂肪酸[J].? 光譜實驗室,2012,29(4):2286-2290.
[11] 王曉玲,楊? ?青,劉高強,等.? 低溫結晶法富集馬尾松毛蟲幼蟲中的多不飽和脂肪酸[J].? 食品與發酵工業,2010,36(9):70-74.
[12] 陳樂清,林? ?文,丁朝中,等.? 分子蒸餾純化亞麻籽油中α-亞麻酸的研究[J].? 食品工業科技,2013,34(4):216-219.
[13] 景戰軍.? 紫蘇籽α-亞麻酸提取技術[J].? 甘肅農業科技,2011(3):51-52.
[14] WEILIANG WU,CHAO WANG,JIANXIAN ZHENG. Optimization of deacidification of low-calorie cocoa butter by molecular distillation[J].? LWT-Food Science and Technology,2012,46(2):12-17.
[15] YANG LI,SONG-LIN XU.? DSMC simulation of vapor flow in molecular distillation[J].? Vacuum,2014,110:40-46.
[16] 張運暉,趙? ?瑛,羅俊杰.? 超臨界CO2萃取與分子蒸餾技術的研究綜述[J].? 甘肅農業科技,2013(5):44-46.
[17] SHANTHA N C,NAPOLITANO G E. Review:Gas chromatography of fatty acids[J].? Journal of Chromatography. 1992. 624:37-51.
[18] 張運暉.? SFE-CO2與分子蒸餾技術分離純化亞麻籽油中的α-亞麻酸[D].? 蘭州:蘭州大學,2013.
(本文責編:陳? ? 偉)
收稿日期:2018 - 09 - 17;修訂日期:2019 - 04 - 10
基金項目:甘肅省高等學校科研項目自籌經費項目(2016B188)。
作者簡介:劉金菊(1988 — ),女,四川南部人,講師,碩士,研究方向為化學工程與工藝。Email:839584172@qq.com。

