例說培養學生新情境下氧化還原反應方程式的書寫思路
熊心強
(成都高新三岔中學,四川 成都 641418)
化學是一門以化學方程式為載體的自然學科,通過學習化學方程式來掌握物質的結構及其性質,反過來知道物質的結構和性質以及物質間反應的現象,我們可以推斷出物質之間反應的化學方程式。要學會新情境下氧化還原反應方程式的書寫思路,我們可以先依次學會化學方程式的配平、氧化還原反應方程式的配平、缺項氧化還原反應方程式的配平,在學會在特定化學環境下判斷出反應物和生成物、寫出部分反應物和部分生成物、利用物質的性質現象判斷出其余的反應物和生成物、利用氧化還原反應方程式的特征將其配平。
一、化學方程式的配平
(一)利用原子守恒配平
【典例分析】 配平下列化學方程式
【針對練習1】配平下列化學方程式
(二)利用化合價升降相等和原子守恒相結合給氧化還原反應方程式配平
【典例分析】配平下列化學方程式
【針對練習2】配平下列化學方程式
(三)利用化合價升降相等和原子守恒以及電荷守恒相結合給氧化還原反應缺項離子方程式配平
配平步驟
【典例分析】配平下列化學方程式
【針對練習3】
二、新情境下方程式的書寫
常見氧化劑、還原劑在各自條件下分別對應的還原產物和氧化產物
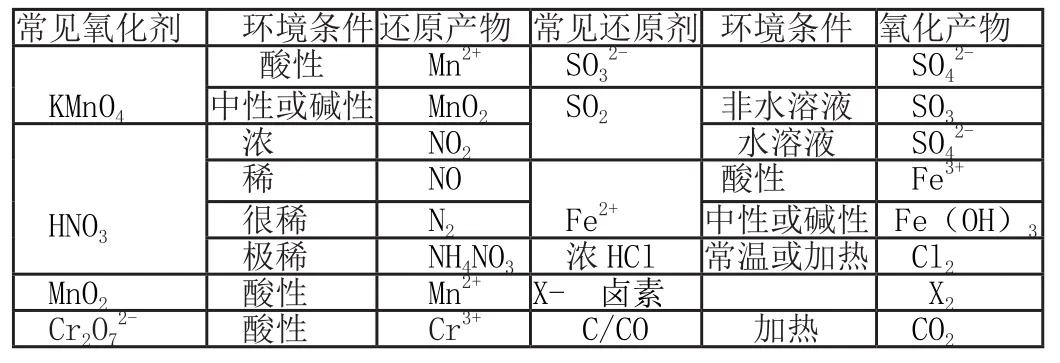
常見氧化劑 環境條件還原產物 常見還原劑 環境條件 氧化產物KMnO4酸性 Mn2+ SO32- SO42-中性或堿性 MnO2 SO2 非水溶液 SO3 HNO3濃 NO2 水溶液 SO42-稀 NO Fe2+酸性 Fe3+很稀 N2 中性或堿性 Fe(OH)3極稀 NH4NO3 濃HCl 常溫或加熱 Cl2 MnO2 酸性 Mn2+ X- 鹵素 X2 Cr2O7 2- 酸性 Cr3+ C/CO 加熱 CO2
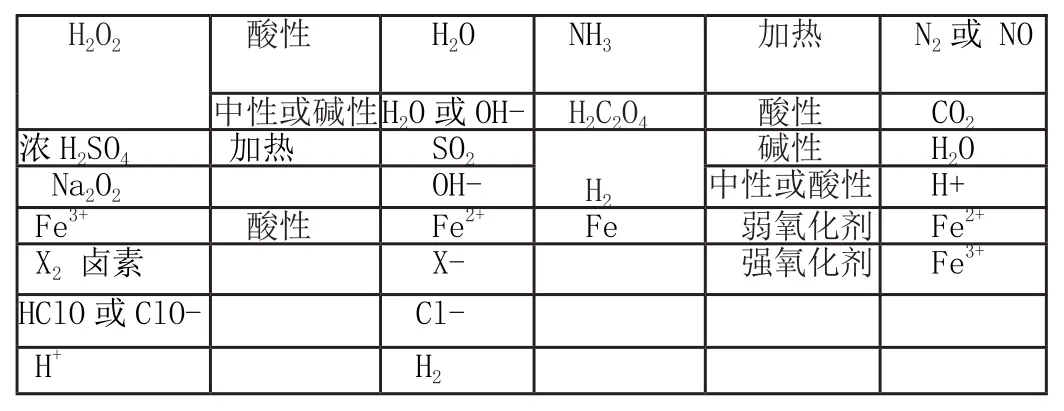
堿性 H2O Na2O2 OH- 中性或酸性 H+Fe3+ 酸性 Fe2+ Fe 弱氧化劑 Fe2+X2 鹵素 X- 強氧化劑 Fe3+HClO或ClO- Cl-H+ H2 H2O2 酸性 H2O NH3 加熱 N2或 NO中性或堿性H2O或OH- H2C2O4 酸性 CO2濃H2SO4 加熱 SO2 H2
【典例分析】
(1) 向FeSO4和硫酸混合溶液中加入NaClO溶液,反應的離子方程式為:
(2) 向FeSO4溶液中加入NaClO溶液,反應的離子方程式為:
(3) 向NaClO和NaOH溶液中滴入FeSO4溶液,反應的離子方程式為:
【考點練習】
(2017年新課標1卷27).(4)+6價鉻的化合物毒性較大,常用NaHSO3將廢液中的Cr2O72-還原成Cr3+,反應的離子方程式為。
三、結束語
新情境下氧化還原反應方程式的書寫是考查學生的化學綜合能力,要提升學生的這種綜合的能力,必須抓好氧化還原反應方程式配平和缺項氧化還原反應方程式配平的基礎,學生還應對常見物質結構及其性質的掌握要牢固。

