小白菊內酯對胰腺癌細胞SW1990增殖、侵襲和遷移的影響
劉雋東 遲南南 徐建博 張天英 楊 義 汪鳳山
(佳木斯大學附屬第一醫院1 藥劑科,2 消化二科,3 重癥醫學科,黑龍江省佳木斯市 154002,電子郵箱:liujundong19831@163.com)
胰腺癌是一種較難治愈的惡性腫瘤,近年來其患病率逐年升高[1]。由于胰腺癌臨床癥狀不明顯,起病隱匿,疾病早期無明顯體征,因此,多數患者確診時疾病已發展至中晚期,手術切除率較低,導致預后較差,5年生存率極低[2]。另外,術后腫瘤的轉移和局部復發也是胰腺癌治療失敗或導致死亡的原因之一[3]。尋找胰腺癌新型綜合治療手段,改善患者預后,成為目前研究的熱點。小白菊內酯(parthenolide,PTL)是提取自菊科植物小白菊的一種倍半萜內酯類物質,具有減輕頭痛、緩解炎癥等功效,臨床上多用于治療風濕、偏頭痛等疾病[4]。近年研究表明,PTL與伏立諾他聯用可顯著抑制乳腺癌MDA-MB231細胞的增殖,并誘導其凋亡和自噬[5]。Yu等[6]發現,經PTL作用后,人口腔鱗癌細胞中含半胱氨酸天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)-3等凋亡相關蛋白表達上調,從而抑制口腔鱗癌細胞的增殖,誘導細胞凋亡。但PTL對胰腺癌細胞的影響尚不清楚。本研究采用不同濃度的PTL作用于人胰腺癌細胞系SW1990細胞,觀察PTL對SW1990細胞增殖、遷移和侵襲的影響,并初步探討其機制,旨在探討PTL應用于胰腺癌治療的可能。
1 材料與方法
1.1 細胞來源及主要試劑與儀器 人胰腺癌細胞系SW1990細胞(批號:TCHu201)購自中國科學院上海細胞庫。PTL(純度≥98%,批號:P0667-25MG)、反轉錄試劑盒(批號:HSRT100)、TRIzol試劑(批號:T9424)均購自美國Sigma公司;L-15培養基(批號:41300039)購自美國Thermo公司;二喹啉甲酸(bicinchoninic acid,BCA)試劑盒(批號:P0011)、蛋白提取試劑盒(批號:P0025)、細胞計數檢測(cell counting kit-8,CCK-8)試劑盒(批號:C0037)、Transwell小室均購自上海碧云天公司;AceQ qPCR SYBR? Green Master Mix(批號:R123-01)、胰蛋白酶(批號:25300054)均購自南京諾唯贊生物科技有限公司;羊抗兔IgG二抗以及兔源一抗周期蛋白依賴性激酶4(cyclin-dependent kinase 4,CDK4)抗體、E-鈣黏素抗體、基質金屬蛋白酶(matrix metalloproteinase,MMP)-2抗體、MMP-9抗體、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體(批號:ab199728、ab76055、ab92536、ab73734、ab8245)均購自美國Abcam公司;酶標儀(型號:ELx800TM)、熒光定量PCR儀(型號:IQ5)、流式細胞儀(型號:CytoFLEX)均購自美國Bio-Rad公司;CO2細胞培養箱購自日本SANYO公司。
1.2 細胞培養及PTL干預濃度的篩選 復蘇SW1990細胞,用含10%胎牛血清的L-15培養基培養,置于37℃、5% CO2細胞培養箱中傳代培養。取對數生長期的細胞,將SW1990細胞以5 000個/孔接種至96孔板。培養24 h后分別加入不同濃度的PTL(5、10、20、40、80 μmol/L)20 μL處理SW1990細胞,對照組加入等體積0.9% NaCl溶液。分別于干預12 h、24 h、36 h、48 h、60 h、72 h后,向各組細胞加入CCK-8溶液,繼續培養2 h,離心收集SW1990細胞,采用酶標儀檢測細胞在450 nm波長下的吸光度(A)值。計算不同濃度PTL對SW1990細胞的生長抑制率。細胞生長抑制率(%)=(1-APTL處理組/A對照組)×100%。每個濃度設置3復孔,實驗重復3次。根據實驗結果選取PTL干預細胞的適宜濃度。
1.3 細胞分組及干預 取對數生長期的細胞,采用0.25%胰蛋白酶消化后,以1×106個/孔接種至6孔板,培養至細胞融合度約80%時,根據1.2的實驗結果將細胞分為對照組、10 μmol/L PTL組、20 μmol/L PTL組、40 μmol/L PTL組。對照組加入20 μL的0.9% NaCl溶液,其余各組加入相應濃度的PTL。每組設置6個復孔。
1.4 平板細胞克隆形成實驗檢測SW1990細胞增殖情況 干預48 h后,收集各組SW1990細胞,制備單細胞懸液,計數后接種至含有6 mL的L-15培養基的培養皿(每個培養皿含1 000個細胞)中,于37℃、5% CO2、90%相對濕度的培養箱中倒置培養。待長出肉眼可見的細胞克隆時(2~4 d),取出并計數每個培養皿中細胞克隆數目,計算SW1990細胞克隆形成率。克隆形成率=(細胞克隆數目/1 000)×100%。每組實驗重復6次。
1.5 劃痕實驗檢測SW1990細胞遷移能力 干預48 h后,收集各組SW1990細胞,以1×106個/孔接種至6孔板,待細胞長滿后,采用200 mL槍頭于6孔板內側垂直劃痕,輕輕吸盡舊培養基,以磷酸緩沖液洗去劃落的細胞,加入無血清L-15培養基,置于37℃、5% CO2、90%相對濕度的培養箱中常規培養。48 h后置于倒置顯微鏡下拍照,并比較0 h、48 h時,SW1990細胞劃痕兩側的間距,依此評價SW1990細胞遷移能力,劃痕間距=0 h劃痕兩側的間距-48 h時劃痕兩側的間距。每組實驗重復6次。
1.6 Transwell實驗檢測SW1990細胞侵襲能力 PTL干預48 h后,收集各組SW1990細胞,加入無血清L-15培養基制作細胞懸液,接種于加有50 μL基質膠(2.0 mg/mL)的Transwell小室上層(3 000個細胞/孔),按照文獻[7]中的方法進行操作。小室風干后,置于500 μL的 0.1%結晶紫溶液中染色,于顯微鏡下拍照,統計遷移至Transwell下室的SW1990細胞數量。每組實驗重復6次。
1.7 實時熒光定量PCR檢測CDK4、E-鈣黏素、MMP-2、MMP-9 mRNA表達 按1.3方法處理細胞48 h后,采用TRIzol法提取各組SW1990細胞總RNA,檢測其濃度和質量,按照試劑盒說明書操作反轉錄合成cDNA。以GAPDH為內參基因,采用AceQ qPCR SYBR? Green Master Mix試劑盒進行實時熒光定量PCR,反應體系:10 μmol/L上下游引物0.5 μL,SYBR? Green Master Mix 5 μL,50 ng/μL cDNA 1 μL,無菌ddH2O 3.0 μL,總計10 μL。反應條件:95℃ 90 s;95℃ 30 s;62℃ 30 s;72℃ 20 s;40個循環。采用2-△△CT法計算CDK4、E-鈣黏素、MMP-2、MMP-9 mRNA相對表達量。引物均由上海生工生物公司合成,序列見表1。

表1 CDK4、E-鈣黏素、MMP-2、MMP-9及GAPDH引物序列
1.8 蛋白免疫印跡法檢測CDK4、E-鈣黏素、MMP-2、MMP-9蛋白表達水平 按1.3方法處理細胞48 h后,采用蛋白裂解液裂解SW1990細胞,提取細胞總蛋白并測定蛋白總質量。采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離蛋白后進行轉膜;5%脫脂奶粉室溫封閉1 h;分別加入兔源一抗CDK4抗體、E-鈣黏素抗體、MMP-2抗體、MMP-9抗體、GAPDH抗體(1 ∶500),4℃孵育作用過夜;加入二抗羊抗兔IgG(1 ∶4 000),室溫孵育1 h。采用化學發光試劑處理后,經Tanon軟件拍攝圖像并進行半定量分析。
1.9 統計學分析 采用SPSS 24.0軟件進行統計學分析。計量資料以(x±s)表示,多組樣本間均數比較采用單因素方差分析,兩兩比較采用行LSD-t檢驗。以P<0.05為差異具有統計學意義。
2 結 果
2.1 PTL對SW1990細胞增殖的影響 PTL干預細胞36 h后,與對照組相比,各干預時間點,10、20、40 μmol/L PTL均能抑制細胞增殖,見圖1。干預48 h后,PTL對SW1990細胞的半數抑制濃度為(37.15±2.34)μmol/L。
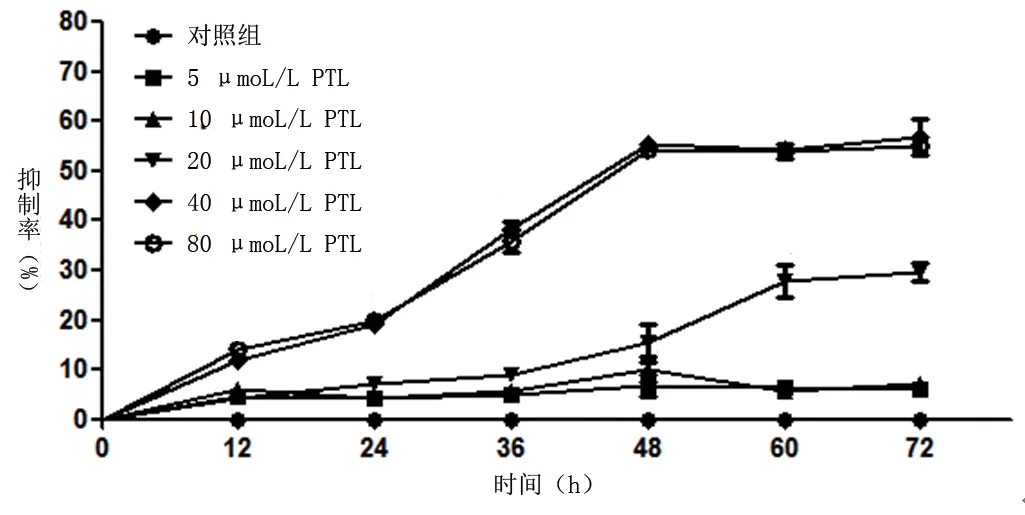
圖1 不同時間點不同濃度PTL干預下SW1990細胞增殖抑制率
2.2 PTL對SW1990細胞平板克隆形成、遷移能力、侵襲能力的影響 對照組、10 μmol/L PTL組、20 μmol/L PTL組、40 μmol/L PTL組SW1990細胞克隆形成率及侵襲能力依次降低,劃痕間距依次增大(均P<0.05),見表2及圖2~3。
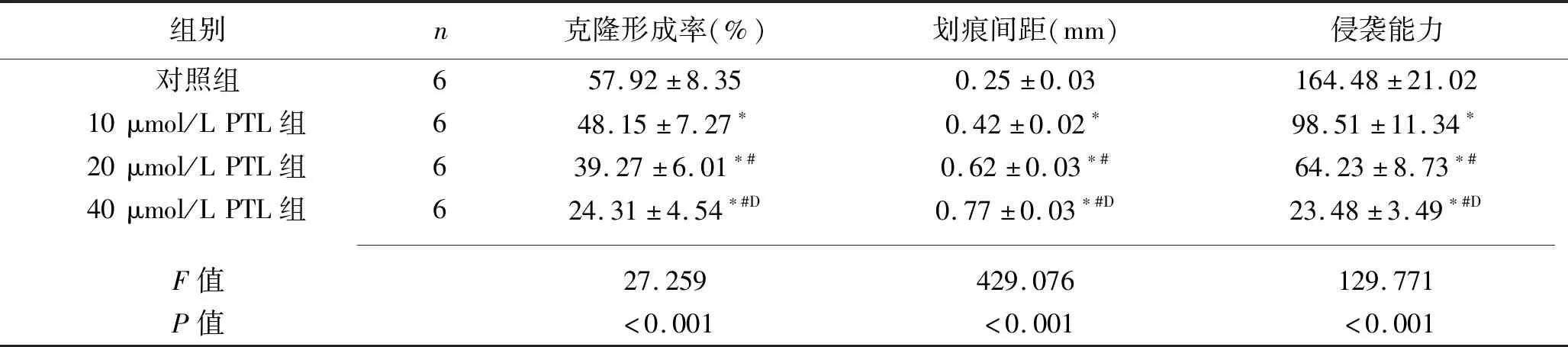
表2 PTL對SW1990細胞平板克隆形成、遷移能力、侵襲能力的影響(x±s)
注:與對照組比較,*P<0.05;與10 μmol/L PTL組比較,#P<0.05;與20 μmol/L PTL組比較,DP<0.05。

圖2 各組SW1990細胞的遷移能力
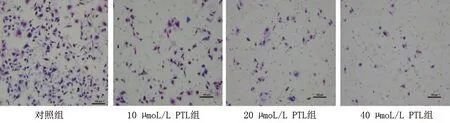
圖3 各組SW1990細胞的侵襲能力
2.3 PTL對SW1990細胞CDK4、E-鈣黏素、MMP-2、MMP-9 mRNA及蛋白表達的影響 PTL作用48 h后,對照組、10 μmol/L、20 μmol/L、40 μmol/L PTL組SW1990細胞CDK4、E-鈣黏素、MMP-2、MMP-9 mRNA及蛋白相對表達水平均依次降低(均P<0.05),見表3~4及圖4。
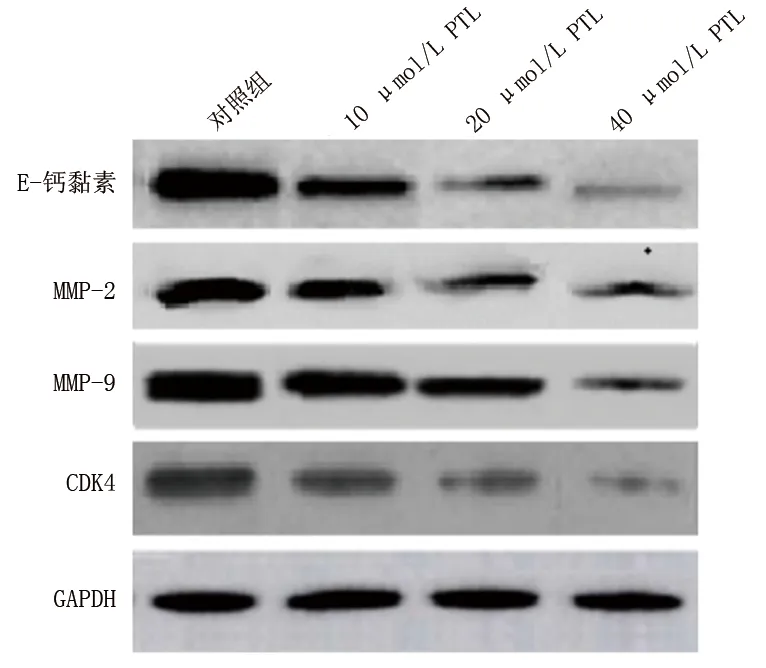
圖4 SW1990細胞CDK4、E-鈣黏素、MMP-2、MMP-9蛋白表達情況
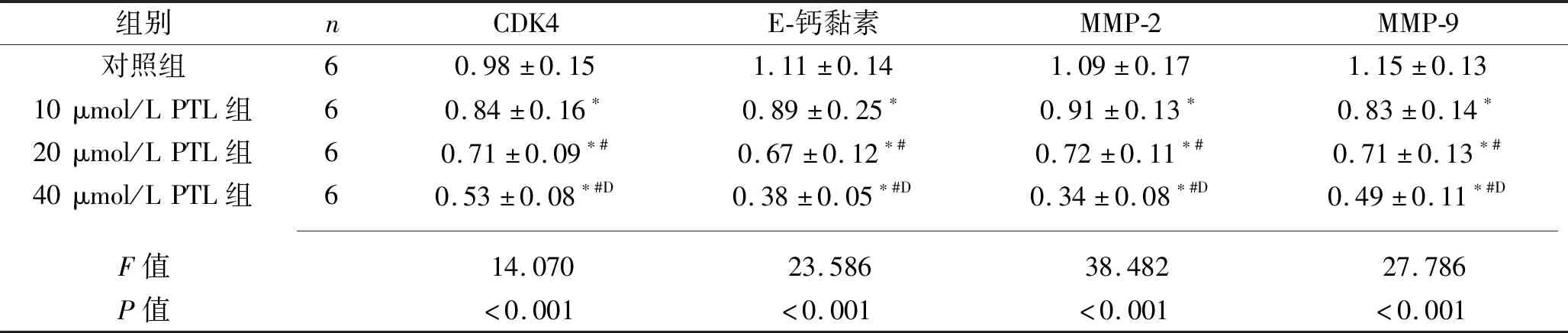
表3 各組SW1990細胞CDK4、E-鈣黏素、MMP-2、MMP-9 mRNA相對表達水平比較(x±s)
注:與對照組比較,*P<0.05;與10 μmol/L PTL組比較,#P<0.05;與20 μmol/L PTL組比較,DP<0.05。
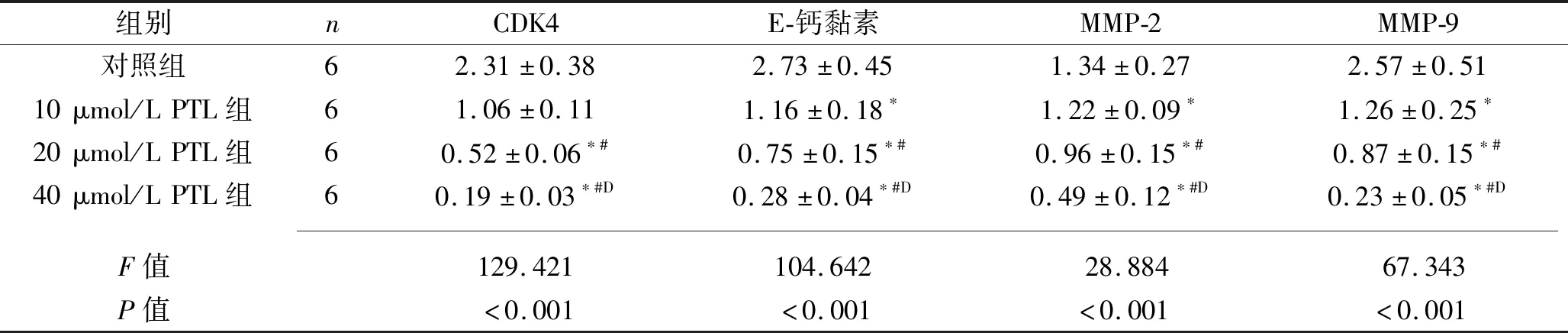
表4 各組SW1990細胞CDK4、E-鈣黏素、MMP-2、MMP-9蛋白相對表達水平比較(x±s)
注:與對照組比較,*P<0.05;與10 μmol/L PTL組比較,#P<0.05;與20 μmol/L PTL組比較,DP<0.05。
3 討 論
胰腺癌是惡性程度較高的惡性腫瘤,其發生與高脂飲食、遺傳及環境因素有關,但具體發病機制尚不明確。目前外科手術是根治胰腺癌的唯一方法,然而由于胰腺癌的早期診斷困難,確診時患者病情已發展至中晚期,錯過手術機會,此時化療是主要的治療方式[8]。目前臨床采用吉西他濱作為胰腺癌化療的一線藥物,但其毒副作用大且治療效果不佳[9]。因此,尋找有效、安全的胰腺癌治療藥物具有重要意義。胰腺癌SW1990細胞系源自一名Ⅱ期胰腺腺癌患者,已被廣泛應用于胰腺癌的研究[10]。本研究結果顯示,PTL干預SW1990細胞36 h后,各干預時間點,20 μmol/L、40 μmol/L、80 μmol/L PTL均能抑制胰腺癌細胞系SW1990細胞的增殖,而干預48 h后,PTL對SW1990細胞的半數抑制濃度為(37.15±2.34)μmol/L,故本研究選擇10、20、40 μmol/L PTL干預SW 1900細胞為48 h。
PTL是分離自菊科植物小白菊等的一種天然倍半萜內酯類物質,具有抑制炎癥、抗腫瘤等藥理活性[11]。Kim等[12]發現,PTL可通過上調結直腸癌細胞的促凋亡蛋白的表達,如p53細胞色素等,促進結直腸癌細胞的凋亡,發揮抗腫瘤作用。本研究結果顯示,對照組、10 μmol/L PTL組、20 μmol/L PTL組、40 μmol/L PTL組細胞的克隆形成率均依次降低(均P<0.05),提示PTL可抑制人胰腺癌細胞增殖能力,具有抗腫瘤作用,且呈一定的劑量依賴性。
細胞是人體的基本組成單元,細胞增殖是一個多基因協同調控的過程,哺乳動物的細胞生長周期分為G1、S、G2、M 4個時期,其中G0/G1期的正常啟動是細胞周期正常增殖的關鍵[13]。細胞接到信號后,在生長因子等的持續作用下,激活一系列信號通路,CDK4/6作用于受體結合域蛋白,使其磷酸化,進而作用于下游目標蛋白,促使細胞由G1期進入S期,開始染色體的復制,完成有絲分裂過程[14-15]。本研究中,各濃度PTL組SW1990細胞CDK4 mRNA和蛋白表達水平均低于對照組,且呈劑量依賴性(P<0.05),提示PTL對SW1990細胞增殖的抑制作用可能與抑制CDK4蛋白表達有關。
腫瘤的發生由多因素共同參與,疾病過程復雜,當機體受到致癌物刺激后,單一細胞基因表達失調,導致細胞增殖異常,侵襲能力增加,呈浸潤式生長,引起癌變[16]。本研究中,各濃度PTL組SW1990細胞劃痕的間距大于對照組、侵襲至Transwell下室的細胞數量少于對照組(均P<0.05),提示PTL可抑制人胰腺癌細胞的遷移和侵襲能力。上皮-間充質轉化(epithelial-mesenchymal transition,EMT)是腫瘤發生遠端轉移的病理狀態,主要表現為失去上皮細胞特性而具有肌成纖維細胞特性[17]。在細胞發生EMT過程中,上皮細胞標志物,如E-鈣黏素表達減少,間充質標志物,如α-平滑肌動蛋白表達增加,細胞間的黏附作用降低[18-19]。MMP-2和MMP-9屬于Ⅳ型膠原酶原,對細胞外基質的降解具有重要作用[20],與腫瘤細胞的侵襲轉移密切相關。本研究中,PTL各處理組SW1990細胞E-鈣黏素、MMP-2、MMP-9 mRNA及蛋白相對表達水平均低于對照組,且呈劑量依賴性(P<0.05)。提示PTL可能通過抑制SW1990細胞上皮細胞標志物E-鈣黏素蛋白及侵襲相關蛋白MMP-2、MMP-9的表達,從而抑制人胰腺癌細胞遷移和侵襲。
綜上所述,PTL可能通過調控CDK4、E-鈣黏素、MMP-2及MMP-9等蛋白的表達,從而抑制人胰腺癌細胞系SW1990細胞的增殖、遷移和侵襲,以發揮抗腫瘤的作用。

