異檸檬酸脫氫酶1對替莫唑胺干預下U87細胞細胞凋亡的影響*
王舉波, 權瑜, 呂健, 董丹鳳
(1.西安交通大學第二附屬醫院 神經外科, 陜西 西安 710004; 2.西安交通大學第一附屬醫院 腫瘤內科, 陜西 西安 710061)
腦膠質瘤是發病率最高、且最具危險性的顱內原發惡性腫瘤,盡管近年來外科技術及各種綜合治療方法不斷更新,但仍然難以改變其高居不下的致死率及致殘率[1-4]。腫瘤細胞增殖同時存在細胞死亡[5],主要包括壞死與凋亡,后者是細胞自身增殖調控的重要方式,是由幾條經典凋亡通路控制的程序性死亡[6],與腫瘤的進展關系密切[7-8],研究膠質瘤細胞的凋亡與增殖特性具有重要的臨床價值[9]。檸檬酸脫氫酶1(isocitrate dehydrogenase1,IDH1)在膠質瘤中有著廣泛的突變率,且突變型患者具有相對較好的預后[10-11],但目前國內外對突變型膠質瘤患者良好預后的機制鮮有報道,本研通過研究異檸檬酸脫氫酶1(mutant isocitrate dehydrogenase1,mIDH1)基因過表達對替莫唑胺(temozolomide,TMZ)干預下人腦惡性膠質瘤細胞系U87凋亡的影響,探討mIDH1影響膠質瘤患者預后的原因,為臨床治療提供參考。
1 材料與方法
1.1 材料與試劑
U87人腦惡性膠質瘤細胞系由西安交通大學醫學院中心實驗室提供,Caspase-3及Caspase-9兔抗人單克隆抗體購買于Santa Cruze公司,胎牛血清購自四季青公司,脂質體Lip2000系購自Sigma公司,Western blot試劑盒購自上海銳賽公司;研究所用的相關基本試劑及試驗耗材均購自西安交通大學實驗耗材供應中心,基本操作儀器由西安交通大學環境重點實驗室提供。
1.2 方法
1.2.1細胞培養 U87細胞用含有雙抗(青霉素、鏈霉素各100 000 IU/L)、10%胎牛血清的DMEM培養基在37 ℃培養箱、5% CO2條件下培養,定時換液、傳代。
1.2.2真核表達載體構建與目的基因細胞穩定轉染 采用Primer5 軟件設計IDH1 PCR擴增引物,模板為Pcmv-IDH1、參考文獻進行擴增,PCR產物大小為225~1 466 bp ;采用限制性內切酶BamH I和Sac1進行雙酶切,回收酶切片段,T4 DNA 連接酶對載體與雙酶切產物進行重組,構建(wild isocitrate dehydrogenase1,wIDH1)真核表達載體,利用點突變試劑盒突變技術構建mIDH1真核表達載體。U87細胞接種培養融合率達60%~70%時,以脂質體Lip2000轉染細胞,G418篩選,直至穩定的單細胞克隆株出現,對單細胞克隆株傳代培養,凍存留種。
1.2.3mIDH1對體外U87細胞凋亡的影響 采用流式細胞術,轉染成功的U87細胞傳代培養24、48 h,適量0.25%的胰酶消化液消化細胞,收集細胞,室溫,800 r/min離心5 min;再次重懸細胞并計數,室溫,800 r/min離心5 min;棄去上清液,加入binding buffer 400 μL重懸細胞;加入Annexin V-RFP 5 μL,室溫避光孵育15 min;30 min內檢測(激發光波長545 nm,發射波長>575 nm)。
1.2.4TMZ對mIDH1過表達膠質瘤細胞凋亡的影響 采用流式細胞術,轉染成功的U87細胞傳代培養,加入0.25%胰酶消化、計數細胞,種入6孔培養板;按照0、50及100 mg/L的TMZ濃度計算需要補加入的培養基和TMZ溶液量,將二者混合后緩慢加入培養孔中,設置3個復孔,培養24 h;胰酶消化,收集細胞,加入binding buffer 400 μL,重懸細胞;加入Annexin V-RFP 5 μL,避光孵育15 min,30 min內檢測(激發光波長采用545 nm,發射波長>575 nm)。
1.2.5TMZ對mIDH1過表達細胞凋亡相關蛋白表達的影響 采用Western blot法,轉染成功的U87細胞細胞胰酶消化,離心收集,用50 mg/L的TMZ培養液重懸細胞并傳代;培養24 h時,置于冰上,RIPA裂解液裂解15~30 min。收集細胞,超聲粉碎,4 ℃ 12 000 r/min離心15 min;吸取上清液,蛋白定量分裝保存。SDS蛋白質聚丙烯酰胺凝膠電泳及轉膜,取待測蛋白樣品40 μg上樣,進行半干式法轉膜,TBST漂洗PVDF膜,5%脫脂奶粉封閉2 h;加入封閉液稀釋配制的一抗,4 ℃孵育過夜;分別加入以牛奶封閉的HRP標記的二抗(1 ∶5 000),室溫孵育2 h;TBST溶液洗膜、顯色,顯影定影;凝膠成像系統掃描記錄目的蛋白的表達強弱,用光密度表示,目的蛋白與β-actin比值來表示相對表達水平,全自動凝膠成像系統對結果拍照并分析。
1.2.6TMZ對裸鼠移植瘤凋亡相關蛋白表達的影響 采用免疫組織化學法,皮下注射法構建裸鼠移植瘤模型,計算裸鼠體表面積(S),S= 體型系數(0.06)×2/3體質量,根據裸鼠的體表面積及TMZ用藥參考確定TMZ給藥劑量,將TMZ用DMEM配成混懸液,按裸鼠體表面積每日灌胃給藥,連續5 d,實驗終末處死裸鼠,留取移植瘤標本,石蠟包埋,做5 μm石蠟組織切片、烘干、二甲苯及梯度酒精脫蠟, 3% H2O2浸泡,加入檸檬酸緩沖液暴露抗原結合位點,加一抗(利用PBS代替一抗作空白對照),4 ℃過夜,加入二抗,37 ℃孵育30 min,滴上適量的SABC,37 ℃孵育30 min,滴加顯色劑,中性樹膠封片,顯微鏡下觀察瘤細胞內見棕黃色或者棕褐色顆粒為陽性細胞。按陽性細胞面積計分:不表達記0分、<10%記1分、10%~50%記2分、51%~80%記3分、>80%記4分,按著色強度計分:不表達記0分、弱表達記1分、中度表達記2分、強表達記3分;兩者積分乘積為0表示陰性、>1為陽性、1~3表示弱陽性、4~7表示陽性、8~12為強陽性。
1.3 統計學方法
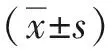
2 結果
2.1 mIDH1穩定轉染U87細胞系構建
如圖1所示,mIDH1基因穩定轉染U87細胞后,經G418單克隆篩選,最終篩選出穩轉細胞單克隆株,因目的基因與熒光報告基因有共同的啟動子,故而目的基因得到穩定表達,熒光顯微鏡下可見穩定表達的EGFP熒光報告基因。

圖1 U87穩定轉染細胞內EGFP表達(40×)Fig.1 Expression of EGFP in U87 stable cell line
2.2 U87細胞凋亡率
如圖2,將mIDH1、wIDH1及對照組穩定轉染U78細胞常規培養進行細胞凋亡檢測,結果顯示,與對照組比較,mIDH1組細胞凋亡率無顯著改變,經培養24 及48 h時3組細胞的細胞凋亡率均接近于1%,差異無統計學意義(P>0.05);因未檢測到mIDH1/wIDH1對體外培養細胞的凋亡有明顯影響,故未再對體內凋亡蛋白進行檢測。

圖2 3組U87細胞培養24 h及48 h的細胞凋亡率Fig.2 Apoptotic rate of the three cell line cultured for 24 hand 48 h
2.3 TMZ干預后U87細胞凋亡率
流式細胞檢測結果顯示, TMZ干預濃度為50 mg/L時,mIDH1過表達組U87細胞即表現出較高的凋亡率,且隨TMZ濃度的升高,細胞凋亡比例升高,與其它兩組比較,差異有統計學意義(P<0.05),wIDH1組細胞凋亡率顯著低于對照組,差異有統計學意義(P<0.05)。見表1。

表1 不同濃度TMZ 作用下三組細胞的凋亡率(%)Tab.1 The effect of different concentrations of TMZ on cellular apoptosis
注:(1)與對照組比較,P<0.05;(2)與 mIDH1組比較,P<0.05
2.4 TMZ干預后U87細胞Bcl-2、Bax、Caspase-3及Caspase-9蛋白表達
轉染mIDH1、wIDH1及空載體的膠質瘤U87細胞經TMZ干預后,Western blot結果顯示,與對照組比較,mIDH1組腦膠質瘤U87細胞的Bcl-2蛋白表達水平降低, Bax、Caspase-3及Caspase-9蛋白表達水平升高,wIDH1組腦膠質瘤U87細胞Bax、Caspase-3及Caspase-9蛋白表達水平降低,差異有統計學意義(P<0.05),Bcl-2則差異無統計學意義(P>0.05)。見圖3、表2。

圖3 TMZ干預后U87細胞凋亡相關蛋白Bax、Bcl-2、Caspase-3及Caspase-9表達(Western blot)Fig.3 The effect of TMZ on the expression levels of apoptosis-associated proteins

組別細胞凋亡相關蛋白Bcl-2BaxCaspase-3Caspase-9對照組0.89±0.190.43±0.170.55±0.160.52±0.14mIDH1組0.33±0.14(1)0.88±0.21(1)0.83±0.24(1)0.69±0.14(1)wIDH1組0.92±0.21 (2)0.27±0.14(1) (2)0.26±0.15(1) (2)0.25±0.16(1) (2)
注:(1)與對照組比較,P<0.05;(2)與 mIDH1組比較,P<0.05。
2.5 TMZ干預后裸鼠移植瘤Bcl-2、Bax、Caspase-3及Caspase-9蛋白表達
免疫組織化學結果顯示, mIDH1組移植瘤中Bcl-2蛋白表達水平顯著低于對照組和wIDH1組,Caspase-9蛋白表達水平顯著高于對照組和wIDH1組,差異有統計學意義(P<0.05);wIDH1組Bax、Caspase-3蛋白表達水平顯著低于對照組和mIDH1組,差異有統計學意義(P<0.05)。見圖4、表3。

圖4 TMZ干預后移植瘤Bcl-2、Bax及Caspase-3表達(免疫組織化學法,×400)Fig.4 The effect of mutIDH1 expression on TMZ-mediated apoptosis-associated protein expression

組別細胞凋亡相關蛋白Bcl-2BaxCaspase-3Caspase-9對照組10.2±1.38.9±1.210.3±1.410.2±1.3mIDH1組3.5±0.6(1)9.8±1.210.7±1.63.5±0.6(1)wIDH1組10.5±1.4(2)2.8±0.4(1)(2)2.1±0.4(1)(2)10.5±1.4(2)
注:(1)與對照組比較,P<0.05;(2)與 mIDH1組比較,P<0.05。
3 討論
腫瘤的形成是細胞增殖過度與細胞凋亡減少的累積效應[12],抗凋亡作用不僅在腫瘤的形成中起重要作用,而且與腫瘤的放化療敏感性有著密切的關系[13]。細胞的凋亡調控是在凋亡與抗凋亡因素的共同作用下完成的,是一個多因素參與的復雜過程,調控基因分為凋亡基因和抗凋亡基因,前者如野生型p53、Bax、FAS/Apo-1、Bcl-xs等,后者如Bcl-2、Bcl-xl等。新生腫瘤的產生,往往伴隨抗凋亡基因表達上調及凋亡基因表達的下調。Bcl-2是目前研究最深入的凋亡調控基因,屬于抗凋亡基因[14],其功能蛋白定位于線粒體外膜、核膜和粗面內質網上,具有膜通透活性適配子雙重功能[15]。
研究報道,上調抗凋亡因子的表達,可在一定程度上抑制過氧化物和自由基增加所誘導的細胞凋亡[16]。目前認為,Bcl-2/Bax比值決定細胞是否凋亡。在最近一項關于侵襲性垂體瘤的研究中發現Bcl-2下調與細胞凋亡增加有關,且Bcl-2、Bax的表達水平與Caspase-3、Caspase-9 的表達水平有關,在膠質瘤細胞系的相關研究中也有類似發現[17]。Caspase家族成員的激活是細胞凋亡過程中的重要事件[18]。Caspase-3是其中的一個關鍵酶,對許多蛋白的降解都起到了重要的參與作用,Caspase-9主要發生于凋亡起始期,由藥物化療激活,進而激活下游Caspase-3,導致凋亡。Bcl-2與Bax基因是凋亡調控的兩個重要基因,Bcl-2的激活抑制細胞色素C的釋放,從而抑制Caspase激活而抑制凋亡[19]。在細胞外凋亡途徑中,死亡配體與受體,激活死亡信號,活化Caspase-8,細胞色素C釋放或者通過直接作用于Caspase-3及其它下游Caspase活化凋亡途徑。在細胞內途徑中,細胞內的一切異常改變都可作為死亡通知信號,誘發細胞死亡,這些改變可導致線粒體釋放細胞色素C與Caspase-9結合形成凋亡復合體而進一步被激活,其下游的Caspase-3等被激活而導致細胞凋亡。TMZ在體內轉化為活性產物,導致DNA甲基化加成物的錯配修復,發揮細胞毒作用,啟動內源性凋亡途徑[20]。
本研究發現,TMZ作用于體外膠質瘤細胞后,mIDH1組U87細胞Bcl-2表達下調,Bax、Caspase-3、Caspase-9表達均有不同程度的上調,其凋亡率較wIDH1組及對照組高,mIDH1通過改變凋亡相關蛋白的表達水平對TMZ的抗腫瘤效應起到了協同疊加作用,從而提高了化療敏感性,這與調控Bcl-2水平增強化療敏感性的文獻報道相符[14]。而wIDH1組U87細胞Bcl-2表達有所上調,Bax、Caspase-3、Caspase-9表達均有不同程度的下調,與mIDH1組表現相反,在一定程度上表現出化療抵抗性。同樣,TMZ干預移植瘤模型后,mIDH1組移植瘤樣本中Bcl-2的表達下調,Bax表達上調,Caspase-3及Caspase-9表達上調,在干預中表現出協同作用。wIDH1組則表現出一定的拮抗作用,究其原因可能是wIDH1通過正常的三羧酸循環維持良好的能量代謝水平及還原底物,避免細胞氧化損傷導致的凋亡[20]。而mIDH1通過異常代謝途徑,不能為提供正常的細胞供能及抗氧化還原底物,以對抗過度的氧化應激,細胞微環境的改變導致內源途徑激活,加之能量代謝不足,經典的MAPK和Akt途徑中的Bad磷酸化不足,使Bad去磷酸化而活化,活化下游的Bax基因,促使細胞色素C的釋放,最終誘發細胞凋亡。
綜上,本研究發現mIDH1通過上調TMZ作用后U87細胞及裸鼠移植瘤組織的Caspase-3、Caspase-9、Bax表達、下調Bcl-2表達促進膠質瘤細胞凋亡,增強治療敏感性,協同TMZ抗腫瘤,增加化療敏感性,改善膠質瘤患者預后。

