HE4在慢性阻塞性肺疾病的表達及意義
朱筱慧 賈嫚 許家艷 孟亞奇 喬瑩瑩 姚欣
1南京醫科大學第一附屬醫院呼吸與危重癥醫學科210029;2蘇州大學附屬第三醫院呼吸科,常州213003
COPD是一種常見的可以預防和治療的疾病,以持續性呼吸道癥狀和氣流受限為特征[1]。過去學者們認為COPD是慢性炎癥性疾病,而近年來越來越多的研究發現,蛋白酶/抗蛋白酶失衡、氧化/抗氧化失衡等非炎癥機制,亦是造成COPD氣道重塑及氣流不可逆受限的重要原因[2-3]。1964年,瑞典學者Laurell和Eriksson率先提出了蛋白酶/抗蛋白酶失衡假說,該假說目前已成為肺氣腫發病的經典機制[4]。人附睪蛋白4(human epididymis protein 4,HE4)是1991年由Kirchhoff等[5]在男性附睪組織中發現的,與分泌性白細胞蛋白酶抑制劑(secretory leucocyte protease inhibitor,SLPI)和彈性蛋白酶抑制劑elafin具備同源性,均屬于乳清酸性蛋白(whey acid proteim,WAP)抑制劑家族成員之一,后兩者在多個系統均表現出一定的抗蛋白酶活性[6]。該家族成員可通過抑制基質金屬蛋白酶、胰蛋白酶、糜蛋白酶等多種蛋白酶的活性從而保護肺組織,減輕肺組織的損傷。本研究通過檢測穩定期COPD患者肺組織、造模小鼠支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)以及人支氣管上皮細胞(human bronchial epithelial cells,16 HBE)HE4的表達水平,探索HE4與COPD的聯系。
1 對象與方法
1.1人肺組織 本實驗中研究對象肺組織由南京醫科大學第一附屬醫院呼吸與危重癥醫學科提供。肺組織來源于因肺結節、肺大泡、肺癌等相關肺部疾病接受手術治療的患者,若為肺部惡性腫瘤患者,肺組織則取自腫瘤病灶邊緣5 cm 以外的范圍。根據獲得的肺組織患者的第一秒用力呼氣容積(forced expiratory volume in the first second,FEV1)/FVC參數分為COPD組6 例(FEV1/FVC<70%)、對 照 組6 例(FEV1/FVC ≥70%)[1]。以上所有研究對象均對此實驗有所知曉并同意進行,均簽署了知情同意書。本研究通過南京醫科大學第一附屬醫院醫學倫理委員會批準(2018-SRFA-205)。
1.2動物及細胞來源 6周C57BL/6 雄性小鼠,獲取于南京江寧區青龍山動物繁殖場,生產許可證號:SCXK(蘇)2017-0001;16 HBE 獲取于美國模式菌種收集中心。
1.3材料 香煙煙霧提取物(cigarette smoke extract,CSE,美國Philip Morris公司),HE4抗體(美國Fab Gennix 公司),小鼠HE4 酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)Kit(中國華美公司),16 HBE(美國ATCC公司),1640 培養基(美國Gibco 公司),胎牛血清(美國Sciencecell公司)。引物由南京銳真生物公司生產,HE4引物序列:上游引物為5'-CAAGAGTGCGTCTCGGACAG-3';下游引物為5'-TTCATCTGGCCAGGACACTG-3',甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物序列:上游引物為5'-AGAAGGCTGGGGCTCATTTG-3';下游引物為5'-AGGGGCCATCCACAGTCTTC-3'。
1.4方法
1.4.1人肺組織免疫組織化學 首先,取得肺組織標本后,先用無菌的冰生理鹽水反復沖洗肺組織去除標本上手術時殘留的血液;其次,將肺組織完全浸沒于4%的甲醛溶液中固定,并過夜;然后,石蠟塊包埋,切成0.4 mm 厚的切片,烘片。HE染色,放置于光學顯微鏡下觀察人肺組織的病理變化。免疫組織化學檢測人肺組織HE4 蛋白表達,具體步驟如下:枸櫞酸鹽微波抗原修復、3%H2O2室溫,均15 min,PBS溶液洗滌3次;山羊血清工作液37℃孵育1 h,加一抗(HE4抗體1∶200)過夜;滴加生物素標記的二抗(山羊抗鼠1∶2 000)37℃孵育1 h,TBS 緩沖液洗滌3 次;DAB顯色,自來水終止顯色;蘇木精染色2 min;蒸餾水沖洗,鹽酸酒精分化并水洗,45℃溫水返藍10 min;中性樹脂片封片并鏡檢。采用Image-pro plus 7.0軟件分析免疫組織化學切片:每組切片分別隨機挑選5個200倍、400倍視野進行觀察并拍照。胞質棕黃色為HE4染色陽性,測量HE4陽性的積分光密度值(integral optical density,IOD),計算IOD/area。
1.4.2動物造模 采用隨機教學表法將24只6周C57BL/6雄性小鼠隨機分為對照組和COPD組,每組12只。COPD組暴露于3 ppm 的臭氧,每周2次,每次3 h[7];對照組在相同條件下暴露于空氣。分別于實驗開始后1 周、3 周末次暴露24 h后,2組各取6 只小鼠處死取材。將小鼠右肺結扎,用1 ml注射器緩慢推入0.4 ml預冷的1×PBS至氣管,30 s后緩慢回抽,將獲得的左肺BALF放入EP管中。4℃,離心半徑8 cm,1 500 r/min離心10 min,保存于-80℃冰箱。采用ELISA 檢測臭氧造模小鼠BALF中HE4的濃度,嚴格按照說明書進行操作。
1.4.3細胞實驗 分別用1%、2.5%、5%濃度的CSE預處理16 HBE細胞24 h,以無任何干預措施的細胞為對照組。移去培養基,以預冷的PBS清洗細胞,每孔加入1 ml Trizol提取總RNA,逆轉錄后加入SYBR Green行實時定量逆轉錄聚合酶鏈式反應。反應條件為:預變性95℃30 s→變性95℃5 s→退火60℃30 s→延伸72℃10 min,共40個循環。以GAPDH 為內參,采用2-ΔΔCT計算目的基因的相對表達量。
1.5統計學分析 采用SPSS 23.0統計學軟件進行數據處理,計量資料以±s表示,組間數據比較采用LSD-t檢驗。計數資料采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1基本臨床資料 2 組年齡、性別組成比較,差異無統計學意義(P值均>0.05),COPD組FEV1、FEV1%pred、FVC 及FEV1/FVC 均低于對照組(P值均<0.05),見表1。
2.2人肺組織中HE4 免疫組織化學染色及半定量 HE4主要分布于支氣管上皮細胞,肺泡巨噬細胞也有少量表達(圖1)。以IOD 值對HE4表達進行半定量分析,對照組肺組織HE4表達量為0.070±0.007,COPD組肺組織HE4 表達量為0.048±0.004,COPD組HE4 表達量低于對照組(t=2.267,P<0.05),見圖2。
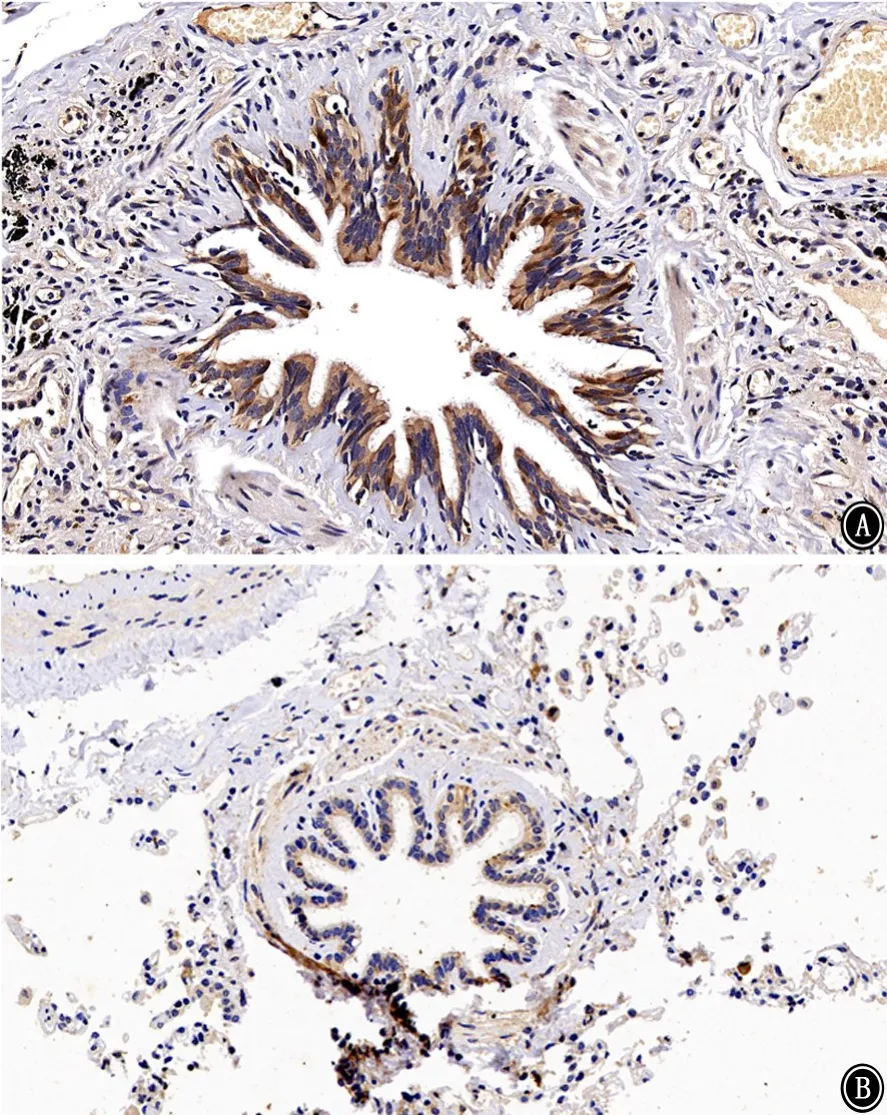
圖1 人肺組織中人附睪蛋白4病理圖片 免疫組織化學染色 ×400 A:對照組;B:COPD組
2.3COPD小鼠模型制備結果 對照組小鼠肺組織肺泡結構完整,無肺泡擴大;COPD組可見肺組織稀疏,肺泡隔減少、破壞,肺泡壁斷裂,肺泡擴大、融合,肺大泡形成(圖3),1周、3周時2組小鼠肺泡平均線性截距比較差異均有統計學意義(P值均<0.000 1),見圖4。除了肺氣腫表現,COPD組還出現了氣道壁增厚及炎癥細胞浸潤,表明造模成功。

表1 臨床病例基本資料
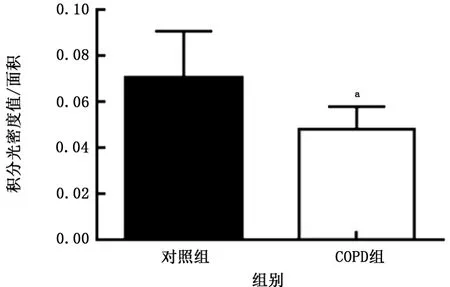
圖2 2組肺組織支氣管上皮細胞中人附睪蛋白4表達水平
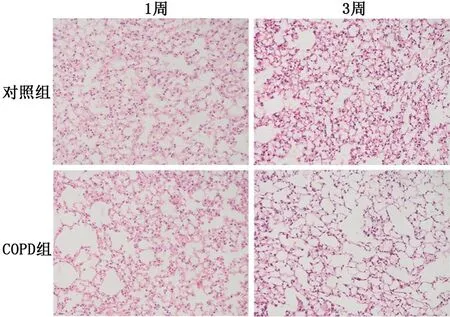
圖3 2組小鼠肺組織病理學改變 HE ×200
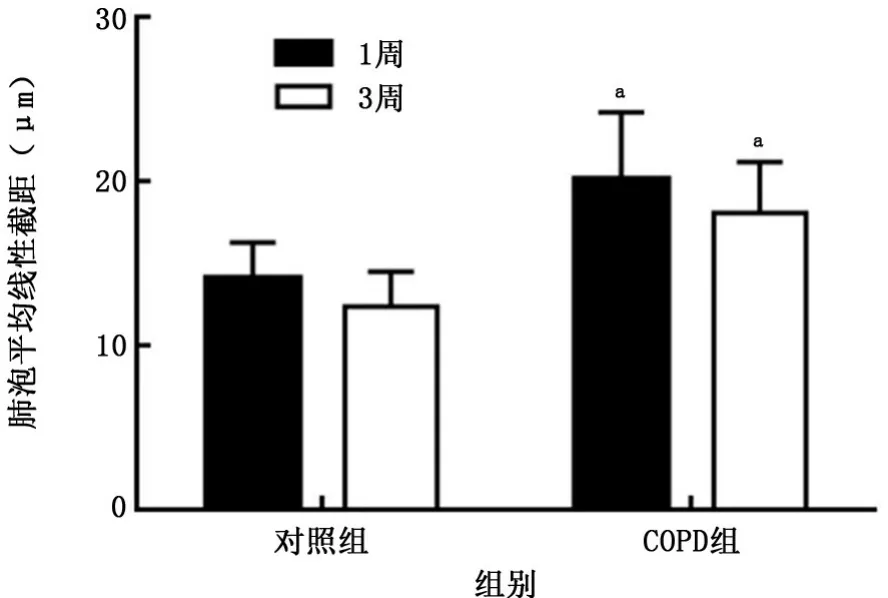
圖4 2組小鼠肺泡平均線性截距情況
2.4HE4在BALF中表達情況 1周時,對照組小鼠BALF中HE4水平為(838.5±110.2)ng/L,COPD組為(463.1±107.0)ng/L;3周時,對照組小鼠BALF中HE4水平為(760.6±138.0)ng/L,COPD組為(403.4±52.27)ng/L。在1周、3周時,COPD組小鼠BALF中HE4水平均低于對照組,差異有統計學意義(t=2.423、2.987,P值均<0.05),見圖5。
2.5HE4 m RNA 在CSE預處理16HBE中表達情況 與對照組比較,2.5%、5%CSE 干預細胞均明顯抑制HE4 m RNA 的相對表達量,差異均有統計學意義(t=3.895、4.060,P值均<0.05),見圖6。
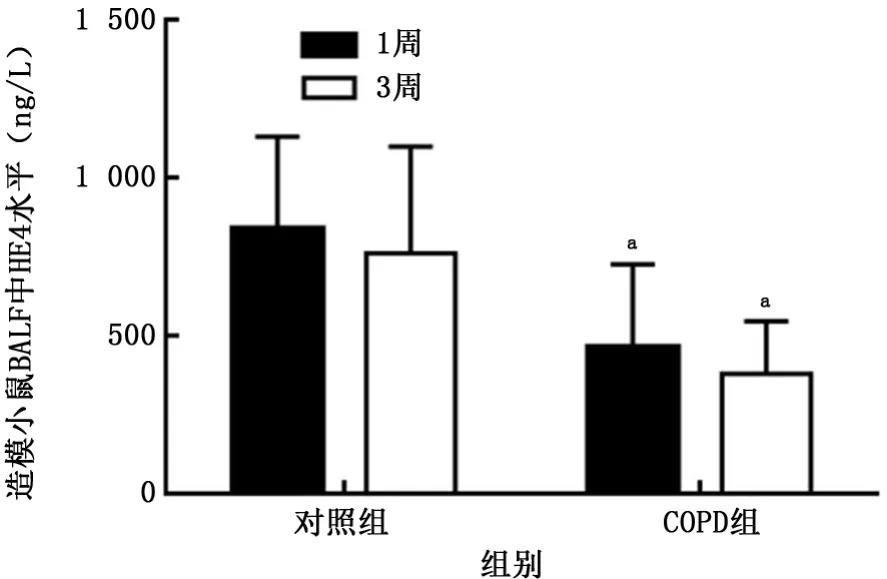
圖5 2組小鼠支氣管肺泡灌洗液中人附睪蛋白4情況
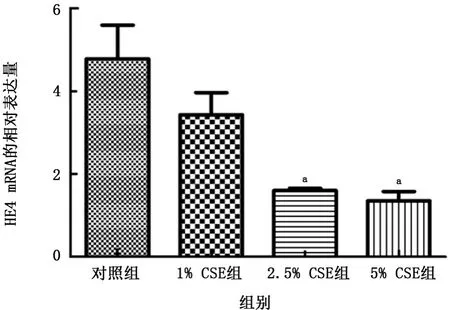
圖6 各組人支氣管上皮細胞中人附睪蛋白4 m RNA 表達情況
3 討論
COPD是目前世界范圍內一個主要的公共衛生問題[1],發病率和病死率日益增長。學者預測,到2020年,因COPD導致的病死率將會升至全球第三位[8]。盡管COPD近年來受到醫學界的極大關注,但它的確切發病機制仍然尚未完全揭曉[8]。COPD被認為是長期累積暴露于有毒氣體和顆粒等環境因素及包括遺傳學、氣道高反應性和兒童期肺部生長不良等多種宿主因素的后果[8-9]。
HE4基因又稱為WAP-4-二硫化物核心結構域2,定位在染色體20 q12-q13.1,由WAP類型的二硫鍵核心構成,編碼124個氨基酸的HE4蛋白前體,全長11.78 kb[10]。HE4分布于人體一些組織和器官,如:氣管、呼吸道上皮細胞、唾液腺、腸道黏膜、遠端腎小管、前列腺、附睪等;HE4 亦存在于一些惡性腫瘤組織中,如:婦科系統的子宮內膜癌、卵巢漿液性癌以及肺癌等[10]。
Bingle等[11]通過免疫組織化學的方法闡明了HE4在呼吸道、唾液腺、外周肺組織的表達部位,并發現其在囊性纖維化(cystic fibrosis,CF)患者的支氣管上皮細胞中表達升高。Nagy等[12]學者發現,在囊性纖維化患者中,血清HE4水平與其整體病情嚴重性及肺功能下降速度呈明顯正相關,推測HE4可作為CF 的新炎癥因子并可用作評估CF治療療效。LeBleu 等[13]發現,HE4 基因作為假定的絲氨酸蛋白酶抑制劑在人和小鼠腎纖維化模型中表達均上調,并且在腎纖維化患者血清中的濃度升高,對基質金屬蛋白酶2、基質金屬蛋白酶9、絲氨酸蛋白酶、胰蛋白酶均有抑制作用,與其自身的類絲氨酸蛋白酶抑制劑活性密切相關。在COPD領域,目前尚無與HE4 相關的研究發表。COPD患者存在遷延不愈的持久的氣道慢性炎癥,即使徹底戒煙后,這種氣道炎癥仍然持續存在,相關具體機制尚不明確,導致氣管、支氣管以及黏膜下腺體中的巨噬細胞、中性粒細胞等炎癥細胞分泌增多,并且募集、活化,造成氣道內的基質金屬蛋白酶、中性粒細胞彈力酶等蛋白酶成分的釋放顯著增多,蛋白酶占據絕對優勢,從而出現彈性蛋白降解,肺間質消融,肺泡壁結構破壞,肺泡腔擴大和/或融合,小氣道在呼氣末失去了周圍肺組織的支持而塌陷,導致COPD發生、發展[4]。另外,COPD患者氣道上皮發生杯狀細胞的增生、促炎癥介質的釋放等一系列病理生理學改變,通過上皮間充質轉化(epithelial-mesenchymal transition,EMT),引起間質標記物如成纖維細胞蛋白、基質金屬蛋白酶9等表達增高,從而產生氣道重塑[14]。因此,我們推測,HE4可能與COPD的氣道炎癥和/或氣道重塑存在一定的相關性。本項研究顯示,在COPD組患者肺組織中,HE4主要在支氣管上皮細胞中表達,同時在肺泡巨噬細胞中亦有極少量表達;COPD組小鼠BALF中HE4水平降低,推測HE4所具有的抗蛋白酶活性,可與基質金屬蛋白酶、中性粒細胞彈力酶等蛋白酶相結合,抑制彈性蛋白降解,減輕肺組織損傷,因此支氣管上皮細胞內游離的HE4消耗相應增多從而導致含量減少,該機制可能是HE4下降的主要機制之一。
煙霧暴露是COPD的重要的危險因素,16HBE受CSE刺激后,HE4表達水平下降,表明支氣管上皮細胞中HE4水平的降低可能與CSE 等有毒有害氣體對氣道屏障的損害作用有關,但具體的信號通路尚待研究。Small 等[15]發現,作為WAP抑制劑家族成員中研究最多的蛋白質,SLPI是氣道中重要的保護基質,SLPI進入巨噬細胞、單核細胞的細胞核,通過調節核因子κB 通路發揮生物學效應,其與P65競爭性結合核因子κB 的連接位點,從而抑制炎癥因子的轉錄,如:腫瘤壞死因子α和IL-8,從而減輕炎癥反應。既往研究發現,轉化生長因子β1(transforming growth factor-β1,TGF-β1)被 認 定是COPD發病進程中發揮關鍵作用的致病因子,牛瑞超等[16]研究表明,COPD大鼠模型肺組織標本中SLPI的表達量呈現顯著下降趨勢,有可能歸結于TGF-β1表達量上升;同時發現,TGF-β1使COPD大鼠模型支氣管上皮細胞中SLPI表達下降是通過Smads信號通路介導的。我們猜測,HE4與SLPI同為WAP基因家族成員,可能作用機制相同,均是通過調節核因子κB 和/或TGF-β1/Smads信號通路發揮生物學功能。
目前,在COPD領域尚無與HE4相關的研究發表。鑒于WFDC 家族蛋白質具有豐富的生物學效應,HE4作為功能多樣的分泌蛋白,在COPD的病程中可能具備重要的生物學特性。HE4具備蛋白酶抑制劑的功能[13],由此,我們猜測HE4通過調節蛋白酶/抗蛋白酶失衡機制對COPD病程產生影響,COPD支氣管上皮細胞HE4表達量降低可能因其消耗過多所導致。反之,通過重組蛋白提高支氣管上皮細胞中HE4水平,可能抑制彈性蛋白降解,減慢COPD發生、發展。本研究目前存在一定的局限性,雖然HE4在COPD支氣管上皮細胞中表達水平降低,但具體機制尚未完全闡明,本課題組下一步將會對此進行后續研究。
綜上所述,HE4可能是COPD發生、發展過程中的潛在生物標志物,對HE4作用機制的進一步研究將可能對COPD產生影響。
利益沖突所有作者均聲明不存在利益沖突

