里氏木霉利用玉米秸稈形成類胡敏酸(HAL)的特異性研究
張一楓,竇 森,葉淑芬,張丹丹
(吉林農業大學資源與環境學院,長春 130118)
玉米秸稈作為普遍存在的農業固體廢棄物,是研究腐殖化的原材料的重點對象,而其作為木質纖維素材料有著可再生且成本低的優勢。玉米秸稈的分解及有效轉化在全球碳循環中起著重要作用。而腐殖物質(Humus substances,HS)是腐殖化過程的最終產物,秸稈好氧堆肥的腐殖化過程與土壤腐殖化過程相近,是最典型的腐殖化過程[1]。作為一種環境友好型技術,堆肥也是農業殘留物處理的最佳方法之一,可以實現高效的生物轉化[2],是農業副產品可持續管理的重要解決方案[3]。
土壤HS具有不同于其形成前體的化學組成與結構特征的“特異性”[4],是經腐殖化作用形成的、具有特異性的、多相分布的類高分子化合物[5]。在最為廣泛認可的Schulten等[6]提出的模型中,土壤胡敏酸(Humic acid,HA)是由長鏈脂族結構鏈接多個芳香環而形成,在芳香環和脂族側鏈上還存在許多由羥基和羧基所構成的活性官能團組[7]。但與長期腐殖化的土壤相比,堆肥腐殖化的水平是較低的,相較于土壤中“成熟”的胡敏酸,秸稈堆肥中的類胡敏酸相對“稚嫩”[8-9],但其中含有大量含氧基團,如羧基、酚羥基、醇羥基、甲氧基和醌基等[10]。在類胡敏酸的分析中,Genevini等[11]曾提出類胡敏酸通常分為類胡敏酸(Humic acid-like,HAL)和核心類胡敏酸(Core-humic acid-like,cHAL)2種。cHAL相比HAL是去除了脂類物質后得到的胡敏酸。關于腐殖質的形成過程,比較盛行的是多酚理論,即土壤有機質首先經微生物作用,分解為簡單的有機化合物,例如保留原來芳香結構的多元酚類,成為腐殖質組成的結構單元,在酶的作用下,將多元酚氧化為醌[12],醌與含氮化合物等縮合成為腐殖質。許多學者曾對此進行試驗,發現真菌可以有效將木質素與纖維素降解轉化,并進一步形成醌型化合物[13]。
玉米秸稈主要由纖維素、半纖維素、木質素構成,上述三種成分之間存在各種化學鍵,共同構成植物細胞壁,最終變為難降解物質[14]。通常在秸稈堆肥過程中,真菌對上述三種成分都有較為強力的分解作用,對玉米秸稈的礦化分解起著重要作用。在土壤有機質中,真菌作為K策略的微生物主要分解難降解的有機質,而細菌作為r策略微生物更喜歡利用活性有機質[15]。微生物的死亡殘體、代謝產物(如胞外酶、胞外多聚物等)或殘留物(如幾丁質、肽聚糖等)也均屬于較難分解的有機質[16],植物殘體可以這些形式徹底被轉化為土壤有機質。真菌的生物體因更難分解而對土壤的有機庫貢獻更高。故使用真菌進行模擬腐殖化,對達到植物殘體的利用效益最大化更加值得研究。木霉菌是有益真菌,可以促進有機廢物利用,且對環境無危害性[17]。里氏木霉(Trichoderma reesei)具有出色的木質纖維素酶的生產能力[18-19]。如果選用里氏木霉這種對玉米秸稈分解礦化表現卓越的真菌,進行腐殖化培養,腐殖化進程是否能夠被高效促進?其培養產物類腐殖質(Humic-like substances,HLS)的堿提取物——類胡敏酸的結構特征與土壤胡敏酸有著怎樣的差異呢?是否同樣具有特異性?
針對上述疑問,本研究選擇了對玉米秸稈的木質纖維素綜合利用能力較強的真菌:里氏木霉(Trichoderma reesei),通過固體好氧發酵的方式進行為期30 d的腐殖化培養,在培養的0、15、30 d采樣觀察研究。通過元素組成、紅外光譜及差熱手段進行分析真菌利用玉米秸稈得到的類腐殖質的堿提取物——類胡敏酸,與土壤的胡敏酸的結構進行比較。以期為闡明真菌培養玉米秸稈得到的HAL的結構特異性以及真菌能否高效促進腐殖化進程提供理論依據。
1 材料與方法
1.1 供試材料
1.1.1 玉米秸稈樣品概況
采樣地點:吉林農業大學試驗田玉米連作耕地(43°48′43.57″N,125°23′38.50″E)。采樣地點屬于北溫帶大陸性半濕潤季風性氣候,春秋干旱多風,夏短多雨,冬長寒冷。溫度最高月份為7月,平均23℃,年均溫度為4.8℃,年均日照時間為2678 h,年均降水量為618 mm,多集中在7、8月。采樣地點的土壤為半濕溫半淋溶土亞綱黑土類,也就是所謂的黏淀濕潤軟土(Argiudolls),含碳量為12.31 g·kg-1,C/N為9.84,于2017年10月4日采集土壤樣品,且研究對比所用的土壤HA由該土壤制備。
采樣的玉米秸稈植株品種為中金368(采購來源為北京金粒粒金種子有限公司),玉米種子于2017年4月底播種,10月初收獲,基本性質為:秸稈有機碳376.4 g·kg-1,全氮為 7.44 g·kg-1,全磷 7.7 g·kg-1,全鉀4.5 g·kg-1,C/N為61.8。實驗用玉米秸稈于2017年10月4日采集,然后自然晾干并粉碎至0.5 cm。
1.1.2 供試微生物及微生物菌液的制備
里氏木霉(T.reesei)MCG77購買于ATCC(American Type Cilture Collection)。
首先制取菌絲,將里氏木霉接種在固體斜面試管中,內含30 mL培養基。培養基采用馬鈴薯葡萄糖瓊脂培養基(PDA)。將接種好的試管放在28℃的培養箱中培養72 h,即制備成功,得到成熟菌絲。向試管中加入2 mL無菌水,振蕩2 min,制取菌液,將上述液體轉移到滅菌試管中。通過血球計數板計數,計算濃度并稀釋,制成孢子濃度為1×107個·mL-1的孢子懸液,最后將菌液加入至PDA液體培養基中,以1∶10的比例接種,在溫度30℃,轉速為100 r·min-1的振蕩培養箱中振蕩培養6 d,得到含有孢團菌絲體的菌液。
PDA培養基:馬鈴薯(去皮)200 g·L-1,煮沸30 min并過濾,葡萄糖:20 g·L-1,瓊脂:20 g·L-1。
PDA液體培養基:馬鈴薯(去皮)200 g·L-1,煮沸30 min并過濾,葡萄糖:20 g·L-1。
1.2 試驗設計
1.2.1 腐殖化培養
培養組:將25 g秸稈粉末加入到三角瓶中后密封。置于滅菌鍋中進行滅菌處理,參數設定:溫度121℃,時間40 min。經過滅菌處理后,待溫度下降至30℃開始加入菌液和無機礦物鹽培養液(菌液10 mL、無機鹽62.5 mL),用無菌透氣性封口膜封口(能夠保證空氣交換且不會有外界粉塵進入),置于恒溫振蕩搖床上進行好氧發酵培養。
對照組:以滅菌后加入無機鹽、不添加菌液的處理作為空白對照CK。
試驗采用G-G 17三角瓶,容積為500 mL。
恒溫振蕩搖床設定參數:溫度30℃;轉速180 r·min-(1以達到充分振蕩通氣的目的)。
無機鹽培養液含有:(NH2)2CO 4.2 g·L-1,(NH4)2SO419.6 g·L-1,CaCl20.028 g·L-1,KH2PO428 g·L-1,MgSO44.2 g·L-1,FeSO4·7H2O 0.07 g·L-1,MnSO40.021 g·L-1,ZnSO40.019 g·L-1,CoCl24.2 g·L-1,酵母膏 7 g·L-1,pH=5。
1.2.2 樣品采集
將腐殖化培養時間設置為0、15、30 d,共3組,每組時間設3個重復。
到培養時間后,分別將樣品取出,在55℃條件下干燥、粉碎并混勻,全部過0.25 mm篩后備用。
1.3 測定項目與方法
1.3.1 類腐殖質的提取分組
參照土壤腐殖質組成修改法[20],從玉米秸稈培養樣品中提取類富里酸(FAL)、類胡敏酸(HAL)和類胡敏素(HLM)。通過重鉻酸鉀氧化法[21]對玉米秸稈的總有機碳含量(TOC)及各組分的含碳量進行測定,并計算HAL的相對含量以及其在類腐殖質中所占比例(PQ值)。
HAL組分相對含量為該組分的有機碳含量占玉米秸稈TOC的百分比:
HAL=HAL(g·kg-1)/TOC(g·kg-1)×100%
PQ值的計算公式:
PQ=HAL(g· kg-1)/[HAL(g· kg-1)+FAL(g· kg-1)]×100%
比較所用的土壤腐殖質提取分組方法同上。
1.3.2 類胡敏酸的提取與純化
腐殖化產物HLS中的堿提取物HAL:提取純化根據國際腐殖質協會推薦方法操作[22],具體步驟為:將烘干后的秸稈樣品稱量2.5 g加入離心管中,加入1 mol·L-1HCl溶液靜置 1 h 后用濃度為 0.1 mol·L-1的HCl調節固液比為1∶10。在25℃室溫條件下振蕩離心管6次,每次約10 min,然后低速離心棄上清液,在離心管中加入0.1 mol·L-1NaOH溶液至固液比為1∶10,用1 mol·L-1NaOH調節pH為13~14,立即向離心管中充大約30 s N2并密封。在25℃室溫下振蕩,1次·h-1,12次后靜置過夜。靜置過夜后低速離心保留上清液HLE(Humus-like extracted),以上堿提取過程重復3次。用6 mol·L-1HCl將HLE調節至pH為1~2,靜置過夜后低速離心沉淀即為HAL。用較少量的0.1 mol·L-1KOH溶解沉淀,加入KCl使K離子濃度達到0.3 mol·L-1,靜置1 h后高速離心去除懸浮物,用6 mol·L-1HCl調節pH=1.0,靜置12~16 h,高速離心棄上清液得到沉淀為HAL,用 0.1 mol·L-1HCl與 0.3 mol·L-1HF混合溶液酸洗HAL,次日經高速離心棄掉上清液,上述混合酸洗過程共重復3次。酸洗完成后,將離心管中沉淀電滲析至無Cl-(AgNO3檢測),經旋轉蒸發,凍干,得到最終純化的HAL干樣品。
比較所用的土壤HA的提取純化方法同上。
1.3.3 結構特征分析測定方法
元素組成:采用德產Vario ELIII型元素分析儀測定,在C/H/N模式下進行測量,用差熱分析中計算出的水分和灰分對數據進行校正,其中C、H、N元素含量為實測值,O+S元素含量采用差減法計算。
熱穩定性:采用日本島津TA-60型熱重分析儀測定,稱取樣品量為5~7 mg,在60 mL·min-1的空氣流量條件下,以15℃·min-1的升溫速率由35℃升至700℃。使用儀器自帶軟件來進行差熱分析(Differential Thermal Analysis,DTA)和熱重分析(Thermo Gravimetric Analysis,TG或TGA)。
紅外光譜:采用KBr壓片法,在美國Nicolet AV-360傅里葉變換紅外光譜儀上進行測定,波數范圍為4000~500 cm-1,分辨率為 4 cm-1,掃描次數為6,圖譜采用Omnic Version 8.2軟件包分析,對紅外譜圖的特征吸收峰進行峰面積計算,并對相對應的特征基團進行半定量分析。
1.4 數據處理
使用Excel 2017進行數據處理,SPSS 22.0用作試驗后結果的統計分析和差異顯著性檢驗,用Origin 8.6繪制圖譜。
2 結果與分析
2.1 不同培養時間HAL的外觀及含量變化
通過圖1對于HAL的外觀觀察,可以發現秸稈中提取的HAL是深棕色的,土壤中提取的HA是黑色的,二者在顏色上有很大差異。但無論是T.reesei處理還是CK,HAL的顏色均會隨著腐殖化培養時間的增加而變深,而T.reesei處理在30 d的顏色比同期CK處理的顏色要更深,與土壤HA更加相近。
在30 d的腐殖化過程中2種處理的TOC呈下降趨勢,T.reesei處理差異顯著,HLM的下降是引起TOC下降的主要因素。通過表1和圖2均可以發現2種處理的HAL的相對含量均隨著腐殖化時間的增加而提高,T.reesei處理差異顯著。在0 d時,類腐殖質組分中FAL有機碳含量高而HAL有機碳含量低;但在15 d時,T.reesei處理的HAL有機碳含量已超越了同期的FAL;30 d時T.reesei處理的HAL有機碳含量與CK相比增幅更大且差異顯著,其HAL的相對含量在30 d高達21.49%,是CK處理2倍左右,其PQ值在此時也是CK處理的近2倍,非常接近土壤的PQ值。但土壤HA的相對含量為28.54%,仍高于HAL的相對含量很多。
2.2 不同培養時間HAL的元素組成變化
表2為不同時間下里氏木霉對HAL元素組成的影響情況。HAL在腐殖化期間呈現C高O低的狀態,C元素占HAL元素組成的50%以上。2種處理的HAL的C/N在培養一開始均在18.3左右,隨著腐殖化時間的增加均呈現不同程度的下降趨勢,T.reesei處理的下降幅度大于CK處理,并在30 d時接近土壤HA的C/N比值;2種處理的HAL在30 d內H元素均下降,O元素均增高,T.reesei處理的變化幅度更大。

圖1 土壤HA與不同培養時間下HAL的外觀比較Figure 1 Comparison of the appearance between the HAL in different culture times and soil HA
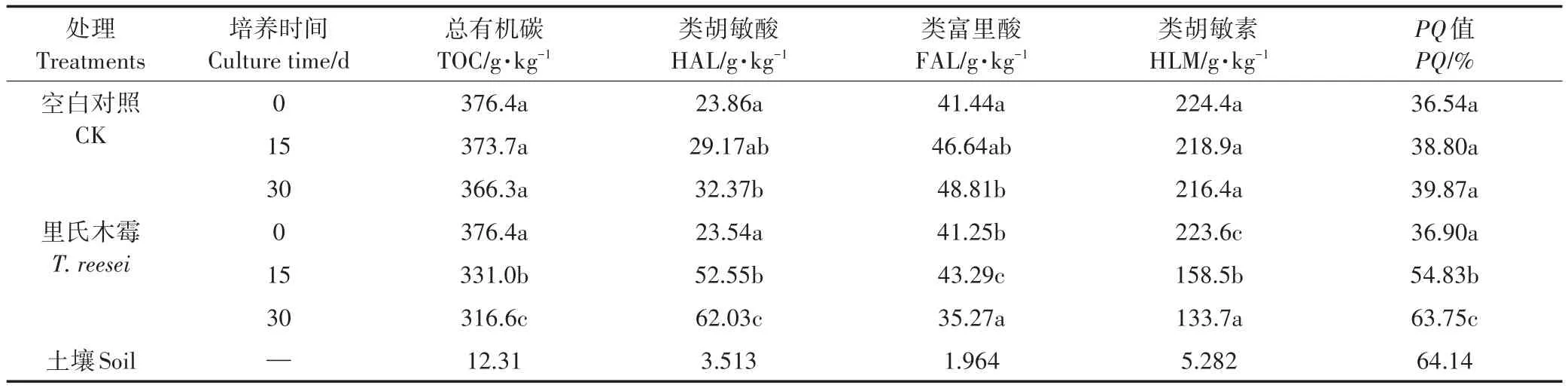
表1 里氏木霉對玉米秸稈類腐殖質組分有機碳含量的影響Table 1 Effect of T.reesei of corn straw on composition and PQ value of soil humus

圖2 里氏木霉處理下不同培養間的HAL相對含量Figure 2 Relative contents of HAL under T.reesei treatment in different culture time
通過對元素組成分析,可以簡單分析和判斷樣品中分子結構的變化情況。H/C可以直觀地表征HA的縮合度,O/C可以表征氧化度強弱,與含氧基團數量成正比[23]。根據分析結果采用H/C和O/C原子比繪制出圖3,即范氏圖(Van Krevelen圖)。
在腐殖化培養開始時,無論是T.reesei還是CK處理,其堿提取物HAL都處于O/C=0.482、H/C=1.471附近的位置上;培養15 d以后,CK處理的位置僅有微小變化,而T.reesei處理的O/C升高,H/C下降;培養30 d時,CK處理的位置更加集中在O/C=0.494、H/C=1.452的附近,而T.reesei處理的位置卻更加集中在O/C=0.531、H/C=1.330的附近,在30 d內與土壤HA的O/C差異縮減了71.08%,H/C比值差異縮減了49.25%,更加接近土壤HA的結構特征。

圖3 不同培養時間下HAL中H/C和O/C的相關性Figure 3 Correlation of H/C and O/C in HAL in different culture time

表2 不同培養時間下里氏木霉對HAL元素組成的影響Table 2 Effect of T.reesei on the elemental composition of HAL in different culture time
2.3 不同培養時間HAL的紅外光譜
不同腐殖化培養時間的T.reesei、CK處理的HAL與土壤HA的FTIR如圖4所示。T.reesei與CK處理相比在官能團區的吸收峰強度變化較大,而在指紋區僅略有變化,特征峰的相對影響強度的半定量分析見表3。
官能團區中3400 cm-1處的寬峰是由酚類Ar-OH、羥基或羧基的O-H振動引起。相比于CK,T.reesei處理可隨著模擬腐殖化時間的增加,增加HAL的羥基含量。2920 cm-1代表不對稱脂族-CH3的C-H伸縮振動峰,2850 cm-1代表-CH2-對稱脂族C-H伸縮振動峰[24],1720 cm-1則由羧基、醛或酮的C═O振動所致[25],I2920/I1720的值可以衡量脂族含量[26]。2種處理的HAL在2920 cm-1的吸收峰的相對強度在整個培養期間均隨時間而增加,T.reesei的增幅大于CK;T.reesei、CK處理在1720 cm-1的吸收峰相對強度在0~15 d均增加,但在15~30 d時CK仍保持增加的同時T.reesei卻下降了。T.reesei處理的I2920/I1720值在0~15 d下降了0.58,而CK在此期間僅降了0.05;在15~30 d時T.reesei處理的I2920/I1720值回升,較同期仍保持下降的CK處理小0.22。1620 cm-1及1500 cm-1處來自芳香烴的C═C骨架振動(呼吸),在確定是否有芳核的存在時有重要意義。因此I2920/I1620值可以衡量芳香性的強弱。T.reesei處理的HAL的I2920/I1620值在0~15 d降低了0.46,在15~30 d時下降了0.07,而同期的CK處理在30 d內僅下降了0.06。T.reesei處理的HAL的2項比值在培養的30 d過程中更接近土壤HA,但仍與土壤HA有很大差距。
指紋區中1230 cm-1的峰歸屬于芳香基團的COH振動或芳基醚和酚類的C-O-C振動,脂族的COH振動可引起1122 cm-1處峰[27]。2種處理在上述2處的吸收峰相對強度在30 d內持續增加,其中T.reesei處理的增幅更大。1034 cm-1處的峰可代表多糖與類多糖物質中C-O的存在。T.reesei處理的HAL在1034 cm-1處的相對強度隨培養時間增加而持續降低,而CK在此處無明顯變化。
2.4 不同培養時間HAL的熱穩定性變化
圖5是HAL的DTA及TG曲線,HAL樣品在分解過程中表現為中溫放熱(326~352℃)和高溫放熱(394~535℃),且HAL始終較土壤HA多一個(394~455℃)高溫放熱峰。值得注意的是CK處理在0 d時DTA曲線與T.reesei處理相似,但其從左至右的高溫放熱峰較同期T.reesei處理的分別低24、45℃;15 d時,T.reesei處理的高溫放熱峰發生明顯變化,而CK處理的DTA曲線線型仍與0 d相似;在30 d時CK處理的高溫峰發生了分峰現象,而T.reesei處理在30 d時的DTA曲線線型則與土壤HA更加接近。T.reesei處理的高溫峰隨著培養時間的增加發生了左移,并逐漸接近土壤HA放熱峰的分布位置。
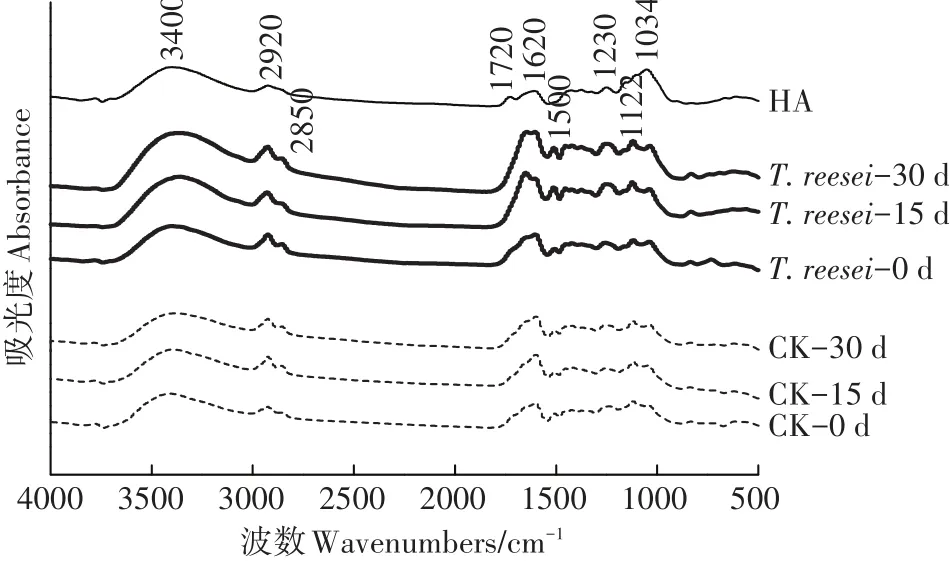
圖4 不同培養時間T.reesei、CK處理下的HAL與土壤HA的FTIR譜圖Figure 4 FTIR spectras of HA of soil,HAL of T.reesei and CK treatments in different culture time
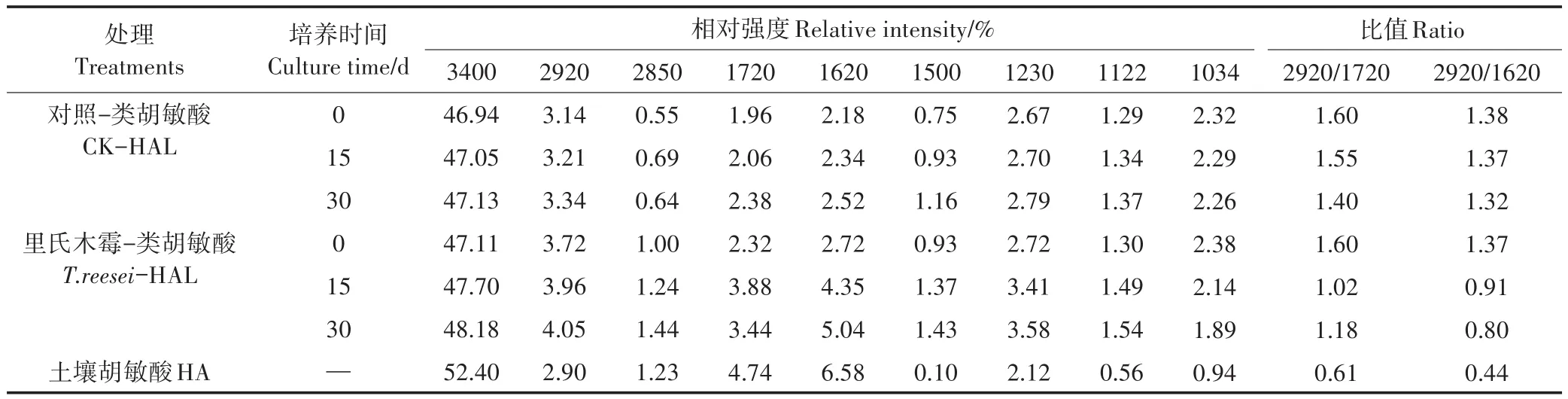
表3 不同培養時間下T.reesei、CK處理下的HAL與土壤HA的FTIR光譜主要吸收峰相對強度比較Table 3 Effects of relative intensity of the main absorption peaks in the FTIR spectrum of HA of soil,HAL by T.reesei and CK treatments in different culture time
表4為HAL的半定量分析,T.reesei、CK處理均隨著模擬腐殖化時間的增加,其HAL的熱量高/中、失重高/中比值在0~15 d不同程度地增加,T.reesei在30 d時的失重高/中比值有微小下降,30 d內其2項比值分別提升了1.539、0.378;CK處理的2項比值在30 d內僅提升了0.103、0.037。
3 討論
僅通過外觀變化便可以判定,HAL與成熟土壤中的HA仍存在著很大的差別,但伴隨著腐殖化過程中T.reesei對玉米秸稈的轉化合成與利用,使其在外觀上更加接近了HA,縮小了原本的差異。不僅是外觀的變化,HAL的相對含量在30 d時已經是同期CK的2倍。Juradom等[28]發現半纖維素、纖維素和木質素降解率比未接種微生物的堆體分別高28%、21%和25%,接種微生物可以增加HS的數量從而加快腐殖化進程。李國平等[29]認為放入微生物菌劑能夠較為顯著增加胡敏酸含量。
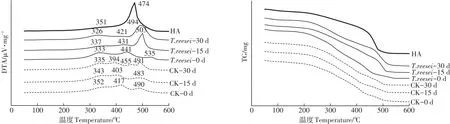
圖5 里氏木霉對HAL的DTA與TG曲線的影響Figure 5 Effects of T.reesei on DTA and TG curves of HAL
通過對不同腐殖化時間下HAL元素組成分析,發現接種T.reesei可以有效降低HAL的C/N值。在腐殖化的過程中C和N是最重要的2種元素,C為微生物提供能源,N可以提供微生物建造細胞結構[30]。Eneji等[31]通過元素分析得出秸稈堆肥過程中類胡敏酸的結構是C高O低的,表明其氧化程度較低,同時堆肥過程中有機物含量、總C含量一般呈減少的趨勢,但腐殖酸的相對含量是增加的。Amir等[32]通過元素分析得出,在好氧發酵過程中HA的H含量減少,H/C值和C/N值下降。而在本實驗中,C元素在HAL中表現為先下降后升高的變化趨勢。這可以歸因于在15~30 d的高分解階段,釋放出了一些來自其他頑固結構(如木質素)中的一些脂族化合物。Sánchez-Monedero等[33]曾研究表明,在堆肥過程中一些其他物質如木質素的降解殘留物被釋放出來,其表現的特征與HA類似,并會在pH=2時沉淀。
通過分析范氏圖的分布狀況,結合FTIR譜圖,可以得出接種T.reesei處理的HAL的O/C呈現出均值增加又略有下降的趨勢,可以歸因于在15~30 d新被釋放出的氧化度較低的脂族化合物致使O/C值下降,這與HAL在30 d時的I2920/I1720值和中溫放熱回升、失重下降變緩的結果相符。T.reesei處理下的HAL的H/C卻能持續降低,且在FTIR和DTA、TG的分析結果中顯示前0~15 d時HAL的芳香性增加速度高于15~30 d。促成這種現象的原因是0~15 d的腐殖化過程中,HAL中的脂族碳易被利用,而芳香碳較穩定在此期間被保留,即核心胡敏酸(cHAL)在此期間逐漸暴露,致使H/C下降,這一結果符合多酚學說。Adani等[34]將HAL分為不易被生物利用的的穩定組分(芳香碳)和易被微生物降解的不穩定組分(脂肪族碳)研究,他提出HAL的形成是通過不穩定部分的降解和更穩定部分的保存而進行。但HAL的降解與合成是同時進行的,很顯然在15~30 d時,伴隨著降解過程中脂族性物質的不斷釋放增多,芳香族/脂肪族的比例仍在顯著提升,這要歸功于T.reesei的合成作用。Jouraiphy等[35]通過傅里葉紅外光譜分析,發現HS在好氧發酵后芳香結構增多,其來源于發酵原料和微生物合成。Awasthi等[36]研究表明,接種真菌處理的HAL芳香化程度比未接種處理更高。在本研究的FTIR的半定量分析中,T.reesei處理下的HAL在1620 cm-1處和1500 cm-1處來自芳香烴的C═C骨架振動的吸收峰強度持續增加、I2920/I1620比值持續降低也均可證明HAL的結構在模擬腐殖化的過程中芳香性持續增加。在HAL和HLS的DTA與TG分析中也可以發現接種T.reesei可以在30 d內大幅改變芳香性與脂族性物質的比例分布,增加熱穩定性。

表4 不同培養時間下里氏木霉HAL及土壤HA的放熱與失重比較分析Table 4 Exothermic heat and mass loss of T.reesei's HAL in different culture times and soil HA
通過觀察FTIR譜圖中1034 cm-1處的相對強度變化,可以判斷在T.reesei處理下的HAL中,多糖類物質在30 d內大幅下降,相對于HAL中的其他碳源,多糖更容易被T.reesei消耗和利用,González-Pérez等[37]認為多糖在HA中的含量可以表征該土壤有機質組成與植物殘體的接近程度。HA中的多糖類物質含量越低,其腐殖質越成熟,1034 cm-1處影響強度的降低預示著T.reesei可以在30 d內有效促進HAL向成熟的HA轉化。
4 結論
(1)在30 d的腐殖化過程中,接種里氏木霉(T.reesei)可以顯著改變其培養產物的堿提取物——類胡敏酸(HAL)的結構特征,其芳香性/脂族性的比例變化支持了多酚學說。
(2)HAL在整個過程中隨著模擬腐殖化時間的增加,與土壤HA的特征差異持續縮小。里氏木霉可以在30 d內將HAL的元素結構集中在O/C=0.528、H/C=1.322左右,與土壤HA的O/C比值、H/C比值差異縮減了71.08%、49.25%。
(3)里氏木霉在降低HAL的脂族性、增強芳構化程度和熱穩定性方面能力很強,可以高效促進玉米秸稈的腐殖化進程。雖然里氏木霉處理下的HAL并不具備與土壤HA完全相同的特異性,但其可隨著模擬腐殖化時間的增加,與土壤HA的結構特征差異持續縮小,逐漸具有特異性。為利用里氏木霉與玉米秸稈腐殖化的應用提供參考。

