丁苯酞誘導缺氧條件下NDUFA4L2蛋白的高表達并參與腦保護的機制
近20年來,缺血性腦卒中的腦保護治療一直備受全世界腦研究者的關注,但諸多研究結果均未得到充分肯定[1-2],進一步深入研究缺血性腦卒中的損傷與修復機制有著重要的臨床意義。 丁苯酞是我國目前應用于臨床且被證明可有效改善缺血性腦卒中的新藥,多次被急性缺血性腦卒中診治指南推薦[3-4]。既往多個研究提示其藥效機制可能涉及多個病理機制,如細胞興奮毒性、線粒體及能量代謝障礙、氧化應激、炎癥反應等[5-6],其中,線粒體保護、改善細胞能量代謝障礙是非常重要的環節。
NDUFA4L2蛋白是細胞線粒體呼吸鏈中復合體Ⅰ(Complex Ⅰ)亞基家族中一員[7]。實驗研究發現,NDUFA4L2蛋白是唯一一個只存在于線粒體且在低氧環境高表達的ComplexⅠ亞基蛋白,其基因就是低氧誘導因子(hypoxia inducible factor 1 alpha, HIF-1a)的直接目標基因[8]。低氧環境下,嗜銘細胞瘤細胞(PC12)、腦細胞內的線粒體NDUFA4L2蛋白水平均呈高表達趨勢,故推測HIF-NDUFA4L2蛋白-ComplexⅠ反應軸可能與細胞低氧適應性、細胞損傷保護有關,但至今尚未有相關的報道證實。如前所述,NDUFA4L2蛋白僅在線粒體高表達,那么,丁苯酞的線粒體藥效作用機制是否可能與NDUFA4L2蛋白相關?換言之,NDUFA4L2蛋白是否與腦保護機制有關?本研究以PC12細胞為載體,制作PC12細胞缺氧模型,在0、6、12、18、24、48 h不同時間段觀察PC12細胞形態變化及NDUFA4L2蛋白表達變化,探索PC12細胞缺氧模型不同時間點NDUFA4L2蛋白表達變化趨勢及可能的有效時間窗,以證實NDUFA4L2蛋白對PC12細胞缺氧損傷的保護作用;其次,應用丁苯酞預處理PC12細胞培養基,應用Western blot半定量檢測NDUFA4L2蛋白,比較預處理前后NDUFA4L2蛋白變化,以期發現NDUFA4L2蛋白與丁苯酞腦保護作用的關聯,為腦保護治療的基礎與臨床研究提供部分實驗學依據。
1 材料與方法
1.1 主要材料及儀器 PC12細胞由中國科學院上海生命科學研究院神經科學研究所惠贈;光學顯微鏡OLMPUS-CKX31(日本OLMPUS公司);1640培養基(GIBCO公司);胎牛血清(GIBCO公司);馬血清(GIBCO公司);青鏈霉素雙抗混合液(GIBCO公司);胰酶消化液(GIBCO公司);三氣培養箱-3111(美國Thermo公司);NDUFA4L2抗體(Abcam公司);山羊抗兔IgG H&L(Alexa Fluor? 647)熒光二抗(Abcam公司);倒置熒光顯微鏡(萊卡公司);BCA蛋白濃度測定試劑盒(美國Thermo公司);總蛋白提取試劑盒(上海生工生物工程股份公司);DAPI(ROCHE 公司);丁苯酞原液(石藥集團恩必普藥業有限公司)。
1.2 實驗方法
1.2.1 PC12細胞培養及細胞形態觀察:使用1640培養基+2.5%胎牛血清+12.5%馬血清+1%青鏈霉素雙抗混合液作為培養液,PC12細胞培養于37 ℃5%CO2恒溫恒濕的細胞培養箱中。在顯微鏡下觀察正常培養細胞形態。
1.2.2 PC12細胞缺氧模型制作、細胞形態觀察及標本制作:利用三氣箱制作PC12細胞缺氧模型,PC12細胞放置缺氧恒溫箱(設置氧濃度為1%)中培養6、12、18、24、48 h,分別觀察每個時間段細胞形態、爬片和樣品收集。收集到的樣品加0.2 mL RIPA(radio immunoprecipitation assay)裂解液(含1%的蛋白酶抑制劑),充分吹打后收取蛋白。
1.2.3 Western Blot實驗:細胞加含蛋白酶抑制劑的裂解液,4 ℃裂解30 min。裂解完后于4 ℃下12 000 r/min離心10 min,留取上清,通過BCA法測定蛋白濃度。然后進行聚丙烯酰胺凝膠電泳,電轉移至PVDF膜上,用5%脫脂奶粉室溫封閉1 h,孵育一抗(β-actin 1∶5000、E-cadherin 1∶1000、Snail 1∶1000、Twist 1∶1000),孵育二抗(羊抗小鼠1∶10 000;羊抗兔1∶10 000),化學發光法顯示結果,曝光,顯影定影后掃描。利用Graphpad prism分析軟件對實驗結果進行分析,以目的條帶與內參β-actin的平均吸光度比值表示相對表達水平,進行半定量分析。
1.2.4 丁苯酞預處理:丁苯酞注射液預處理,按不同濃度(1μmol/L、10μmol/L、100μmol/L)分成3組分別加入培養液中,將PC12細胞放置37 ℃5%CO2恒溫恒濕的細胞培養箱中培養6 h,缺氧(1%氧濃度)培養12 h,后續進行NDUFA4L2蛋白的Western blot檢測。
1.3 統計學分析 應用SPSS 17軟件對多組數據進行單因素方差分析,兩兩比較采用LSD法,繪圖軟件為Graphpad prism,以P<0.05為差異有統計學意義。
2 結果
2.1 細胞形態變化 正常培養的PC12細胞為貼壁細胞,呈較規則圓形,折光度強,成簇生長(圖1A)。缺氧6 h(圖1B)、12 h(圖1C)、18 h(圖1D)、24 h(圖1E)、48 h(圖1F)后,細胞形態逐漸變不規則,折光度減弱,最終細胞固縮,脫落。
2.2 PC12細胞缺氧情況下NDUFA4L2的表達情況 Western blot灰度分析比較提示:6、12、18、24 h NDUFA4L2蛋白水平均明顯高于0 h(P<0.05),但NDUFA4L2蛋白表達水平與缺氧時間無明顯相關性(P>0.05)。見圖2。
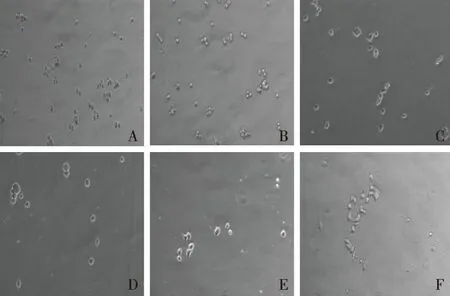
注:A:缺氧培養0 h(正常培養);B:缺氧培養6 h;C:缺氧培養12 h;D:缺氧培養18 h;E:缺氧培養24 h;F:缺氧培養48 h。
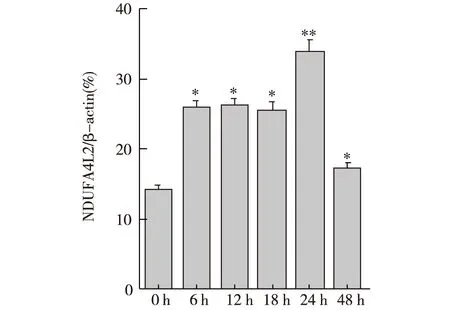
注:與0 h 比較,*P<0.05,**P<0.01
2.3 丁苯酞預處理后NDUFA4L2蛋白表達情況 使用不同濃度(1μmol/L、10μmol/L、100μmol/L)丁苯酞注射液預處理后,灰度分析提示,與未預處理組相比,丁苯酞預處理后的NDUFA4L2蛋白表達水平均增高,差異有統計學意義(P<0.05)。見圖3。
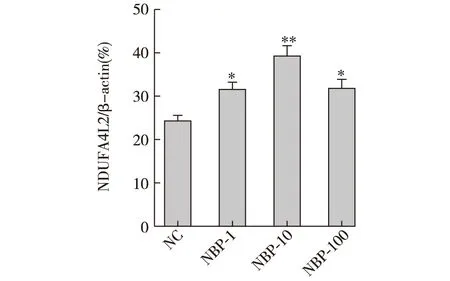
注:NC:未預處理;與NC組比較,*P<0.05
3 討論
缺血性腦卒中發生后,血流中斷即使是幾分鐘,核心梗死區也會導致不可逆轉的損傷,只有缺血半暗帶區可能被神經保護機制暫時保護;氧和葡萄糖因血流中斷而缺乏,會即刻在神經元、膠質細胞、血管(即神經血管單元)之間產生大量聯級反應性的分子路徑[9]。這些環節過程中,線粒體功能非常重要,除了直接影響能量代謝之外,還與氧化應激、炎癥反應、細胞凋亡及神經保護密切相關[10]。
NDUFA4L2蛋白是細胞線粒體呼吸鏈中ComplexⅠ亞基家族中的一員,而ComplexⅠ的含量與缺氧有關,受低氧誘導因子(HIF)調節[11],由于NDUFA4L2 基因僅在線粒體編碼,NDUFA4L2蛋白是唯一一個低氧環境高表達ComplexⅠ亞基蛋白[7-8],故備受關注。Tello等[8]提出“線粒體HIF-1a-NDUFA4L2蛋白相關的低氧適應模型”,即缺氧條件下HIF-1a上調線粒體NDUFA4L2蛋白水平,NDUFA4L2蛋白抑制電子傳遞過程的ComplexⅠ活性,其結果是氧氣消耗減少,活性氧(ROS)的產量顯著減少,從而使細胞能夠適應低氧環境;但是,隨著缺氧時間延長,NDUFA4L2蛋白水平也會逐漸下降,這可能是細胞在缺氧條件下于有效時間內的一種自我保護機制。Li等[12]通過缺氧再灌注(hypoxia-reperfusion, H/R)模型模擬心肌缺血/再灌注(ischaemia/reperfusion I/R)損傷模型,證實了NDUFA4L2可以通過Complex Ⅰ來預防心肌細胞凋亡和線粒體功能失調,從而預防H/R損傷。心肌缺血損傷修復與腦缺血損傷修復有類似之處,且缺氧條件下NDUFA4L2蛋白在腦組織中呈高表達水平,因此我們推測,腦卒中后可能也存在HIF-1a-NDUFA4L2-ComplexⅠ保護機制。
PC12細胞作為神經元的前體細胞,能夠很大程度地反映神經元在不同狀態下的結構和功能變化,并彌補神經元不能傳代在實驗中所造成的不便制作。所以,利用PC12細胞制作缺氧模型模擬腦缺血性卒中模型是可取的。本研究通過對24 h內PC12細胞缺氧模型不同時間段的NDUFA4L2蛋白Western blot定量檢測發現,缺氧24 h內NDUFA4L2蛋白水平普遍增高,但與缺氧時間無相關性,提示24 h內NDUFA4L2蛋白可能對缺氧環境下PC12細胞損傷有保護作用。另外,通過細胞外形觀察,缺氧對PC12細胞損傷明顯,與時間呈正相關,尤以48 h后細胞損傷顯著,貼壁困難,影響48 h以后缺氧模型的建立及相關研究的進行,故本研究主要集中于24 h以內細胞缺氧模型的研究。
丁苯酞在治療缺血性腦卒中時,其發揮藥效的機制多數和線粒體有關[13-14]。NDUFA4L2蛋白作為新發現分子,其作用靶點也與線粒體能量代謝、ROS、細胞低氧適應性有關,與目前研究發現丁苯酞的藥效機制有共通之處。本研究中,PC12在不同濃度丁苯酞預處理、缺氧培養12 h后,NDUFA4L2蛋白表達水平均高于未預處理組,提示丁苯酞預處理對缺氧24 h以內PC12細胞損傷有保護作用。NDUFA4L2蛋白可能是其發揮保護作用的關鍵。
綜合實驗結果及上述分析,推論HIF-1a-NDUFA4L2蛋白-ComplexⅠ路徑可能是丁苯酞保護線粒體、抗氧化應激等的藥效作用機制之一,NDUFA4L2蛋白可能與腦保護機制有關,NDUFA4L2蛋白相關的HIF-1a-NDUFA4L2蛋白-ComplexⅠ通路可能是腦保護研究的一個新路徑或靶點,有進一步探索和研究價值。

