基于β-內酰胺酶構建大腸桿菌體內Aβ42聚集抑制劑篩選體系
趙文平,賈龍剛,路福平,劉夫鋒
(工業發酵微生物教育部重點實驗室,天津市工業微生物重點實驗室,工業酶國家工程實驗室,天津科技大學 生物工程學院,天津 300457)
人體內某些蛋白質在特定病理條件下會發生錯誤折疊和聚集,最終在組織或器官內形成不溶性淀粉樣蛋白沉積,進而引發如阿爾茲海默病(Alzheimer’s disease,AD),帕金森綜合癥和II型糖尿病等疾病[1]。AD是以進行性認知功能障礙和行為損害為特征的神經退行性疾病,多發生在老年及老年前期。目前,AD嚴重影響著世界上數以千萬計的患者,對家庭和社會造成了極大的負擔[2]。AD的病因復雜,其中淀粉樣級聯假說是目前AD發病機制的主流學說,即淀粉樣β蛋白(Aβ)在腦內的錯誤折疊和聚集是AD發生發展的關鍵因素之一[3-4]。Aβ是由β-分泌酶和γ-分泌酶依次水解淀粉樣前體蛋白APP產生的多肽片段,一般含有39~43個氨基酸。大量證據表明Aβ42的聚集性和神經毒性最強,在AD的發病過程中扮演著更關鍵的角色[5-10]。有研究報道指出,患者腦脊液內Aβ42的濃度在納摩爾每升水平[11-12]。納摩爾到微摩爾每升的低濃度水平上可溶性Aβ寡聚體對細胞軸突和突觸已存在明顯毒性作用[13],表明Aβ42在較低濃度時便能在體內發生聚集。因此,篩選Aβ42聚集抑制劑成為開發抗AD藥物的研究熱點。
開發快速、簡便和準確的Aβ42聚集抑制劑篩選方法,對于開發抗聚集藥物至關重要。硫磺素T(thioflavin T,ThT)熒光染色法是目前鑒定淀粉樣蛋白聚集抑制劑的“黃金方法”[14],其基本原理是,當ThT分子結合到富含β-折疊的淀粉樣纖維上時,在特定激發波長下會發出較強熒光。根據特定波長下樣品的熒光強度來判斷淀粉樣蛋白纖維的含量,進一步分析受試化合物的聚集抑制效果[8, 15-16]。然而該方法存在工作量大、效率低、假陽性高等缺陷。另外,由于體內外生理環境的巨大差異,體外檢測獲得的抑制劑分子在體內可能難以發揮有效的聚集抑制作用[17-19]。
前期研究表明,將易于錯誤折疊和聚集的蛋白質基因插入到報告蛋白的合適位置,報告蛋白的活性將依賴于插入蛋白的錯誤折疊或聚集狀態[20]。TEM1-β-內酰胺酶(TEM1-β-lactamase, βlac)是一種常用的報告蛋白,βlac位于革蘭氏陰性菌的細胞周質中,分為αβ和α兩個結構域,這2種結構域相互作用,在表面形成一個底物結合裂口[21-23]。研究表明,βlac的196位氨基酸殘基位于αβ和α結構域之間,βlac對該位置附近發生的插入或缺失特定片段具有耐受性[21, 23-26]。基于上述特點,將受試蛋白插入到βlac的196和197殘基之間,構建βlac-受試蛋白三聯體融合體系,可將蛋白質穩定性與宿主菌對抗生素的抗性有效聯系起來[27]。目前,基于βlac的三聯體融合體系目前已廣泛應用于優化蛋白質的體內折疊和體內識別小分子聚集抑制劑等[20-21, 28-29]。本文將Aβ42多肽插入到βlac的196和197殘基之間,構建大腸桿菌體內βlac-Aβ42篩選體系(圖1),并利用已知聚集抑制劑,結合3種檢測方法對該系統進行驗證(圖2)。
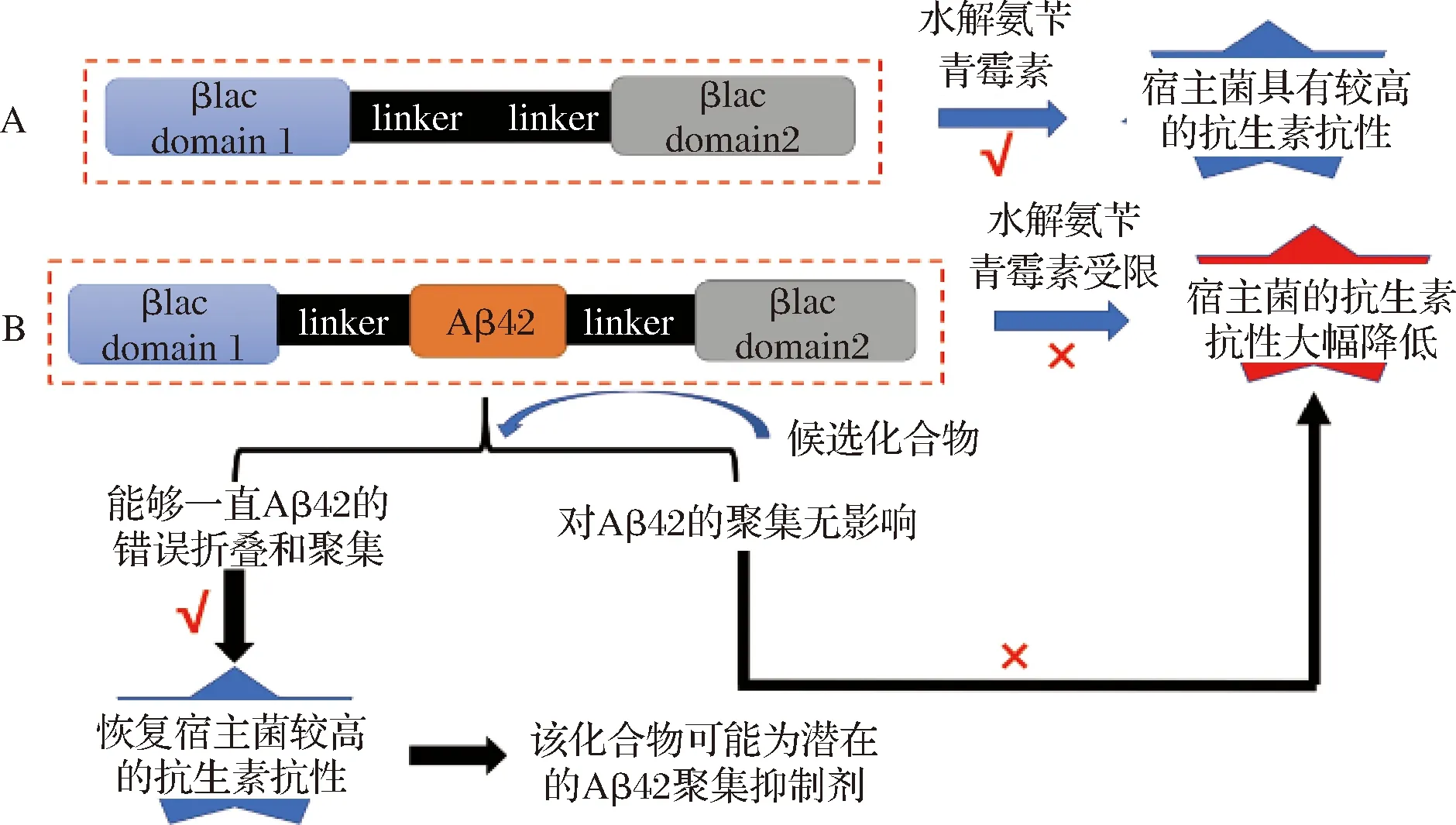
A-βlac;B-βlac-Aβ42圖1 βlac和βlac-Aβ42融合體系示意圖Fig.1 Schematic diagram of βlac and βlac-Aβ42 fusion systems
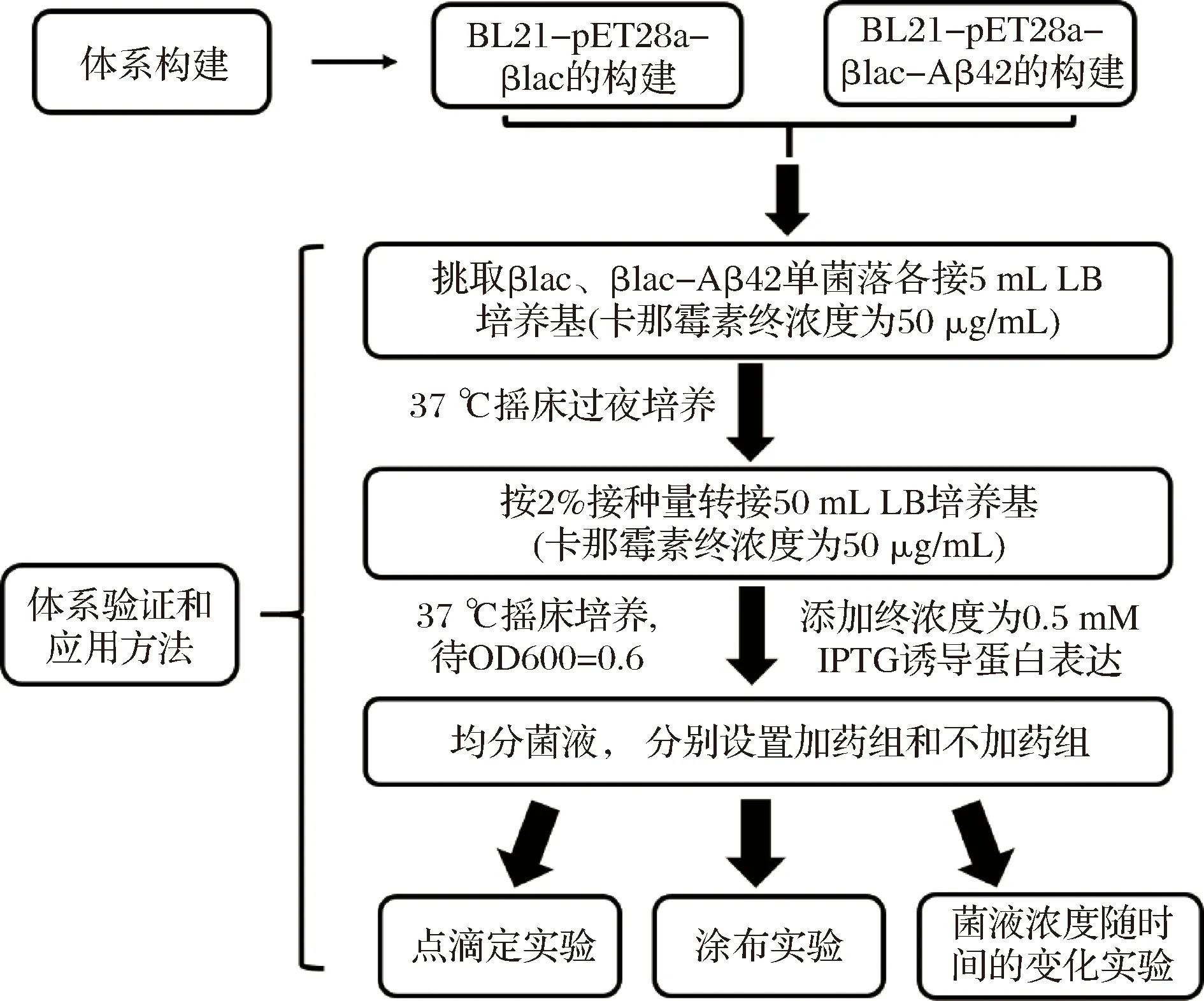
圖2 篩選體系構建流程圖Fig.2 Flow chart of the construction of the inhibitor screening system
1 材料與方法
1.1 材料與試劑
大腸桿菌JM109、BL21(DE3),pMD19T(Simple)克隆載體和pET28a表達載體質粒保存于本實驗室;高保真DNA聚合酶、T4 DNA連接酶及限制性內切酶NdeI、EcoR I、XhoI、BamH I,大連寶生物公司;質粒小量提取試劑盒,北京索來寶科技有限公司;姜黃素(curcumin)、EGCG、固綠(fast green),上海源葉生物科技有限公司;其他未注明試劑均為分析純,上海生工生物工程股份有限公司。
1.2 儀器與設備
Mastercycler nexus PCR儀,德國eppendorf公司;ZXGP-B2080隔水恒溫箱、ZHJH-C1106C超凈工作臺,上海智城分析儀器制造有限公司;Multifuge X1R高速冷凍離心機、NanoDrop 2000蛋白核酸定量儀,美國ThermoFisher Scientific公司;Infinite 200PRO多功能酶標儀,奧地利TECAN公司。
1.3 實驗方法
1.3.1 DNA片段、引物合成,pET28a-βlac、pET28a-βlac-Aβ42表達載體的構建
根據βlac蛋白氨基酸序列,密碼子優化為偏好大腸桿菌表達的DNA序列。DNA合成及測序由蘇州金唯智生物科技有限公司完成,引物由深圳華大基因公司合成,DNA及引物序列見表1。
βlac DNA序列以pUC57-βlac形式合成,NdeI和EcoR I雙酶切pUC57-βlac質粒獲得βlac片段,與具有相同黏性末端的pET28a載體框架于16 ℃連接4 h,轉化JM109大腸桿菌感受態細胞,37 ℃培養12 h后,挑取陽性轉化子進行菌落PCR驗證,并提取質粒送至金唯智基因公司進行測序鑒定,將鑒定正確的質粒命名為pET28a-βlac。
以Nde I-βlac-F,EcoR I-βlac-R為引物,通過PCR技術,獲得含有酶切位點NdeI/EcoR I的目的片段βlac。參考上述分子生物學方法,將βlac與T載體片段連接,構建T-βlac。用XhoI和BamH I同時酶切質粒T-βlac和Aβ42基因,以相同方法構建T-βlac-Aβ42質粒。NdeI和EcoR I酶切質粒T-βlac-Aβ42,回收目的片段與含有相同黏性末端的pET28a載體連接并轉化大腸桿菌JM109,最終獲得表達載體pET28a-βlac-Aβ42。
1.3.2 斑點滴定實驗[21, 23]
將pET28a-βlac、pET28a-βlac-Aβ42轉化大腸桿菌BL21(DE3),獲得重組工程菌BL21-βlac,BL21-βlac-Aβ42。挑取單菌落至5 mL LB培養基中,37 ℃過夜培養,按體積分數2%的接種量轉接至5 mL新鮮LB培養基中,37 ℃培養至OD600為0.6,添加終濃度0.5 mmol/L異丙基-β-D-硫代半乳糖苷(IPTG)進行誘導,37 ℃繼續孵育4 h,用無菌LB培養基將BL21-βlac,BL21-βlac-Aβ42菌液調至OD600=0.7,然后用170 mmol/L NaCl 10倍遞增連續稀釋。取3 μL稀釋液點滴定至LB固體培養基(卡那霉素50 μg/mL,IPTG 0.5 mmol/L),其中含有終濃度100 μmol/L小分子藥物以及不同濃度的氨芐青霉素(ampicillin, Amp)。將平板置于37 ℃孵育18 h,觀察各Amp濃度下允許菌體生長的最大細胞稀釋度。

表1 βlac、βlac-Aβ42基因序列及PCR反應所需引物序列Table 1 Sequence of βlac and βlac-Aβ42, and the primers used in the PCR reaction
1.3.3 平板涂布實驗
融合蛋白的誘導表達方法同1.3.2,37 ℃誘導4 h后,用無菌LB培養基將OD600調至0.7,并用170 mmol/L NaCl 10倍遞增連續稀釋,吸取50 μL各稀釋液均勻涂布于含有卡那霉素、IPTG、100 μmol/L小分子藥物和不同濃度Amp的6孔板固體培養基中,37 ℃培養箱恒溫孵育18 h。
1.3.4 菌體濃度檢測
融合蛋白的誘導表達方法同1.3.2,37 ℃誘導4 h后,用無菌LB培養基將OD600調至0.7。于96孔板中分別加入200 μL的目的菌液,同時加入卡那霉素(終濃度50 μg/mL),IPTG (終濃度0.5 mmol/L),小分子藥物(終濃度100 μmol/L)以及不同濃度的Amp,37 ℃恒溫振蕩培養,于不同的時間點檢測菌液濃度變化。
葉曉曉睜大了眼睛。一千塊一場,13次,她的學費就夠了啊!多一項技能總比輟學好吧。她想,反正涂當是支持的,拍就拍吧。
2 結果與分析
2.1 BL21-pET28a-βlac、BL21-pET28a-βlac-Aβ42表達載體的構建
根據βlac氨基酸序列,對其基因序列進行大腸桿菌密碼子偏好性優化,獲得完整的βlac DNA序列(表1)。將βlac與pET28a表達載體框架連接,構建pET28a-βlac表達載體質粒(圖3-A)。轉化大腸桿菌JM109,轉化子經菌落PCR驗證。結果如圖3-C所示,4個轉化子PCR產物與βlac基因理論大小一致(951 bp)。同時,采用NdeI和EcoR I雙酶切驗證pET28a-βlac是否構建成功,結果如圖3-E (泳道1和泳道2)所示,2個轉化子酶切產物與pET28a和βlac基因理論大小一致(5 369 bp和951 bp)。基因測序結果表明目標基因序列未發生突變,證明pET28a-βlac表達載體質粒構建成功。
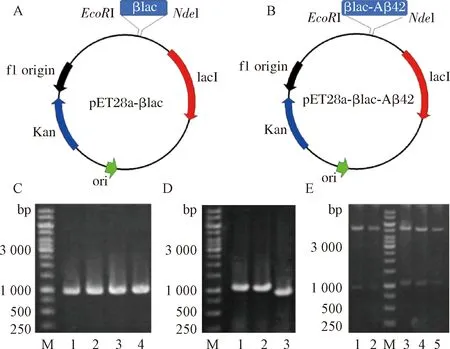
A-pET28a-βlac載體示意圖;B-pET28a-βlac-Aβ42載體示意圖;C-菌落PCR驗證pET28a-βlac轉化Jm109轉化子: M-1 kb marker; 1~4-4個pET28a-βlac轉化Jm109轉化子;D-菌落PCR驗證pET28a-βlac-Aβ42轉化Jm109轉化子: M-1 kb marker; 1~2-2個pET28a-βlac-Aβ42轉化Jm109轉化子; 3-含有pET28a-βlac的對照菌;E-雙酶切驗證pET28a-βlac和pET28a-βlac-Aβ42轉化Jm109轉化子: M-1 kb marker; 1~2-2個pET28a-βlac轉化Jm109轉化子; 3~5-3個pET28a-βlac-Aβ42轉化Jm109轉化子圖3 表達載體pET28a-βlac/βlac-Aβ42的構建和驗證Fig.3 Construction and identification of pET28a-βlac/βlac-Aβ42
pET28a-βlac-Aβ42表達載體如圖3-B所示。菌落PCR驗證結果如圖3-D所示,其中2個轉化子(泳道1和泳道2) PCR產物大小與βlac-Aβ42基因理論大小一致(1 074 bp)。進一步雙酶切驗證,可觀察到與理論大小一致的pET28a (5 369 bp)片段和βlac-Aβ42 (1 074 bp)片段,如圖3-E中泳道3、4和5所示。結合測序驗證結果證明表達載體pET28a-βlac-Aβ42構建成功。
2.2 βlac和βlac-Aβ42蛋白的表達
重組質粒pET28a-βlac、pET28a-βlac-Aβ42轉化大腸桿菌BL21(DE3)感受態細胞中,挑取單克隆菌株并用IPTG誘導表達。SDS-PAGE分析蛋白表達情況,由圖4-A可以看出,與BL21-pET28a空白對照相比,BL21-βlac和BL21-βlac-Aβ42中均觀察到明顯的蛋白條帶(泳道2、3),片段大小與βlac和βlac-Aβ42理論值一致(33.5和38.0 kDa),證明2種融合蛋白成功表達。
同時,分別檢測了IPTG誘導后BL21-βlac和BL21-βlac-Aβ42的菌體濃度,結果如圖4-B所示,2種重組菌株OD600值分別為1.297 5和0.736 5,表明BL21-βlac-Aβ42生長狀況較差。造成該現象的原因可能是在βlac-Aβ42融合蛋白表達過程中,Aβ42的快速聚集導致βlac-Aβ42折疊發生改變,對Amp抗性降低,導致部分細胞死亡,菌體濃度下降。

A-pET28a-βlac和pET28a-βlac-Aβ42表達產物SDS-PAGE分析;M-蛋白Marker; 1-BL21-pET28a; 2-BL21-βlac; 3-BL21-βlac-Aβ42;B-BL21-βlac與BL21-βlac-Aβ42誘導結束后的菌液濃度圖4 βlac和βlac-Aβ42蛋白表達Fig.4 Expression of the βlac and βlac-Aβ42
2.3 重組大腸桿菌菌株對氨芐青霉素耐受性分析
通過斑點滴定實驗檢測重組融合蛋白菌株對Amp的耐受能力,具體實驗方法見1.3.2。為確定最佳Amp濃度,將Amp質量濃度設置為20,50和100 μg/mL。結果如圖5-A所示,上述3種Amp濃度下,對照組BL21-βlac均有菌落生長,說明βlac蛋白誘導表達,使重組菌株BL21-βlac具有Amp抗性。與之相反,BL21-βlac-Aβ42未出現明顯的菌落說明由于Aβ42的聚集阻礙了βlac的2個結構域的正常結合,導致重組BL21-βlac-Aβ42對Amp的敏感性增加,因此在同濃度抗性平板上無法正常生長。
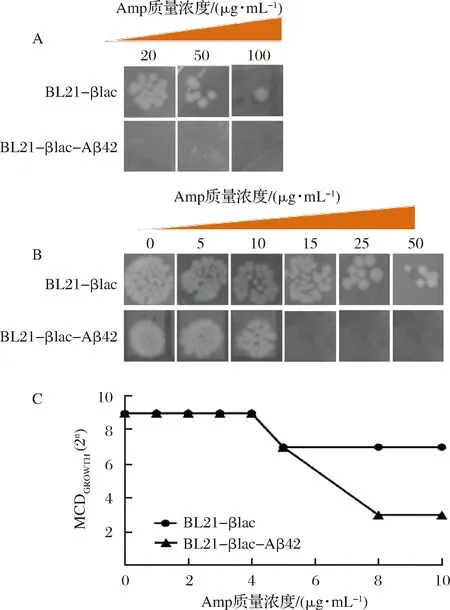
A-Amp質量濃度為20、50、100 μg/mL時,BL21-βlac和BL21-βlac-Aβ42菌落生長狀況;B-Amp質量濃度為0、5、10、15、25、50 μg/mL時,BL21-βlac和BL21-βlac-Aβ42菌落生長狀況;C-抗生素濃度與允許菌體生長的最大細胞稀釋倍數(MCDGROWTH)之間的關系圖5 不同濃度Amp對BL21-βlac和BL21-βlac-Aβ42生長的影響Fig.5 Effect of different concentrations of Amp on the growth of BL21-βlac and BL21-βlac-Aβ42
為確定BL21-βlac和BL21-βlac-Aβ42允許菌體生長的最大Amp濃度。將不同Amp濃度梯度0,5,10,15,25,50 μg/mL來進行斑點滴定實驗。結果如圖5-B所示,BL21-βlac在Amp質量濃度為50 μg/mL時仍能正常生長,而BL21-βlac-Aβ42在Amp質量濃度為15 μg/mL時菌落已不再生長。因此,選擇在低Amp濃度范圍(0~10 μg/mL)內,以允許菌體生長的最大細胞稀釋倍數(MCDGrowth)來衡量2種重組菌株的生長情況(圖5-C)。結果表明,當Amp質量濃度低于4 μg/mL時,2種菌的MCDGROWTH值為29,隨著Amp濃度的繼續增大,BL21-βlac MCDGROWTH值明顯高于BL21-βlac-Aβ42。
綜上所述,當Amp質量濃度為15 μg/mL時,BL21-βlac-Aβ42的菌落不能生長,質量濃度降為10 μg/mL時,2種重組菌的原液不僅可以正常生長,且隨著稀釋倍數的增加呈現明顯的梯度效果(圖6)。
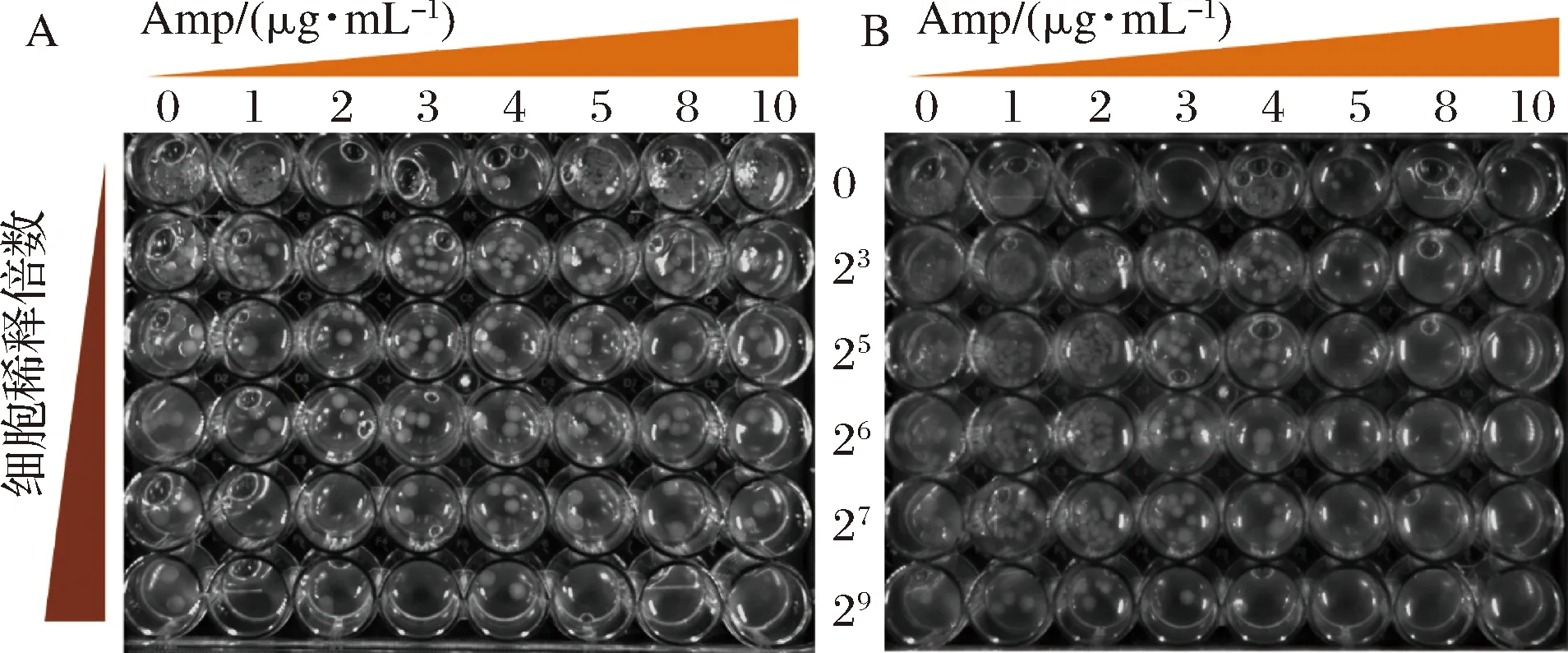
A-BL21-βlac;B-BL21-βlac-Aβ42圖6 0~10 μg/mL下Amp重組菌株的生長狀況Fig.6 The growth of recombinant strains in the presence of Amp (0~10 μg/mL)
2.4 已知Aβ42聚集抑制劑對體內篩選系統的驗證
根據上文確定的Amp濃度范圍,利用已知Aβ42聚集抑制劑,分別通過斑點滴定實驗、涂布實驗以及檢測重組菌株OD 3種方法來驗證BL21-βlac-Aβ42體內聚集抑制劑篩選體系的有效性。
2.4.1 斑點滴定實驗驗證
姜黃素是從姜科、天南星科中一些植物根莖中提取的化學成分,具有抗炎、抗氧化、抗腫瘤等作用,并且是一種典型的Aβ42聚集抑制劑[30-31]。分析姜黃素對BL21-βlac在不同濃度Amp條件下菌體細胞生長的影響,結果如圖7-A所示,Amp在質量濃度0~10 μg/mL范圍內,加藥組與未加藥組BL21-βlac在各稀釋倍數下均有菌落生長,且隨稀釋倍數增加,菌落數目逐漸減少,表明Amp質量濃度在0~10 μg/mL范圍內,姜黃素的添加不會顯著影響菌體的生長。
分別在加與不加姜黃素的條件下誘導表達βlac-Aβ42,并進行斑點滴定實驗檢測,觀察菌落生長狀態和允許菌體生長的最大細胞稀釋倍數。圖7-B結果顯示,未加藥組BL21-βlac-Aβ42允許菌體生長的最大稀釋倍數為26。添加姜黃素后,允許菌體生長的最大稀釋倍數變為210(圖5)。由此可見,由于姜黃素抑制了Aβ42的聚集,使得βlac的2個結構域正常結合,恢復BL21-βlac-Aβ42菌株對Amp的抗性。以上結果表明該體系可應用于Aβ42聚集抑制劑的篩選。

圖7 (A)0~10 μg/mL Amp下姜黃素對BL21-βlac生長狀況的影響;(B)不同稀釋倍數BL21-βlac-Aβ42在加與不加100 μmol/L姜黃素條件下菌落生長狀況Fig.7 (A)Effect of curcumin on the growth of BL21-βlac in the presence of 0-10 μg/mL Amp;(B) The growth of BL21-βlac-Aβ42 in different dilution ratios with or without 100 μmol/L curcumin
2.4.2 BL21-βlac-Aβ42發酵過程中菌液濃度變化
根據βlac-Aβ42蛋白表達過程中宿主菌OD600的變化來驗證篩選體系。將初始OD600一致的BL21-βlac-Aβ42菌液添加于96孔板中,并分別加入不同質量濃度Amp(0,2,4,6,8,10 μg/mL)和終濃度為100 μmol/L的姜黃素。不加姜黃素菌液為對照組,觀察各組菌液OD600值隨時間的變化。結果如圖8所示,在不同Amp濃度下,隨著時間的延長,加藥組與未加藥組菌液OD600值均逐漸增大。當培養時間超過5 h后,加藥組OD600值明顯高于未加藥組。綜上所述,當添加姜黃素后,Aβ42的聚集受到一定程度的抑制,促使βlac的2個結構域正常結合,并發揮對Amp的抗性作用,改善重組菌株的生長狀況。
2.4.3 平板涂布實驗
本研究利用3種已知Aβ42聚集抑制劑(Curcumin、EGCG、Fast Green),通過菌液涂布實驗進一步驗證BL21-βlac-Aβ42篩選體系。將初始OD600值相同的菌液進行相同倍數的梯度稀釋,取稀釋倍數為0、10、102、103、104和105的菌液進行涂板(Amp質量濃度為10 μg/mL)。結果如圖9-A所示,隨著菌體稀釋倍數的增加,BL21-βlac、BL21-βlac-Aβ42和添加抑制劑后的BL21-βlac-Aβ42菌落數目均逐漸減少。當稀釋倍數為102時,菌落數目明顯減少,但加藥組菌落數目多于未加藥組。稀釋倍數為103時,BL21-βlac-Aβ42無菌落生長,添加Curcumin、EGCG和Fast Green后,BL21-βlac-Aβ42依然有菌落生長,且菌落狀態正常。基于上述實驗結果,在104范圍內將菌液密集稀釋,取稀釋倍數為0、23、25、26、27、29、210、104的菌液涂板,并選取Curcumin為代表藥物,結果如圖9-B所示。添加姜黃素的BL21-βlac-Aβ42菌液允許細胞生長的最大細胞稀釋倍數為104,明顯高于未加藥組(29),證明姜黃素抑制了Aβ42的聚集,恢復BL21-βlac-Aβ42對Amp的抗性,改善菌體生長狀態。上述結果進一步證明該體內系統可以用來篩選Aβ42聚集抑制劑。
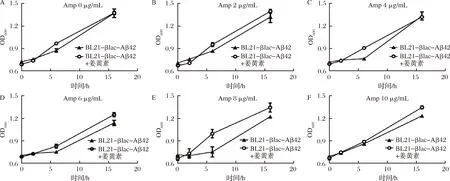
圖8 BL21-βlac-Aβ42菌體質量濃度隨誘導時間的變化Fig.8 Concentrations changes of BL21-βlac-Aβ42 along with the induction time
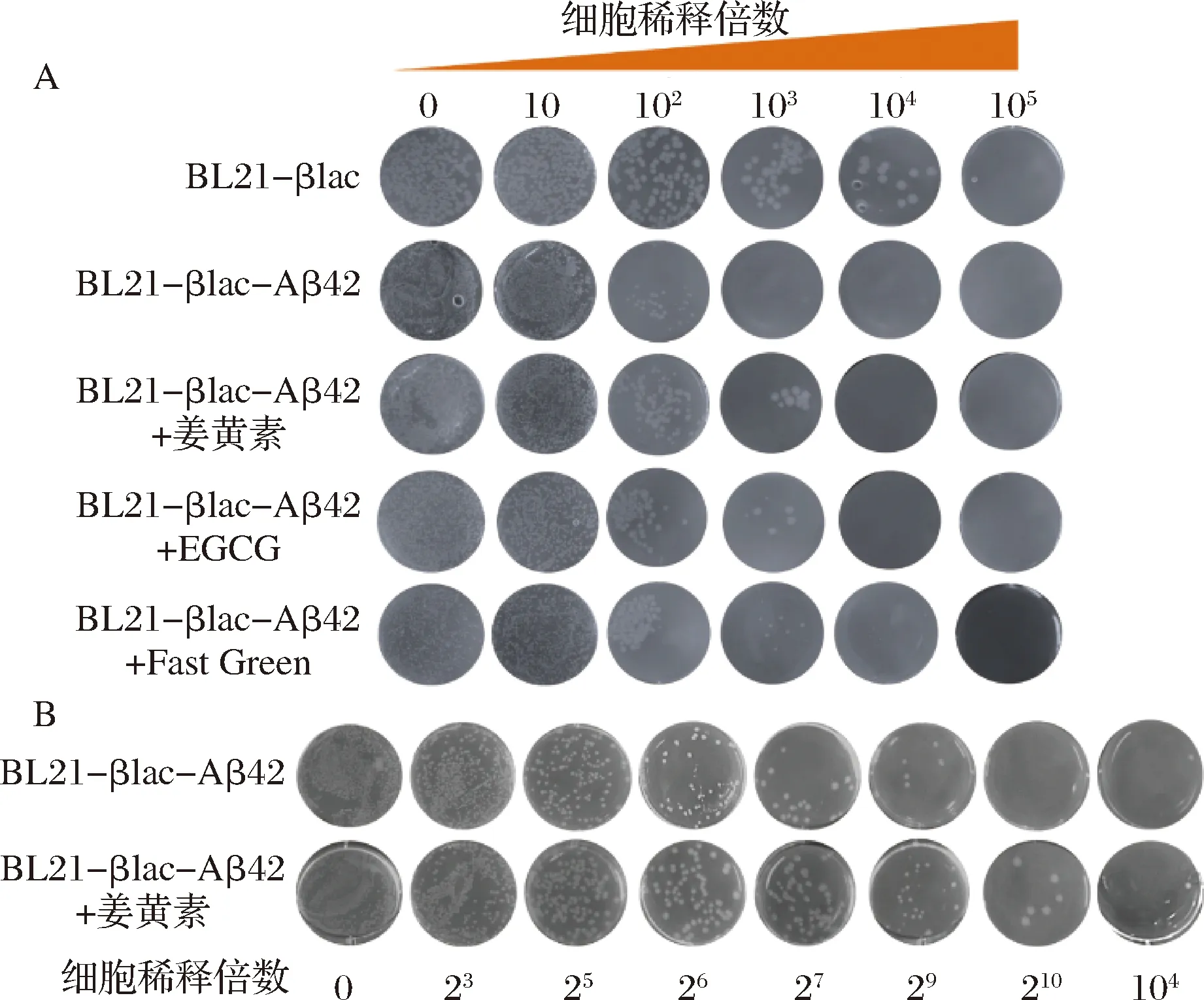
A-姜黃素、EGCG、固綠作用下BL21-βlac-Aβ42菌落生長狀況;B-密集稀釋后,姜黃素作用下菌落生長狀況圖9 不同Aβ42聚集抑制劑作用下BL21-βlac-Aβ42生長狀況Fig.9 The growth of BL21-βlac-Aβ42 in the presence of different Aβ42 inhibitors
3 結論
本研究基于βlac結構特征及Aβ42聚集特性,成功構建了BL21-βlac-Aβ42重組菌株,并將該重組菌株應用于體內篩選Aβ42聚集抑制劑。利用已知Aβ42聚集抑制劑,通過斑點滴定實驗、涂布平板實驗和檢測菌液濃度變化實驗對該體內篩選系統進行了驗證。結果表明添加聚集抑制劑后,BL21-βlac-Aβ42菌體在特定Amp濃度條件下生長狀況得到改善,允許菌體生長的最大細胞稀釋倍數增大,證明了該體系可以應用于大腸桿菌體內篩選Aβ42聚集抑制劑。本文構建的大腸桿菌體內篩選體系拓寬了淀粉樣蛋白聚集抑制劑篩選的思路,提供了抑制劑開發的新方法。

