層狀金屬硫化物硫化錫鉀的制備及其對Sr2+的吸附性能研究
梁成強,賈銘椿,王曉偉,杜志輝,門金鳳
(海軍工程大學 核科學技術學院,湖北 武漢 430033)
核工業的發展產生了大量含鍶放射性廢水,導致的環境問題也日益嚴重,需對其進行妥善的處理與處置[1]。90Sr作為主要的反應堆裂變產物之一,其半衰期較長(T1/2=28 a),由于其化學性質與Ca2+較為相似,易聚集在生物體的骨骼內并對生物體產生長期的β射線照射[2]。因此,國內外研究者致力于尋找經濟有效的放射性廢水中90Sr處理方法,其中無機吸附材料機械強度好、結構易再生、化學穩定性好、具有更規整的孔隙結構、吸附性能穩定[3],是研究熱點之一。
層狀金屬硫化物是目前對含鍶放射性廢水處理效果較好的一類吸附材料,它具有很高的選擇性和離子交換容量[4]。根據Lewis酸堿定理,層狀結構金屬硫化物中的S2-屬于軟堿離子,它對軟酸離子(如Sr2+、Co2+等)的親和性優于硬酸離子(如Na+、K+、Ca2+、Mg2+等)[5]。本研究擬采用水熱法合成層狀金屬硫化物KSnS,并測試其對Sr2+的靜態吸附性能,旨為探索含鍶放射性廢水處理的新方法。
1 實驗
1.1 主要試劑與儀器
碳酸鉀、升華硫、錫粉、丙酮、氯化鈣、氯化鎂、氯化鉀、氯化鈉,以及其他實驗試劑均為市售分析純;實驗用水為去離子水。
Smartlab9型X射線粉末衍射(XRD)儀,日本理學公司;FEI Inspect F50型場發射掃描電子顯微鏡(SEM)、Thermo K-Alpha+型光電子能譜(XPS)儀,美國賽默飛世爾科技公司;ContrAA700型原子吸收光譜儀,德國耶拿分析儀器股份公司;水熱合成反應釜,上海予申儀器有限公司;DKZ系列電熱恒溫振蕩水槽,上海一恒科技有限公司;79-1磁力加熱攪拌器,金壇市大地自動化儀器廠;GM-0.33B無油隔膜式真空泵,天津市津騰實驗設備有限公司;DZ-1BC真空干燥箱,天津市泰斯特儀器有限公司;AL204電子天平,梅特勒-托利多儀器有限公司;PHS-3D精密pH計,上海精密科學儀器有限公司。
1.2 KSnS制備
取適量K2CO3粉末、Sn粉和S粉加入水熱反應釜,再向反應釜加入少量去離子水,攪拌均勻后在220 ℃下反應18 h,將產物分別用丙酮和去離子水洗滌數次,抽濾后在100 ℃下真空干燥得到KSnS,將其研磨至粒徑小于0.1 mm的細小粉末。
1.3 表征
采用XRD儀對KSnS進行晶體結構分析,衍射靶為Cu Kα,電壓為40 kV,管電流為150 mA,掃描速率為10°/min。用SEM觀測KSnS的形貌,用EDS分析KSnS的組分。用XPS分析材料各組分的價態。
1.4 吸附實驗
吸附實驗采用DKZ系列電熱恒溫振蕩水槽,振蕩頻率為100~120 min-1,水浴溫度設定為40 ℃。實驗前首先配制Sr2+濃度為5 mg/L的水溶液,通過預實驗確定吸附劑和溶液的固液比為0.02 g∶50 mL,在此條件下分別研究接觸時間、Sr2+初始濃度、溶液pH值、共存離子對KSnS吸附Sr2+性能的影響。采用以下公式計算去除率和吸附量:
R=(c0-ct)/c0×100%
(1)
qt=(c0-ct)V/m
(2)
其中:c0為Sr2+初始濃度,mg/L;t為吸附反應時間,min;qt為t時刻的吸附量,mg/g;ct為t時刻Sr2+濃度,mg/L;V為溶液體積,mL;m為吸附劑質量,g;R為去除率,%。
2 結果與討論
2.1 KSnS表征
1) SEM分析
KSnS吸附Sr2+前后的SEM圖像示于圖1。由圖1可看出,吸附Sr2+后KSnS的形貌和尺寸未發生明顯的變化,吸附前后均為μm級片狀多邊形,表面較為光滑,局部稍有凸出。

圖1 KSnS吸附Sr2+前(a)、后(b)的SEM圖像Fig.1 SEM image of KSnS before (a) and after (b) adsorption of Sr2+
2) EDS分析
KSnS吸附Sr2+前后的EDS能譜示于圖2,元素摩爾分數變化列于表1。由圖2和表1可見,吸附Sr2+后KSnS中K的含量明顯下降,Sn和S的含量稍有增長。由此可推斷出溶液中的Sr2+是與KSnS中的K+發生了交換。根據電荷守恒定理,交換下的K+的量應為吸附的Sr2+的量的2倍,這與EDS能譜分析結果一致。Sr2+對K+的替換也導致KSnS中各元素的物質的量之和下降,而吸附前后Sn和S物質的量變化不大,因此吸附后Sn和S的摩爾分數出現了少量增長。

圖2 KSnS吸附Sr2+前(a)、后(b)的EDS譜Fig.2 EDS spectra of KSnS before (a) and after (b) adsorption of Sr2+

表1 KSnS吸附Sr2+前后各元素的摩爾分數Table 1 Molar ratio of KSnS before and after adsorption of Sr2+
3) XRD分析
KSnS的XRD譜示于圖3。從圖3可看出,KSnS的主峰位于2θ為10.54°處,次峰分別出現在21.22°和29.50°處,這與標準卡片(JCPDS No.22-0859)中的特征峰基本一致。KSnS具有較明顯的層狀結構,其晶體結構如圖4所示。由圖4可看出,K位于S和Sn構成的層結通道中,便于其進行離子交換反應[6]。
4) XPS分析
為進一步研究KSnS中各元素的化學狀態,對KSnS進行了XPS分析,采用XPS Peak分峰軟件分別對3種元素的軌道結合能進行擬合,擬合前采用Shirley類型本底扣除,固定Gaussian/Lorentzian比(G/L)為80%,保持同價態的K、Sn、S軌道結合能強度比分別為2∶1(2p)、3∶2(3d)、2∶1(2p),結果如圖5所示。對照XPS標準庫可知,KSnS中K主要以+1價存在,Sn主要以+4價存在,S同時存在-2價和+6價2種價態。

圖3 KSnS的XRD譜Fig.3 XRD pattern of KSnS

圖4 KSnS的晶體結構Fig.4 Crystal structure of KSnS

圖5 KSnS的XPS譜Fig.5 XPS spectrum of KSnS
2.2 KSnS的靜態吸附性能
1) 吸附時間的影響
在40 ℃、pH=7.25、c0=5.5 mg/L條件下,吸附時間t對KSnS吸附Sr2+的影響示于圖6。由圖6可知,在最初的5 min內,KSnS對 Sr2+的吸附量增加迅速,幾乎達到平衡吸附量的80%。在約35 min時達到吸附平衡,平衡吸附量為13.75 mg/g,此時Sr2+的去除率達99.62%。

圖6 吸附時間對KSnS吸附Sr2+的影響Fig.6 Effect of contact time on adsorption of Sr2+ by KSnS
2) 溶液pH值的影響
在40 ℃、c0=5.2 mg/L、t=1 h條件下,溶液pH值對吸附的影響示于圖7。由圖7可看出,在所考察的pH值范圍內,KSnS吸附Sr2+的最佳pH值為7~9,Sr2+去除率在此范圍內始終大于99%。在pH>5的弱酸環境下,Sr2+去除率可保持在80%以上。與pH<7環境下基本無吸附能力的吸附劑(如鈦酸鈉[7]和鈦硅酸鹽[8]等)相比,KSnS的吸附性能具有明顯的優勢。這是由于KSnS中的Sn和S形成了基團,阻止了S2-作為自由基暴露出來,使KSnS在酸性環境下具有較強的穩定性[9]。在強堿性環境下Sr2+會與OH-結合生成Sr(OH)-基團從而影響吸附性能[10]。總體來說,KSnS的吸附反應可操作pH值范圍較寬,對Sr2+的選擇性能較好。

圖7 pH值對KSnS吸附Sr2+的影響Fig.7 Effect of pH on adsorption of Sr2+ by KSnS
3) Sr2+初始濃度的影響
在40 ℃、pH=7.22、t=1 h條件下,Sr2+初始濃度(5、10、20、50、100 mg/L)對KSnS吸附Sr2+的影響示于圖8。由圖8可知,隨著Sr2+初始濃度的增加,KSnS中由K+脫附后形成的吸附位得到充分利用,平衡吸附量提高,并在100 mg/L時趨于飽和,飽和吸附量約為80 mg/g。

圖8 Sr2+初始濃度對KSnS吸附Sr2+的影響Fig.8 Effect of initial Sr2+ concentration on adsorption of Sr2+ by KSnS
4) 共存離子的影響
在40 ℃、pH=7.24、c0=5.2 mg/L、t=1 h條件下,考察K+、Na+、Mg2+、Ca2+的共存對KSnS吸附Sr2+的影響,結果示于圖9。由圖9可知,K+、Na+、Mg2+、Ca2+的共存均會抑制KSnS對Sr2+的吸附作用,且同一種共存離子的抑制作用隨其濃度的增加而增強。其中二價離子的抑制作用(Mg2+、Ca2+)明顯強于一價離子(K+、Na+)。這是由于二價離子的結構更接近Sr2+,同時其攜帶的電荷多,與吸附劑的結合力較大,因此二價離子對KSnS吸附Sr2+的干擾較大。當共存離子濃度與Sr2+濃度比為100∶1時,各共存離子存在下,KSnS對Sr2+的去除率分別為:K+,73%;Na+,67%; Mg2+,32%;Ca2+,36%。其對Sr2+的去除明顯優于傳統處理工藝SrTreat[6]。
5) 吸附動力學
為更好地了解KSnS對Sr2+的吸附性能,分別采用Lagergren準一級[11]和準二級[12]動力學模型分析KSnS對Sr2+的吸附過程。
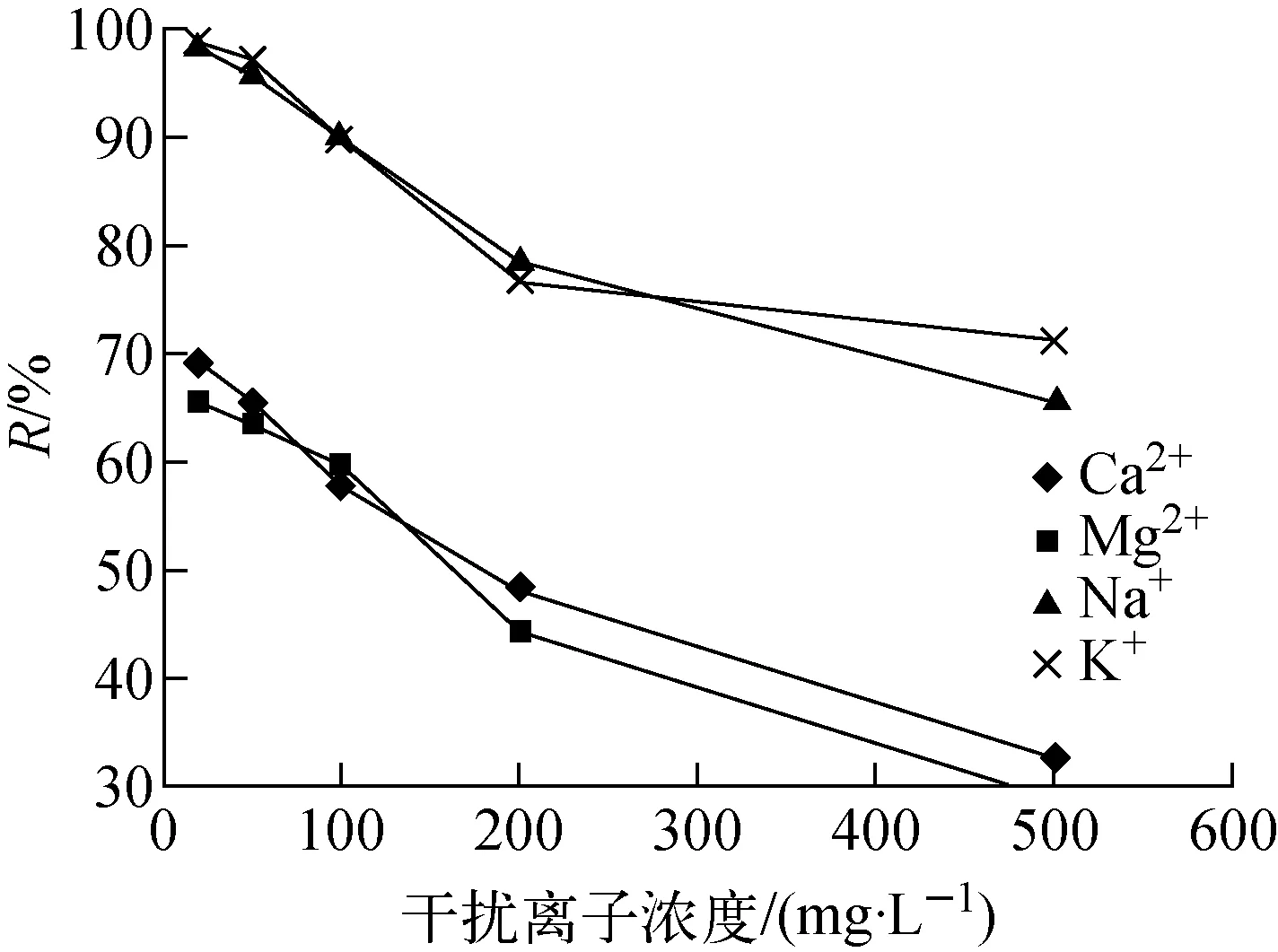
圖9 共存離子對KSnS吸附Sr2+的影響Fig.9 Effect of co-existing ion on adsorption of Sr2+ by KSnS
準一級動力學模型為:
ln(qe-qt)=lnqe-k1t
(3)
準二級動力學模型為:
(4)
其中:qe為平衡吸附量,mg/g;k1為準一級速率常數,min-1;k2為準二級速率常數,g/(mg·min)。
KSnS對Sr2+的準一級及準二級動力學擬合曲線示于圖10。由圖10中動力學方程擬合的相關系數R2可知,準二級動力學方程能更好地描述KSnS吸附Sr2+的過程,由此可推斷KSnS吸附Sr2+的過程基本遵循準二級反應機理。由于準二級動力學方程假設的是化學鍵的變化控制吸附過程,因此可認為KSnS對Sr2+的吸附屬于化學吸附[13]。
6) 吸附速率控制
KSnS對溶液中Sr2+的吸附可分為3個主要步驟:(1) Sr2+通過KSnS表面的液膜擴散至顆粒外表面,即液膜擴散;(2) Sr2+由外表面進入KSnS的內孔向顆粒內表面擴散,即顆粒內擴散;(3) 吸附反應階段。一般吸附反應的速度極快,對吸附速率的影響可忽略,因此吸附反應速率主要由液膜擴散和顆粒內擴散兩者共同控制。

圖10 KSnS對Sr2+的準一級(a)及準二級(b)動力學擬合曲線Fig.10 Pseudo-first-order (a) and pseudo-second-order (b) kinetics plot for adsorption of Sr2+ by KSnS
為探究KSnS吸附Sr2+過程中影響吸附速率的主導因素,運用Weber-Morris顆粒內擴散模型和Boyd液膜擴散模型分別對吸附反應數據進行分析。
Weber-Morris顆粒內擴散模型的表達式[14]為:
qt=I+kwt1/2
(5)
Boyd液膜擴散模型的表達式[15]為:
Bt=-0.497 7-ln(1-qt/qe)
(6)
式中:kw為顆粒內擴散速率常數,mg/(g·min1/2);Bt為qt/qe的數學函數;I為截距,mg/g。I越接近于0,則液膜擴散過程對整個吸附過程的影響越小[15]。
在40 ℃、pH=7.25條件下,KSnS吸附Sr2+的顆粒內擴散模型和液膜擴散模型的擬合曲線示于圖11。由圖11可知,兩種模型的相關系數均較高,R2>0.97,因此分別通過2個模型的擬合參數計算顆粒內擴散系數和液膜擴散系數,計算公式[16]如下:
Di=5π/3·(rpkw/qe)2
(7)
(8)
式中:Di為顆粒內擴散系數,m2/min;rp為顆粒半徑,m;DB為液膜擴散系數,m2/min。
根據電鏡觀察結果,KSnS的顆粒半徑約為0.25 μm,結合圖11中的兩個擬合方程所得數據計算得到Di=1.35×10-13m2/min,DB=3.24×10-14m2/min。可見,液膜擴散系數稍小于顆粒內擴散系數,因此液膜擴散過程是主導吸附速率的步驟。Weber-Morris顆粒內擴散模型中I=7.72 mg/g,也進一步印證了液膜擴散過程對整個吸附過程影響較大,這是由于溶液中Sr2+的濃度較小,液膜擴散的推動力較小。

圖11 KSnS吸附Sr2+的液膜擴散模型(a)和顆粒內擴散模型(b)的擬合曲線Fig.11 Fitting curve of Boyd model (a) and Weber-Morris Model (b) for adsorption of Sr2+ by KSnS
3 結論
1) KSnS對溶液中Sr2+的吸附速率較快,在35 min左右達到吸附平衡,對Sr2+的去除率達到99.62%。
2) KSnS吸附Sr2+的最佳pH值為7~9,在此范圍內,Sr2+的去除率始終大于99%,在pH>5的弱酸環境下,Sr2+的去除率能保持在80%以上。
3) 離子共存對吸附性能的抑制作用隨離子濃度的升高而加大,當共存離子濃度與Sr2+濃度比為100∶1時,KSnS對Sr2+的去除率分別為:K+,73%;Na+,67%;Mg2+,32%;Ca2+,36%。
4) KSnS吸附Sr2+的過程基本遵循準二級反應機理,KSnS對Sr2+的飽和吸附量約為80 mg/g,吸附過程以化學吸附為主。
5) Weber-Morris模型和Boyd模型綜合表明,液膜擴散是吸附速率的主導步驟。

