硝普鈉對紅掌愈傷形成及植株再生的影響
李水根,李秀芬,李記開,朱建軍
(上海市農業科學院林木果樹研究所,上海201403)
紅掌(Anthurium andraeanum)為天南星科(Araceae)花燭屬(Anthurium Schott)多年生草本花卉,原產于南美洲的熱帶雨林。紅掌佛焰苞顏色鮮艷,花型優美,具有較高的觀賞價值,通常用于鮮切花、盤花和花壇造景[1]。組織培養方法是紅掌種苗進行規模化生產的主要途徑,其中愈傷發生的間接不定芽再生途徑是目前最為高效穩定的紅掌組培快繁技術手段,同時也是進行遺傳轉化的理想受體系統[2]。然而紅掌胚性愈傷的發生能力受到基因型的影響,且再生周期較長,嚴重影響紅掌分子育種的進程。胚性愈傷的生長狀態直接影響不定芽的分化能力,提高紅掌胚性愈傷的發生頻率和質量,可以降低紅掌組培快繁的生產成本,對于紅掌的種苗生產具有重要意義。
紅掌胚性愈傷的發生受到外植體、培養基、植物生長調節劑等因素的影響。Perik[3]最早開展紅掌的組織培養研究,采用葉片進行離體培養獲得了胚性愈傷,并最終成功誘導植株再生。此后,研究人員開展了大量的研究工作,發現紅掌的葉片、葉柄、佛焰苞、合子胚和花粉均可以作為外植體誘導胚性愈傷的發生[4-5]。誘導愈傷發生的植物激素一般采用細胞分裂素 6-BA[6-9],配合使用生長素 2,4-D[6-7,9]或NAA[8,10]。單獨使用6-BA或 TDZ[11-12]也能誘導愈傷組織的發生。誘導的愈傷組織類型多樣[13],有致密顆粒狀和松散易碎狀,它們具有不同的分化潛能。有研究發現,細胞分裂素6-BA可以有效誘導紅掌愈傷分化形成不定芽[6]。不定芽的發生起源于愈傷組織的表面,將愈傷進行表面劃痕和再次切割后,能有效提高不定芽的分化頻率[13]。紅掌在叢生芽增殖時期就有不定根同步發生,而且較容易形成氣生根。雖然紅掌生根較容易[5],但不定根的數量較少,不定根的數量和質量直接影響植株后期移栽的成活率。
一氧化氮(NO)作為一種氣體分子,在植物體內廣泛存在。Shen等[14]研究發現,NO調控植物愈傷的發生和不定芽再生。硝普鈉(SNP)作為NO的供體化學物質,被廣泛應用于植物研究中。SNP處理可以提高山藥愈傷組織發生和植株再生的頻率[15],促進櫻桃砧木不定芽的增殖和生根[16]。本試驗開展SNP處理對紅掌愈傷誘導、不定芽再生和植株生根的研究,以期提高紅掌的植株再生頻率和組培苗質量。
1 材料與方法
1.1 試驗材料
以紅掌‘阿拉巴馬’的幼嫩葉片為外植體,通過愈傷誘導的間接器官發生途徑,建立紅掌不定芽再生體系。將紅掌植株剪成帶有單個芽的莖段,轉接到新的增殖培養基上,每個月繼代一次,實現不定芽的繼代培養。
為了誘導胚性愈傷組織發生,以上述繼代培養的植株葉片為外植體,將葉片橫向剪成兩半,葉背面朝下接種于愈傷誘導培養基上。約2個月后愈傷從葉片傷口處發生,將愈傷轉接于不定芽分化培養基上,繼續培養2個月左右,不定芽從胚性愈傷上誘導發生。將大于1 cm的不定芽從愈傷組織上切下,轉接于生根培養基上,約1個月后植株基部可誘導不定根發生。
1.2 培養基及培養條件
紅掌不定芽增殖培養基以Pierik medium[3]為基本培養基,同時添加0.5 mg/L 6-糠基氨基嘌呤(KT)和0.05 mg/L萘乙酸(NAA),培養溫度為(25±2)℃,光照強度為2 000—3 000 lx,光照周期為16 h光照∶8 h黑暗。
愈傷誘導培養基以Pierik medium為基本培養基,同時添加0.5 mg/L噻苯隆(TDZ)、30 g/L蔗糖、2.8 g/L結冷膠,培養溫度為(25±2)℃,暗培養。不定芽分化培養基以1/2 MS為基本培養基,同時添加0.5 mg/L 6-芐氨基嘌呤(6-BA)、25 g/L蔗糖、6.5 g/L瓊脂粉。生根培養基以1/2 MS為基本培養基,同時添加0.2 mg/L吲哚丁酸(IBA)、0.4 g/L活性炭、25 g/L蔗糖、6.5 g/L瓊脂粉。不定芽分化培養和植株生根培養的溫度均為(25±2)℃,光照強度為2 000—3 000 lx,光照周期為16 h光照∶8 h黑暗。
在紅掌愈傷誘導、不定芽分化和植株生根的過程中添加不同濃度的SNP。將SNP粉末配制成母液濃度為0.2 mol/L的水溶液,過濾滅菌后分裝于棕色離心管中,保存于-20℃備用。愈傷誘導、不定芽分化以及植株生根的培養基組分和培養條件與上述相同。將培養基高溫高壓(121℃,103—107 kPa)滅菌20 min后,冷卻至60℃,添加SNP母液,使愈傷誘導培養基、不定芽分化培養基和植株生根培養基中所含SNP的濃度梯度分別為0μmol/L、10μmol/L、20μmol/L、40μmol/L、80μmol/L。將愈傷誘導培養基分裝于直徑為9 cm的培養皿中,每個處理10皿,每皿接種12個外植體。將不定芽分化培養基分裝于罐頭瓶中,每個處理接種10瓶,每瓶接種5塊愈傷組織。將植株生根培養基分裝于罐頭瓶中,每個處理接種6瓶,每瓶接種5棵植株。
1.3 數據統計
將葉片外植體轉接到愈傷誘導培養基上,培養2個月后統計每個培養皿中的愈傷發生率和愈傷鮮重。愈傷發生率=(發生愈傷的外植體數量/接種的外植體數量)×100%。將愈傷組織轉接到不定芽分化培養基上,培養2個月后,統計每瓶中不定芽誘導率以及每塊愈傷組織誘導不定芽的數量。不定芽誘導率=(發生不定芽的愈傷數量/接種的愈傷數量)×100%。將不定芽剪下后轉接于生根培養基上,培養1個月后統計每棵植株不定根的數量和長度。采用DPS軟件進行統計學分析,方差分析采用Duncan多重比較,P≤0.05表示差異顯著。
2 結果與分析
2.1 不同濃度SNP處理對紅掌葉片愈傷誘導的影響
以繼代培養的紅掌植株葉片為外植體,將葉片從中間剪成兩半,接種到愈傷誘導培養基約2個月后,白色致密型愈傷組織從葉片傷口處發生,同時在葉柄傷口處也有部分愈傷組織發生(圖1)。在添加不同濃度的SNP培養基上,愈傷的發生具有一定程度的差異。其中,在添加20μmol/L SNP的愈傷誘導培養基上,葉片愈傷的誘導率和鮮重均最高,顯著高于對照。當SNP濃度為40μmol/L時,愈傷的誘導率和鮮重比對照顯著增加,但是外植體傷口處出現黃化,最后部分葉片發生褐化凋亡。當SNP濃度為80μmol/L時,愈傷的誘導率和鮮重均受到了嚴重的抑制(表1),外植體的黃化現象更為明顯。試驗表明,適宜濃度的SNP可促進紅掌葉片胚性愈傷組織的形成,高濃度的SNP處理則抑制愈傷組織的發生。

圖1 SNP對紅掌葉片愈傷誘導的影響Fig.1 Effects of SNP on callus induction of A.andraeanum leaf
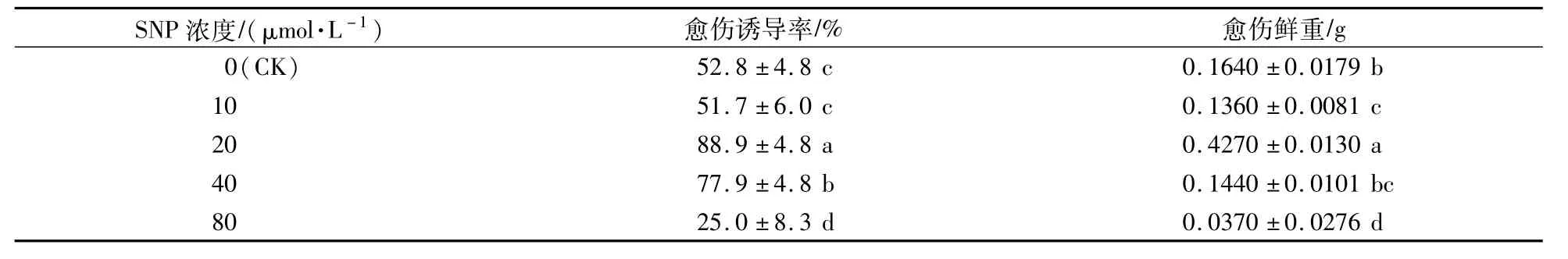
表1 SNP對紅掌葉片愈傷誘導率和鮮重的影響Table 1 Effects of SNP on callus induction rate and fresh weight of A.andraeanum leaf
2.2 不同濃度SNP處理對不定芽分化的影響
將愈傷組織從葉片傷口處切下,轉接于不定芽分化培養基上,并置于光照下培養。愈傷組織由白色逐漸轉為綠色,紅色芽點從愈傷的表面產生,不定芽逐漸伸長,展開葉片,在不定芽的基部伴有氣生根發生(圖2)。兩個月后,愈傷表面形成叢生芽。對愈傷的分化率統計后發現,添加20μmol/L SNP的培養基上,愈傷的分化率達到了100%,但與其他處理差異不顯著(表2)。對不定芽的誘導數量統計后發現,在添加40μmol/L SNP的培養基上,不定芽的誘導數量最多,而80μmol/L SNP處理則抑制了不定芽的發生(表2)。試驗表明,添加SNP不能有效提高紅掌愈傷的分化率,但可以增加不定芽的數量。
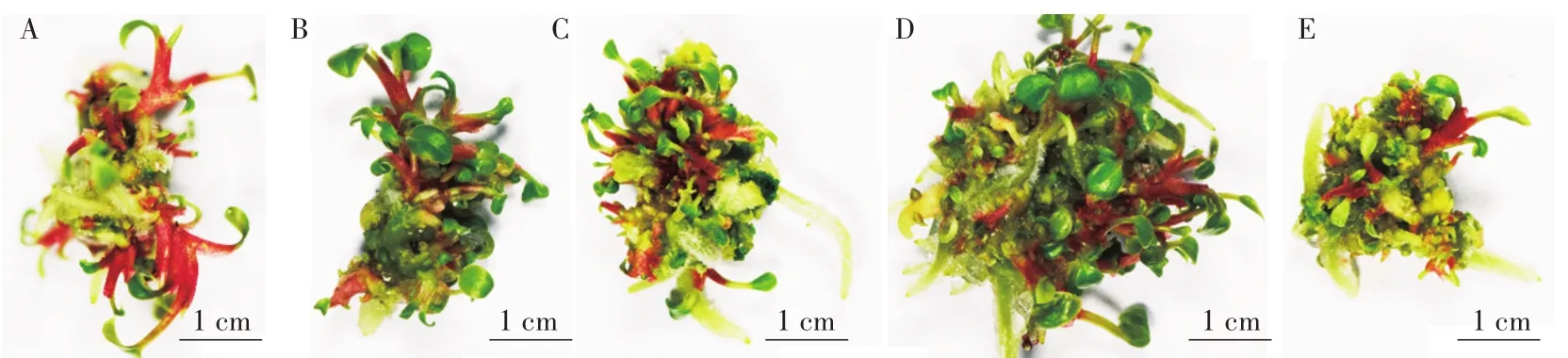
圖2 不同濃度SNP處理對紅掌愈傷不定芽分化的影響Fig.2 Effects of different SNP concentration on shoots differentiation of A.andraeanum
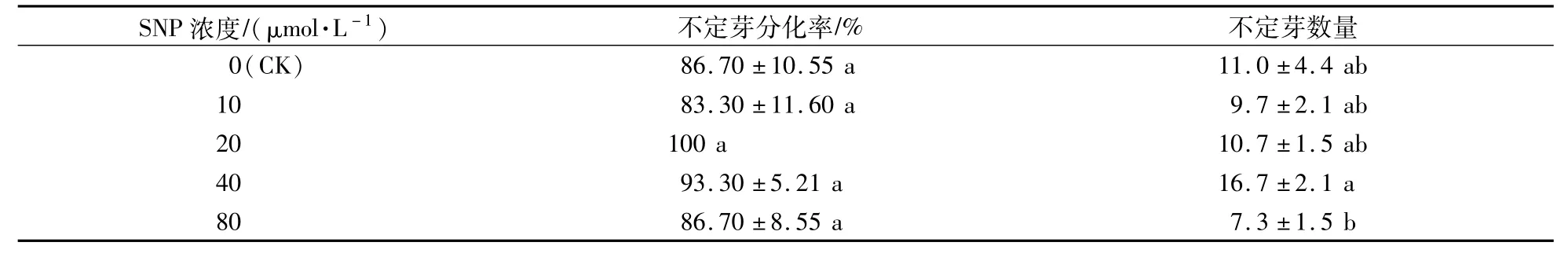
表2 SNP對不定芽分化率和不定芽數量的影響Table 2 Effects of SNP on differentiation rate and number of shoots
2.3 不同濃度SNP處理對植株生根的影響
將不定芽從愈傷組織上切下,然后轉接到生根培養基上,植株基部產生根源基并伸長形成不定根,植株生長良好(圖3)。一個月后統計植株的生根情況,添加不同濃度的SNP均能提高紅掌植株的不定根數量,在添加20μmol/L SNP的生根培養基上,不定根的數量最多,且與對照差異顯著。添加不同濃度的SNP對根長均沒有顯著影響(表3)。試驗表明,SNP處理可以提高不定根的發生數量,但對不定根的長度無顯著影響。

圖3 不同濃度SNP處理對植株生根的影響Fig.3 Effects of different SNP concentration on Anthurium andraeanum rooting
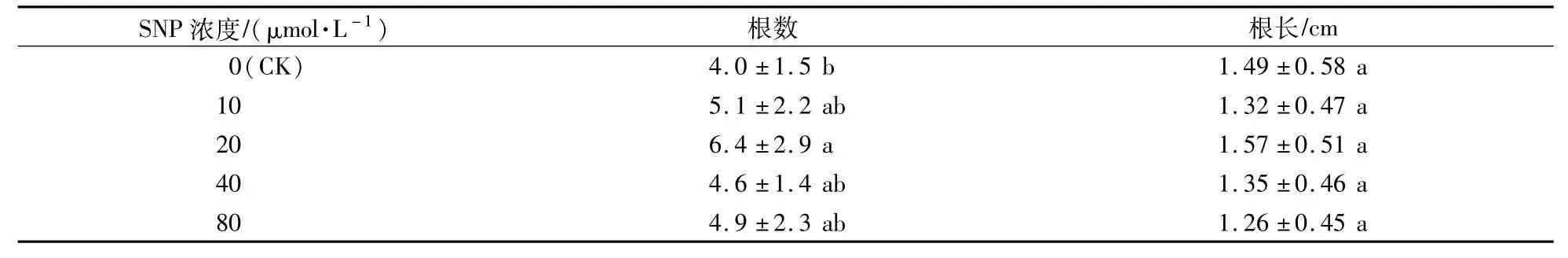
表3 SNP對植株生根數量和根長的影響Table 3 Effects of SNP on number and length of roots
3 討論
在紅掌愈傷誘導培養基中添加20μmol/L和40μmol/L的SNP均能顯著提高葉片的愈傷發生頻率,且添加20μmol/L的SNP使愈傷的鮮重顯著高于對照;而在添加80μmol/L的SNP愈傷誘導培養基上,愈傷的發生頻率和鮮重均受到了明顯的抑制。Xu等[15]研究發現,SNP可以不同程度地促進山藥(Dioscorea opposita)愈傷組織的發生頻率,其中40μmol/L SNP處理的愈傷發生頻率最高。Sarropoulou等[16]研究發現,適宜濃度的SNP處理可以提高櫻桃葉片誘導的愈傷組織鮮重。Han等[17]研究發現,50μmol/L以上濃度的SNP可以抑制湖北海棠(Malus hupehensis)根誘導過程中愈傷組織的發生。因此,適宜濃度的SNP處理可以促進植物愈傷組織的發生。NO參與植物體細胞脫分化的調控過程[14],SNP促進植物愈傷組織發生的機制可能是通過提高外植體的NO含量,誘導胚性愈傷組織的發生。
本研究表明,在紅掌不定芽分化培養基中添加不同濃度的SNP,不定芽的分化頻率沒有得到顯著提高,但是添加40μmol/L SNP可使不定芽的數量顯著提高。在其他植物中的研究同樣表明SNP具有促進愈傷分化的作用。Han等[17]研究發現,30μmol/L SNP處理使湖北海棠不定芽的再生頻率和數量均顯著提高。Kalra等[18]研究發現,SNP可促進大葉合歡(Albizzia lebbeck)不定芽的再生數量,與本研究一致。推測SNP是通過增加愈傷中的擬分生組織個數[19]來提高不定芽的再生數量。
本研究表明,添加不同濃度的SNP可以提高紅掌不定根的發生數量,但對根長的影響不顯著。50μmol/L SNP處理使櫻桃組培苗[16]的生根數得到提高,且不同基因型間差異顯著。25μmol/L SNP處理對白菜側根的長度沒有影響,但顯著提高了側根的數量[20],這與本研究結果相似。SNP促進植物生根的機制可能是通過提高植株基部細胞內的NO濃度,誘導植物內源生長素IAA的合成,并促進根源基的發生。

