農田土壤N2O排放的關鍵過程及影響因素
曹文超,宋 賀,王婭靜,覃 偉,郭景恒,陳 清,王敬國*
(1 中國農業大學資源與環境學院,北京 100193;2 中國熱帶農業科學院環境與植物保護研究所,海南海口 571101;3 安徽農業大學農學院,安徽合肥 230036;4 河北農業大學資源與環境科學學院,河北保定 071001)
一氧化二氮 (N2O,俗稱氧化亞氮) 作為重要的溫室氣體之一,其全球增溫潛勢為CO2的190~270倍,且濃度以每年0.25%的速率持續增加,加劇了全球氣候變暖[1]。同時,N2O也是破壞臭氧層的主要因子[2]。因而,N2O的排放在全球氣候和生態環境變化的研究中受到廣泛關注。
農業活動是N2O最大的人為排放源,其中農田土壤對N2O排放貢獻最大[3-5]。農田土壤每年N2O排放約占全球人為活動N2O排放總量 (6.7 × 106t) 的42%[6]。以我國農田土壤為例,2014年N2O排放量約為1.21 Tg,占全球N2O排放量的31%[7]。一般認為農田土壤N2O產生的主要途徑為硝化和反硝化作用過程[8],同時,環境因子 (土壤pH、溫度等) 和管理措施 (施肥、灌水等) 主要通過影響這兩個過程進而影響N2O排放。然而,綜合土壤N2O排放的其他過程并結合相關環境因子的分析仍缺乏系統性研究。因此,探究農田土壤各調控機制和環境因子對N2O排放的影響,有利于理解農田土壤氮素轉化過程與N2O排放之間的關系,從而為進一步提出合理的N2O減排措施提供理論依據。
1 農田土壤產生N2O的過程
農田土壤產生N2O的生物學過程包括硝化作用、反硝化作用、硝化細菌的反硝化作用、硝酸異化還原成銨以及真菌反硝化作用等。通常認為反硝化和硝化作用是產生N2O的主導途徑。近年來在土壤低氧環境條件下硝化細菌的反硝化作用對N2O排放的貢獻受到重視。此外,硝化-反硝化耦合作用和真菌反硝化作用對N2O排放也有貢獻。而且,化學反硝化、亞硝基化反應 (nitrosation) 等非生物學過程也是土壤N2O的產生途徑 (圖1)。因此,全面了解與N2O排放有關的土壤過程,有助于實現農田土壤N2O減排。
1.1 硝化作用
硝化作用 (nitrification) 通常有兩個過程:氨氧化過程和亞硝酸氧化過程 (圖1A)。氨氧化過程是自養的氨氧化細菌 (ammonia-oxidizing bacteria,AOB) 或氨氧化古菌 (ammonia-oxidizing archaea,AOA) 在氨單加氧酶 (AMO) 催化下將NH3催化氧化為羥胺(NH2OH),并進一步在羥胺氧化還原酶 (HAO) 催化下產生NO2-,該過程是硝化作用發生的限速步驟[9]。亞硝酸氧化是指NO2-在亞硝酸氧化菌 (nitrite oxidation bacteria,NOB) 作用下氧化為NO3-的過程。最近研究發現了完全氨氧化菌 (如Nitrospira) 的存在,這類細菌能夠將銨態氮直接氧化為硝態氮,稱為完全硝化過程 (complete ammonia oxidizers,comammox)[10-11],這一發現顛覆了硝化過程必須經過兩步反應過程的經典認知。除自養硝化作用外,異養硝化作用是指異養微生物將有機態氮氧化為亞硝態氮或硝態氮的過程,其中參與該活動的微生物有細菌、真菌等[12-13]。
N2O不是硝化過程的中間產物,其產生與中間產物NH2OH和NO2-緊密相關。硝化作用對N2O排放的直接貢獻較低,大多低于NH4+-N氧化總量的1%[14]。純培養發現,不同亞硝化螺菌氨氧化過程產生的N2O與其累積的NO2-比例為 0.07%~0.1%[15]。M?rkved等通過泥漿培養試驗發現,土壤硝化作用產生的N2O與硝化終產物NO3-的比值也僅為0.02%~0.09%[16]。硝化過程對土壤N2O排放的貢獻,或許主要體現在其為包括經典生物反硝化過程、硝化細菌的反硝化過程,甚至非生物的N2O產生過程等提供NO3-和NO2-等底物上,其中氨氧化過程產生的終產物NO2-尤為重要。
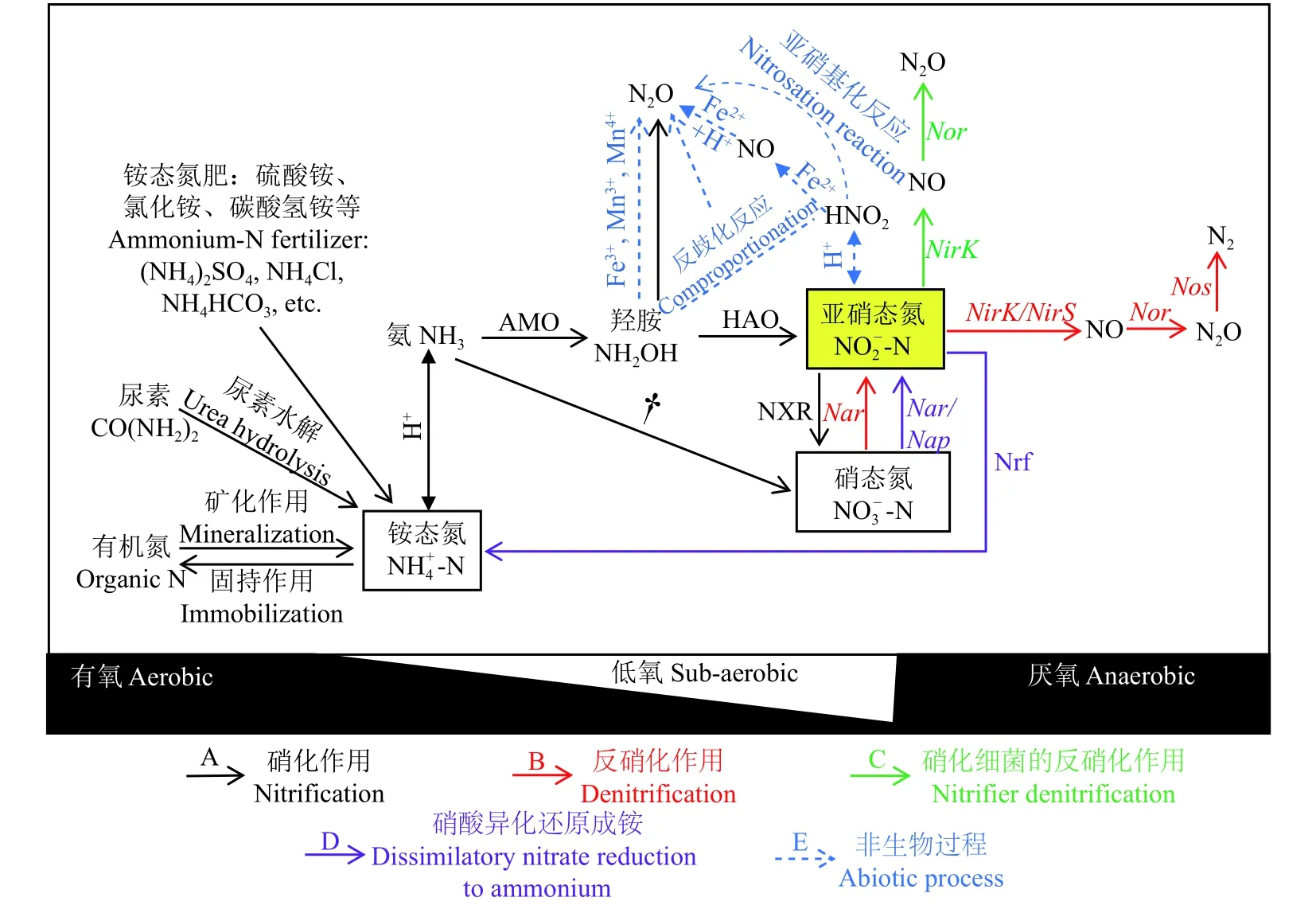
圖1 N2O排放的主要生物學和非生物學過程Fig. 1 Biotic and abiotic processes of nitrous oxide (N2O) emission from soils[注(Note):AMO—氨單加氧酶Ammonia monooxygenase;HAO—羥胺氧化還原酶Hydroxylamine oxidoreductase;NXR—亞硝酸氧化還原酶Nitrite oxidoreductase;Nar/Nap—硝酸異化還原酶Membrane-bound nitrate reductase/periplasmic nitrate reductase;Nrf—亞硝酸還原酶Cytochrome c nitrite reductase;NirK—含銅的亞硝酸異化還原酶Copper-containing nitrite reductase;NirS—含有細胞色素cd1的亞硝酸異化還原酶Cytochrome cd1 nitrite reductase;Nor—NO還原酶Nitric oxide reductase;Nos—N2O還原酶Nitrous oxide reductase;? 該過程 (一步硝化反應) 由Nitrospira細菌作用? This process (one-step nitrification) attributed only to the Nitrospira bacteria[10-11];A、B、C、D、E分別代表硝化、反硝化、硝化細菌反硝化、硝酸異化還原成銨及非生物學過程 A,B,C,D,E represent nitrification,denitrification,nitrifier deitrification,dissimilatory nitrate reduction to ammonium and abiotic processes,respectively.]
進一步對比自養硝化和異養硝化作用對N2O排放的相對貢獻來看,一般認為異養硝化作用對N2O的貢獻較少,但在某些土壤環境條件下不容忽視[17]。如,在酸性森林土壤中異養硝化作用是產生N2O的主要途徑[18-23],其貢獻主要受土壤pH和C/N影響[20]。此外,目前還暫未有證據顯示,完全硝化過程 (comammox) 具有產生N2O的能力,但由于其生物化學過程是經典氨氧化細菌和亞硝酸氧化細菌相關過程的結合,其存在具有產生N2O的可能性[21]。
1.2 反硝化作用
反硝化作用 (denitrification) 通常是指生物反硝化,即反硝化微生物在厭氧條件下將NO3-或NO2-逐漸還原為NO、N2O和N2的過程 (圖1B)[22]。該過程所需的酶包括異化硝酸鹽還原酶 (Nar & Nap)、異化亞硝酸鹽還原酶 (Nir)、一氧化氮還原酶 (Nor) 以及一氧化二氮還原酶 (Nos),相應的編碼基因分別為narG和napA、nirK/S、norB以及nosZ。其中,NO2-還原為NO的過程被認為是反硝化作用中最關鍵的步驟[23]。亞硝酸鹽還原酶 (Nir) 是產生NO的關鍵酶,包含由nirS基因編碼的細胞色素還原酶 (cd1-Nir) 和由nirK基因編碼的可溶性含銅酶 (Cu-Nir)[24]。反硝化微生物通常只含有其中的一種,已分離的反硝化細菌中含nirS的數量占3/4[25],而且在許多環境中以含有nirS基因的反硝化微生物占主導[25]。
通常反硝化作用是土壤產生N2O的主要來源。有研究表明,反硝化作用對N2O排放的貢獻在農田、茶園和竹園土壤中分別為54.5%、72.8%和77.1%[20]。完全的反硝化作用終產物為分子態氮(N2),然而約有1/3數量的反硝化細菌缺少編碼N2O還原酶 (N2OR) 的nosZ基因,導致其終產物為N2O[26]。同時,低土壤pH或高NO3-含量會抑制N2O還原酶的形成[27]。此外,在土壤碳有效性較低條件下,與其他異化還原酶相比,N2O還原酶競爭電子的能力較弱,因而也會造成N2O排放量增加[28]。
1.3 硝化細菌反硝化
硝化細菌的反硝化作用 (nitrifier denitrification,ND) 是氨氧化微生物直接利用其在氨氧化過程產生的亞硝酸鹽 (NO2-) 作為電子受體,進行反硝化的過程。通常多發生在好氧或低氧條件下,進行該反應的微生物通常為氨氧化細菌 (AOB)[29],還未發現氨氧化古菌 (AOA) 具有這種還原能力[30]。此外,由于AOB缺乏N2OR編碼基因,因而其終產物絕大部分是N2O,而非N2[31]。硝化細菌反硝化作用對土壤N2O排放可能占有較高比重[32-33]。Zhu等利用雙同位素標記法證實在低氧濃度條件下,施用銨態氮肥后硝化細菌反硝化作用是土壤N2O排放的主要來源[34]。Huang等研究發現,集約化石灰性低碳旱作土壤中硝化細菌的反硝化作用占N2O排放總量的44%~58%[35]。但也有研究對此持懷疑態度[36],主要是由于定量硝化細菌反硝化的雙同位素方法是基于氨氧化過程產生的NO2-只能被自養AOB還原的假設。然而,事實上許多異養反硝化菌也能夠直接異化還原NO2-,從而導致高估了硝化細菌反硝化作用對N2O排放的貢獻量。
1.4 硝化-反硝化耦合作用
一般認為,硝化和反硝化作用分別發生在有氧和厭氧條件下,即兩個過程在不同的生態位中進行。硝化-反硝化耦合作用 (nitrification-coupled denitrification,NCD) 的實質是同時存在于兩個相鄰微域空間的硝化和反硝化過程的偶聯;發生在有氧空間、由硝化過程產生的NO2-或NO3-作為底物直接被存在于厭氧或低氧空間的反硝化微生物所利用[12,37],從而導致在好氧-厭氧界面上N2O的排放。
硝化-反硝化耦合作用對污水中的氮素去除、沉積物及農田土壤的氮素轉化發揮著重要作用[37-38]。有氧條件的反硝化作用和沉積物內孔隙水的對流運輸可使這兩個過程在空間和時間上耦合更加緊密[39]。同時,研究已經證實,沉積物中添加15NH4+后,由反硝化作用產生的15N-N2幾乎與氨氧化過程和亞硝酸氧化過程同步,即硝化和反硝化過程在發生時間上重疊[41]。在某些情況下硝化-反硝化耦合作用能夠去除河口沉積物中10%~80%的人為氮素污染[40]。在土壤好氧微域環境中,如土壤表面氧化層或根際,硝化產生的NO3-或NO2-進入土壤厭氧微域會進一步發生反硝化作用。已有研究表明,在稻田土壤存在硝化-反硝化耦合作用,且硝化-反硝化耦合作用產生的氮損失很可能受硝化速率調控[41]。同時Ma等[42]研究發現,在稻田土壤250%和100%WHC條件下硝化-反硝化耦合作用對N2O排放總量的貢獻比例分別為6.74%和11.5%。
1.5 真菌反硝化
真菌反硝化作用 (fungal denitrification) 主要是以NO2-作為底物在各種酶參與下還原為N2O的過程[43],其中某些真菌 (如Fusarium oxysporum) 也能夠將NO3-還原為N2O。與細菌反硝化過程不同,由于真菌在線粒體膜上缺少N2OR,故不能將N2O進一步還原為N2[45]。進行反硝化作用的細菌和真菌均能利用NirK編碼的亞硝酸鹽還原酶將NO2-還原為NO[22,44]。與細菌不同的是,真菌主要是在NO還原酶細胞色素P450nor的作用下,以煙酰胺腺嘌呤二核苷(NADH,一種輔酶) 作為電子供體將NO還原為N2O[45],這種NO還原酶在結構和功能上與細菌NO還原酶有較大差別[46]。
一般認為,土壤N2O的產生以細菌主導的反硝化作用過程為主[47]。近年來,越來越多的證據顯示,真菌在不同生態系統中對土壤N2O的排放均有貢獻[48-52],尤其在酸性土壤條件下更明顯[53-54,61],如真菌反硝化作用在低pH茶園土壤中對N2O排放的貢獻高達70%[55]。這主要與真菌群落在低pH條件下占主導,而細菌對酸性土壤環境條件較為敏感有關[56]。相反,真菌反硝化作用在堿性土壤中對N2O的貢獻并不重要[57]。在沙漠和半干旱的草地土壤中真菌也是N2O產生的主要來源[52],同時,在極端高溫條件(40℃) 出現時,酸性土壤施用有機肥后可能也會增加真菌反硝化作用對N2O排放的貢獻[58]。Wei等發現農田土壤田間表層施用顆粒性有機肥后N2O排放主要來源于真菌的反硝化作用[52]。
1.6 硝酸異化還原成銨
硝酸異化還原成銨 (dissimilatory nitrate reduction to ammonium,DNRA) 是硝酸異化還原的過程之一。與反硝化作用類似,DNRA過程是以NO3-或NO2-作為電子受體并在厭氧條件下將其還原為NH4+的過程 (圖1D)。土壤pH、碳源含量、底物濃度(NO3-和NO2-)、C/N等是影響DNRA和反硝化作用這兩個氮異化還原過程競爭的重要環境因素[59]。一般認為,DNRA更易在pH較高的條件下發生。如Yoon等已證實在酸性條件下Shewanella loihica PV-4菌株主要產物為N2O,而在堿性土壤中為NH4+[60]。同時,在NO3-或NO2-底物濃度較高或電子受體充足、碳源含量相對較低的環境中,由于DNRA過程發生所需的自由能比反硝化作用過程自由能高,因此該條件下反硝化作用更易發生[61]。相反,在電子受體 (NO3-/NO2-) 不足而碳源含量充裕時,DNRA過程則占主導[61]。
通常,DNRA過程在海洋生態系統的氮素循環中發揮重要作用,而陸地生態系統其多發生在濕地、草地等自然土壤中[62],其對N2O排放的貢獻較低,甚至可以忽略。如Kool等通過15N-NH4+和15NNO3-標記試驗表明,在沙壤土中DNRA過程對N2O的貢獻可以忽略[63]。然而,也有研究發現具有DNRA功能的細菌中含有非典型N2OR,可將N2O進一步還原,這對N2O消耗具有潛在貢獻[64]。
1.7 非生物學過程
除生物學過程外,近年來非生物學過程對N2O排放的貢獻再次受到關注[65-68]。非生物學產生N2O的過程又稱為化學反硝化作用 (chemodenitrification)[69],包括NO2-的分解、NO2-和NH2OH與金屬離子等作用發生的電子轉移過程[70]以及光化學反應等[71-72]。非生物學過程的發生主要與硝化、反硝化過程釋放的不穩定中間產物NH2OH和NO2-有關 (圖 1E)。它們可與金屬離子 (如Fe2+或Mn3+) 或有機質發生非生物的化學反應產生N2O、NO,甚至N2[70]。其中,NO2-與有機物質的反應,被稱為亞硝基化作用 (nitrosation)。一般而言,NH2OH很少在土壤中出現累積,這與NH2OH具有很高的活性且其氧化的發生與土壤pH、Mn和土壤有機質 (SOM) 的含量有關[73]。如Heil等研究發現,盡管土壤中Mn的含量較低,但NH2OH會優先與Mn3+或Mn4+進行化學反應,而非Fe3+,這主要是因為Fe3+常以不溶性的形態存在,導致其不易與NH2OH接觸進行反應[73]。NO2-既可來源于硝化過程也可能來源于反硝化過程。在高土壤pH條件下施用銨態氮肥后易導致NO2-累積[74],而 NO2-可與Fe2+發生反應生成NO和N2O。此外,土壤NO2-也可與SOM發生亞硝基化反應 (圖1E),且N2O產生量與SOM含量呈正相關[75]。
通常認為非生物學過程對N2O排放的貢獻較少,如在21%和0%氧濃度下,粘壤土化學反硝化對N2O的貢獻分別為6.33%和0.08%;同時,Ma等[42]發現添加NO2-后,滅菌土壤N2O排放占非滅菌土壤N2O排放比例少于1.1%。也有研究發現,添加NO2-后非生物因素對總N2O排放量的貢獻較高,達31%~75%[80],這可能與土壤pH有關。
2 主要環境因子對N2O排放的影響
2.1 氮源
農田土壤施入的化肥氮約有70%以上是以銨態氮或酰胺態氮肥的形式進入土壤[76]。土壤氨氧化過程有中間產物NH2OH和NO2-的產生。這兩種中間產物易于分解,因而在田間條件下的土壤中很難被監測到。特別是NH2OH,由于其極具活性,可經氧化作用產生NO2
-,發生化學作用產生N2O,也可與土壤有機質 (SOM) 發生反應。NO2-在土壤中也不穩定,同時由于土壤樣品儲運和處理過程較長等原因,也不易觀察到其累積。但在實驗室培養條件下,常常會發現NO2-的過渡性積累,且與N2O排放呈極顯著正相關關系[77-80],這表明亞硝態氮作為產生N2O過程底物的重要性。
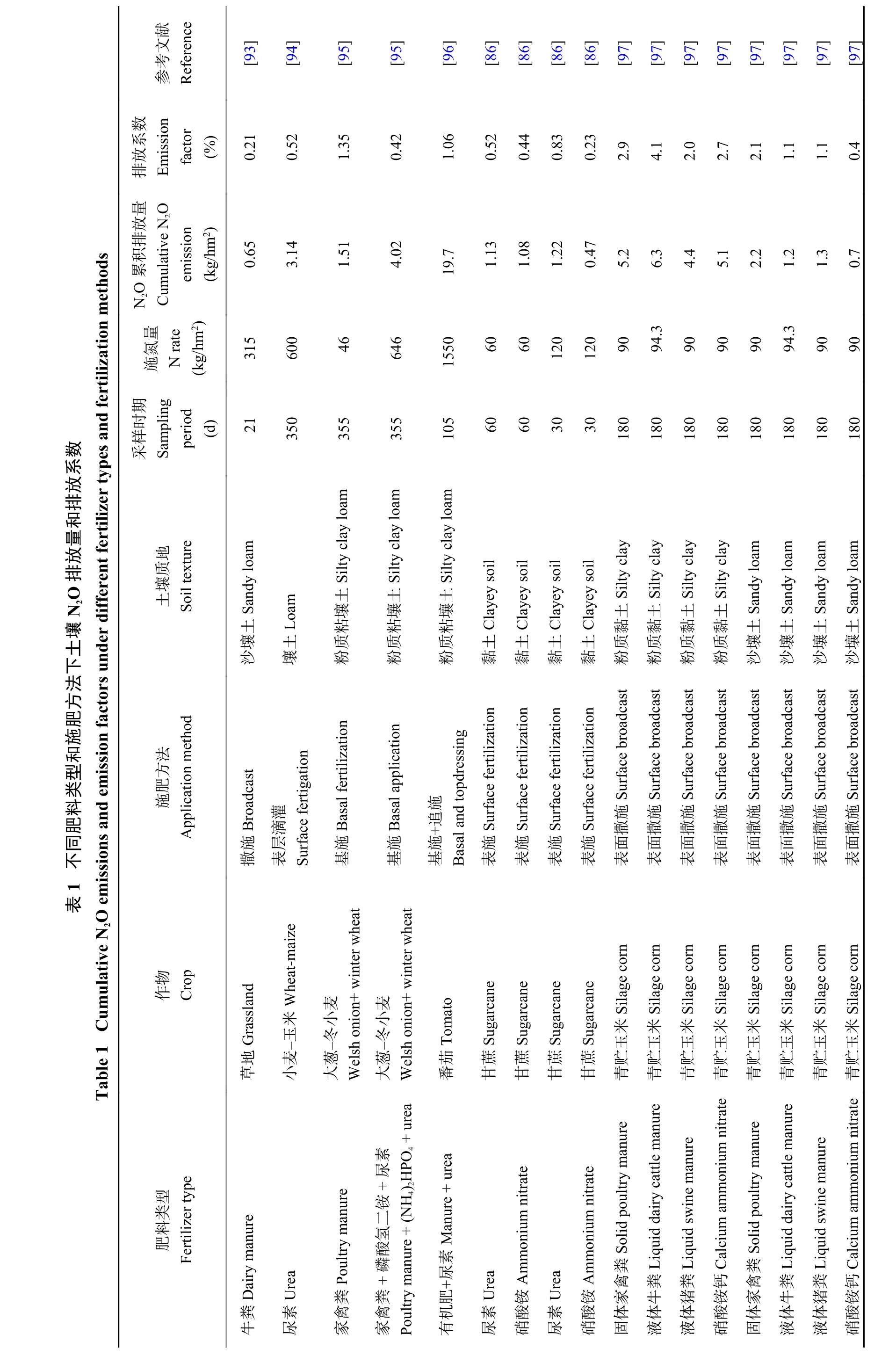
早期研究表明,施用化學氮肥能夠增加農田土壤N2O的排放[81]。Shcherbak等[82]通過元分析發現,N2O排放隨施氮量的增加呈指數而非線性增長。近年來研究發現,在覆膜水稻[83]和常規淹水水稻種植體系[84]土壤中,通過尿素氮深施可顯著降低N2O排放。這可能由于深施后的尿素氮在土壤還原環境條件下多以銨態氮形式保存,且不易移動,降低了硝化和反硝化反應所需底物。對比不同肥料類型來看,通過田間試驗大樣本分析和模型顯示,施用尿素產生的N2O排放量較硫酸銨高[85-86],這在室內培養試驗中也得到類似結論[35]。同時,施用高效氮肥如包膜氮肥可顯著降低土壤N2O排放[87]。Liu等[88]證實施用控釋尿素土壤N2O排放系數顯著低于尿素、硫酸銨和硝酸銨鈣。Xia等[89]通過大樣本分析發現施用控釋氮肥可整體減少N2O排放達38.3%。與尿素[90]和硫酸銨[91]處理相比,土壤施用家禽糞肥可明顯增加N2O排放量。大樣本分析顯示,與僅施用化學氮肥相比,有機肥增加N2O排放量平均高達32.7%[92]。有機肥與化肥混施 (表1) 或有機肥部分替代化肥[88]能夠緩解土壤N2O排放。
?
許多研究顯示,在我國北方石灰性土壤中硝化作用過程是產生N2O的主導途徑[98-101],并推測這可能與該土壤低的有效性碳含量有關[101]。然而,在pH較高的情況下,化學氮肥施入土壤后由硝化作用導致的亞硝態氮過渡性積累,從而為硝化細菌的反硝化和反硝化過程進行提供底物,或許更為重要。在高銨態氮投入的中性土壤中,氨氧化細菌 (AOB)主導控制著硝化作用的活性[102],而氨氧化古菌(AOA) 通常在低NH3濃度的酸性土壤中發揮顯著作用[103],這主要是由于AOA和AOB對底物 (NH3和O2) 的親和性 (Km) 存在較大差異有關[104]。Hink等利用1-辛炔 (C8H14) 區分AOA和AOB對N2O產生量的相對貢獻證實[105],添加銨態氮后AOB對土壤N2O總產生量起主導作用 (貢獻比例為81%~86%),而未添加銨態氮的土壤中,AOA對N2O的貢獻率為47%~58%,AOB對N2O的貢獻可以忽略。因此,在施入或添加外源銨態氮造成NH3濃度較高時,AOB主導了硝化作用的進行,而當NH3主要來源于土壤的礦化作用時AOA是硝化作用過程進行的主要執行者。同時,長期向土壤中添加不同形態的氮素也會顯著影響硝化微生物基因豐度。Zhou等[106]在連續進行44年施肥試驗的草地土壤中發現,添加有機氮顯著增加了AOA的amoA基因拷貝數,而AOB的amoA基因拷貝數在添加無機氮的處理中出現增加,且AOA/AOB比值隨有機氮添加量的增加而增大。Ai等[107]在農田土壤中也發現,長期施用氮肥(尿素) 能顯著增加土壤硝化潛勢和AOB的種群豐度,而施用有機肥增加了AOA的種群豐度。這可能與AOA優先氧化有機氮 (來源于有機肥或土壤有機質) 礦化出來的氨有關,特別是在氨氧化速率超過礦化速率時,AOA對氨具有很高的親和性[108]。而對于反硝化作用過程來說,增加土壤中NO3-通常會造成N2O/N2比值升高[109],這主要是由于NO3-作為末端電子受體 (terminal electron acceptor,TEA) 會被優先利用,且高NO3-含量也會抑制N2O還原酶活性[110]。
2.2 碳源
土壤碳源含量主要受耕作、有機肥投入、根系分泌物和作物殘渣投入 (如秸稈) 等因素影響。Badagliacca等[111]研究發現,免耕措施下N2O排放顯著高于傳統耕作,這可能與免耕增加土壤有效性碳含量有關[112]。有機肥的施用顯著增加土壤反硝化潛勢。這主要是因為田間施用有機肥或其他有機物料后顯著增加了土壤異養微生物的呼吸,同時有機物料中有效性碳為反硝化微生物提供了電子供體,促進了反硝化作用的發生。在植物根系根區內可通過根際沉積作用向根際土壤分泌一些低分子量碳的化合物,如糖類、有機酸和氨基酸等[113]。這些低分子量有機物極易分解,結合土壤根系的呼吸作用,造成根際土壤N2O產生量高于非根際土壤[114-115]。Giles等[116]對不同低分子量有機物研究發現,葡萄糖、谷氨酰胺和檸檬酸均顯著增加N2的釋放,且檸檬酸與葡萄糖和谷氨酰胺相比顯著降低了N2O的排放。
目前,秸稈還田被認為是增加土壤肥力、提高土壤健康的農田管理措施之一。秸稈施入后主要通過影響土壤碳、氮有效性及土壤通氣性進而間接影響N2O排放。Kravchenko等[117]研究發現,多數情況下秸稈施入可提高土壤N2O排放,并抵消土壤碳儲存的氣候效益。如在設施菜田土壤中,田間施用玉米秸稈能夠顯著增加N2O通量排放[118];在小麥-玉米輪作的糧田種植體系,小麥秸稈施用后可顯著增加玉米季N2O排放量[119]。秸稈還田在不同農田土壤土地利用方式下對N2O排放的影響也不一致。Shan等發現秸稈還田在休耕地、旱地土壤中顯著增加N2O排放,而在稻田中N2O排放顯著降低[120]。與施用有機肥相比,通過秸稈深施可顯著降低小麥季土壤N2O排放量[121]。Li等[122]通過15N示蹤技術直接證明了作物秸稈施用后在不同水分條件下反硝化過程是土壤N2O排放的主導途徑。然而,作物秸稈施用后并未發現土壤的反硝化微生物數量出現明顯增加。Philippot等[123]研究發現,短期添加小麥秸稈對土壤反硝化菌基因豐度影響有限。同時,短期添加小麥、油菜和苜蓿秸稈也沒有改變反硝化菌的數量,其反硝化作用與反硝化菌群落豐度呈解耦關系,與呼吸作用顯著相關[124]。作物秸稈碳氮比是影響氮素釋放的重要因子,可調控土壤氮素的固定和釋放[125]。一般認為,高碳氮比植物殘體施入土壤后可增加氮素固持進而有利于土壤肥力的提高,而低碳氮比植物殘體會增加N2O的排放[120,126]。Chen等[14]利用大樣本分析發現,作物秸稈碳氮比 < 45時對土壤N2O排放有顯著正效應,而在碳氮比 > 100時略有負效應。同時,作物秸稈對土壤N2O排放的影響與土壤理化性質,特別是土壤水分和質地緊密相關。如,在低碳氮比土壤中施入動物有機肥可導致N2O排放量增加[127],而在高土壤碳氮比下,氮素氣態損失主要以N2為主[128]。類似地,增加土壤有效性碳與硝態氮的比例可促進N2O還原為N2[129]。此外,大多數研究已證實,土壤施用生物炭能夠顯著減少N2O的排放[130-131],這主要與生物炭和土壤性質以及它們的交互效應有關。生物炭可通過改變土壤物理 (氣體擴散、團聚體、保水性等)、化學 (pH、Eh、有效性有機和礦質態氮、溶解性有機碳等) 以及生物學性質(微生物種群結構、微生物量及活性、與氮循環相關酶活性等) 影響N2O的排放[132]。如生物炭通常具有高C/N比,并含有小分子量有機化合物,其多孔的結構適宜微生物生長并利于土壤氮素的固定,進而減少氮素有效性,降低土壤N2O的排放。同時,具有堿性特性的生物炭可用來改良酸性土壤,提高土壤pH。相關研究也已證實,生物炭可增加土壤微生物nosZ基因豐度,進而促進N2O的還原[133-134]。
2.3 水分含量
土壤水分是環境驅動力中最重要的因素之一[8]。水分影響土壤微生物細胞代謝活性和養分的運輸[135],對硝化和反硝化作用過程具有決定性影響[136]。在土壤水分飽和區或淹水條件下,高土壤水分含量阻礙氣體擴散,使土壤形成嫌氣環境,增加土壤反硝化潛勢和速率。同時,在該條件下,硝化作用進行得較為緩慢,參與反應的硝化微生物在植物根系周圍的氧化區域具有較高活性[137]。在土壤水分非飽和區,其易于硝化作用的進行,該水分條件下反硝化作用主要發生在土壤團聚體和土壤微域環境中[138]。以土壤孔隙含水量 (WFPS) 作為判定N2O主要來源的指標已有大量研究。一般認為,硝化作用在30%~60% WFPS下是產生N2O的主要來源,而在土壤水分含量高于70%時N2O主要源于反硝化過程[138]。然而,在以硝化過程為主導的土壤環境中,N2O的排放總量遠低于以反硝化過程主導的土壤環境[34]。土壤灌水后N2O含量迅速增加主要是反硝化作用的結果[139]。農田土壤玉米播種灌水后WFPS由20%迅速增加至80%,其產生的N2O劇烈排放可能主要來源于反硝化作用過程[140]。設施菜田土壤N2O排放主要集中在基施有機肥并灌水后的1周內,N2O排放也主要受反硝化作用影響[119]。此外,施用有機肥并灌水顯著增加了分子態氮 (N2) 的損失[141]。
水分含量影響土壤硝化和反硝化微生物的活性。Uchida等[142]發現在土壤淹水后的幾小時內(3 h),反硝化基因 (nirK,nirS,nosZ) 在mRNA水平0—1 cm土層土壤中顯著增加并達到峰值,也就是說當水分含量造成土壤氧氣濃度發生改變時,反硝化細菌會迅速做出反應以適應新的環境條件,表明降雨或灌溉后導致N2O排放峰的出現與反硝化過程有關。與此類似的是,Riya等[143]研究表明,在土壤淹水消失前48 h添加NH4+后,amoA的mRNA拷貝數在5—10 mm土層土壤中雖有增加,但不顯著,而nirK的mRNA轉錄水平在淹水消失6 h后急劇增加。然而,與上述觀點不同的是,Theodorakopoulos等[144]發現,隨著土壤WFPS上升,并未發現在0—10 cm土層土壤中反硝化基因轉錄數 (mRNA) 增加,而顯著增加了細菌amoA的轉錄數,且其與N2O排放呈極顯著正相關,這可能與土壤中低氧氣含量和銨態氮有效性增加有關。
2.4 氧氣
土壤氧氣含量是驅動生物地球化學循環的關鍵因素之一,也是影響硝化作用和反硝化作用對N2O排放相對貢獻的決定因子之一[145]。在自然生態系統中,空氣對流和氣體擴散影響土壤中的氧氣含量;同時,異養微生物呼吸作用或微生物耗氧分解以及硝化作用的發生也會減少土壤氧氣濃度[146]。Groffman等[147]認為土壤“熱點”(hot spots) 的形成主要是因為水分含量的提高和有機肥施用后增加了土壤有效性碳氮的富集,進而影響了氧氣濃度在土壤中分布。在氧氣受限而有效性碳充裕的土壤環境下,其“熱點”區域N2O的排放以反硝化作用為主導途徑。氧氣濃度在土壤中的非均質性分布,也是導致N2O產生或排放出現差異性的重要原因[148]。
氧氣濃度影響硝化、反硝化作用對N2O排放的貢獻。Khakil等研究發現,在低氧濃度下 (0.35 kPa)反硝化作用是產生N2O排放的主導途徑。隨土壤厭氧環境的形成,硝化作用對N2O排放的貢獻明顯下降[148]。Zhu等[34]研究發現,在低氧條件下氨氧化和硝化細菌的反硝化作用是產生N2O的主要來源。其中,在0.5%和3%(體積比) 氧濃度下,硝化細菌的反硝化作用對N2O排放的貢獻為34%~66%。這可能主要是由于在低氧條件下,氨氧化細菌 (AOB) 的群落組成發生改變,一些AOB物種能夠進行反硝化作用,如亞硝化單胞菌和類亞硝化單胞菌在低氧條件下豐富度增加,同時異養反硝化作用對N2O的貢獻量主要受氧氣和有效性碳含量的影響[149]。需要注意的是,部分硝化微生物在利用亞硝酸鹽而不是氧氣作為電子受體時,氧氣仍是氨氧化過程反應發生所不可缺少的條件[137]。
2.5 土壤 pH
土壤pH可直接通過影響生物[150]和非生物學過程調控N2O的排放。pH也能夠改變土壤底物有效性,如低pH會降低土壤礦質氮和有機碳的可利用性進而間接影響N2O排放[151]。大樣本分析證實,降低土壤pH會增加N2O排放[152]。Sun等[153]發現,在草原和森林土壤中N2O/N2比值隨土壤pH下降而升高。在我國農田土壤中,由于過量施用氮肥,土壤pH明顯下降[154],或將大幅度增加N2O排放。
硝化作用過程對土壤pH的響應可能較為敏感,這主要與pH影響NH3有效性 (AMO的底物) 有關[;pKa= 9.25,25℃][155]。每改變1個pH單位NH3濃度的變化將近10倍[156]。硝化速率通常隨土壤pH的增加而上升[157-158],其培養的硝化細菌最適pH范圍為7.5~8.0[157]。對于氨氧化微生物而言,增加土壤pH可以增加氨氧化古菌 (AOA)amoA基因豐度,而對氨氧化細菌 (AOB) amoA基因豐度沒有影響,甚至有些減少[159-160],但也有人認為土壤pH增加可以提高AOB的豐度,而對AOA沒有影響[161-162]。大量研究發現酸性土壤硝化作用的主要貢獻者為AOA[163-165],這與AOA在酸性條件下對NH3具有較高的親和力有關[166]。研究表明,pH與硝化細菌的反硝化過程產生的N2O呈正相關關系,而與反硝化作用產生的N2O呈負相關[167]。Cheng等[168]研究發現,好氧條件下,當土壤pH約低于4.4時反硝化作用主導N2O的產生,降低土壤pH能夠顯著增加反硝化作用對N2O的貢獻,這可能與真菌反硝化有關[169-171]。曹文超等[129]在菜田土壤中研究發現,增加土壤pH會提高土壤反硝化速率,并促進N2O還原為N2,這與Richardson等[81]發現的結果相一致,即在堿性環境下,反硝化主要產物為N2,N2O產生量較少。原因主要是低pH會干擾反硝化過程中N2O還原酶組裝 (nosZ基因的表達),降低酶的活性[27,172],導致反硝化作用N2O排放量增加和N2O/(N2O + N2) 比值增大。此外,土壤pH也會顯著影響非生物學過程對N2O的貢獻[66]。如羥胺 (NH2OH) 在pH低于5.95條件下以較游離NH2OH更穩定的質子化形態 (NH3OH+) 存在,導致其有效性降低,進而減少了N2O排放。
2.6 溫度
在全球氣候變暖的大背景下,溫度對N2O排放的影響十分重要。在高緯度地區,土壤溫度是影響N2O排放的主要因子。如在我國三江平原地區不同施氮處理條件下土壤溫度可解釋N2O排放16%~33%的變異[173]。溫度可直接和間接影響土壤N2O排放。直接調控主要表現在對土壤微生物生長和酶活性的影響,如降低土壤溫度能夠抑制土壤生物活性,進而減少N2O產生[174]。其間接調控主要是通過微生物活動改變土壤氧氣和有效性碳的含量[175-176]。此外,氧氣在土壤溶液中的溶解和釋放也受溫度的間接影響[177]。
溫度影響土壤微生物反應活性,進而影響N2O排放。對于氨氧化微生物而言,與20℃相比,AOB和AOA的生長在30℃和40℃下均受到抑制[59]。Maag和Vinther[174]發現提高土壤溫度可降低硝化作用對N2O的貢獻,而增加反硝化過程N2O的產生量。Davidson等[177]也發現,隨土壤溫度提高,反硝化作用產生的N2O排放量增加。這可能是因為升溫后增加了微生物的呼吸作用,造成土壤微域氧氣虧缺,為反硝化微生物活動創造了厭氧條件[178],同時升溫也增加了土壤反硝化活性[179]。許多研究表明,當土壤溫度在10~35℃時,每升高10℃,土壤反硝化的活性可提高1.5~3.0倍[180-181]。類似地,Saleh-Lakha等利用Pseudomonas mandelii進行液體培養發現,其在10~30℃范圍內反硝化作用活性隨溫度的上升而增加[182]。對于施用有機肥后的堿性土壤而言,提高土壤溫度顯著增加N2O排放,同時,與僅施用化學氮肥處理相比,有機肥施入增加了反硝化作用對N2O總排放量的貢獻。這可能與提高溫度后顯著增加了反硝化nirS基因豐度有關[183]。然而,在酸性土壤中研究發現,30℃時施用有機肥處理的nirK基因豐度顯著增加,而nirS在該溫度下迅速降低[59]。
2.7 其他因素
土壤N2O排放隨大氣CO2濃度的增加而增加[184-185]。這可能與增加土壤反硝化作用對N2O的貢獻有關。一方面,大氣CO2濃度升高后減少了植物地上部 (如葉片) 的蒸騰作用,進而使土壤含水量增加;另一方面,高CO2濃度促進了植物地下部有效性碳的分配,如增加根系分泌物的釋放等。二者均有益于反硝化作用的進行[184]。但也有研究認為N2O排放增加是由于硝化作用貢獻增加的結果[186]。此外,CO2濃度提高后,真菌的活動使草地土壤N2O排放潛勢增加了49%,同時,CO2濃度升高顯著增加真菌基因豐度和真菌與細菌拷貝數比例[187]。
土壤結構也是影響N2O排放的重要因素之一,其主要影響土壤通氣性和氣體擴散,進而影響N2O的產生[188-189]。在農田土壤中,機械化操作導致土壤壓實可造成土壤N2O排放量增加[190]。土壤動物活動也會影響N2O排放[191]。如大樣本分析表明土壤大型動物蚯蚓活動增加N2O排放量達42%[192]。Zhu等研究發現蚯蚓和彈尾蟲二者顯著增加土壤N2O排放量[193]。除蚯蚓外,在許多生態系統中,螞蟻生活所形成的蟻丘土壤是CO2排放的“熱點”區域[194-195]。近年已有研究表明,蟻丘土壤N2O產生量顯著高于相鄰自然土壤,這主要是由于螞蟻活動增加了土壤碳氮和粘粒的含量[196]。此外,不同蟻群種類形成的蟻丘土壤對N2O和CO2排放也有差異[177]。
3 農田土壤水肥管理對N2O排放的綜合影響
農田土壤N2O的產生和消耗本質上是土壤碳、氮、氧等因子綜合作用的結果,而田間水、碳、氮的管理措施是影響這些環境因子變化的主要因素 (圖2)。綜合田間土壤N2O通量監測結果,N2O峰值排放階段是其排放的關鍵,該時期N2O累積排放量約占全年農田排放量的50%左右[197-198]。
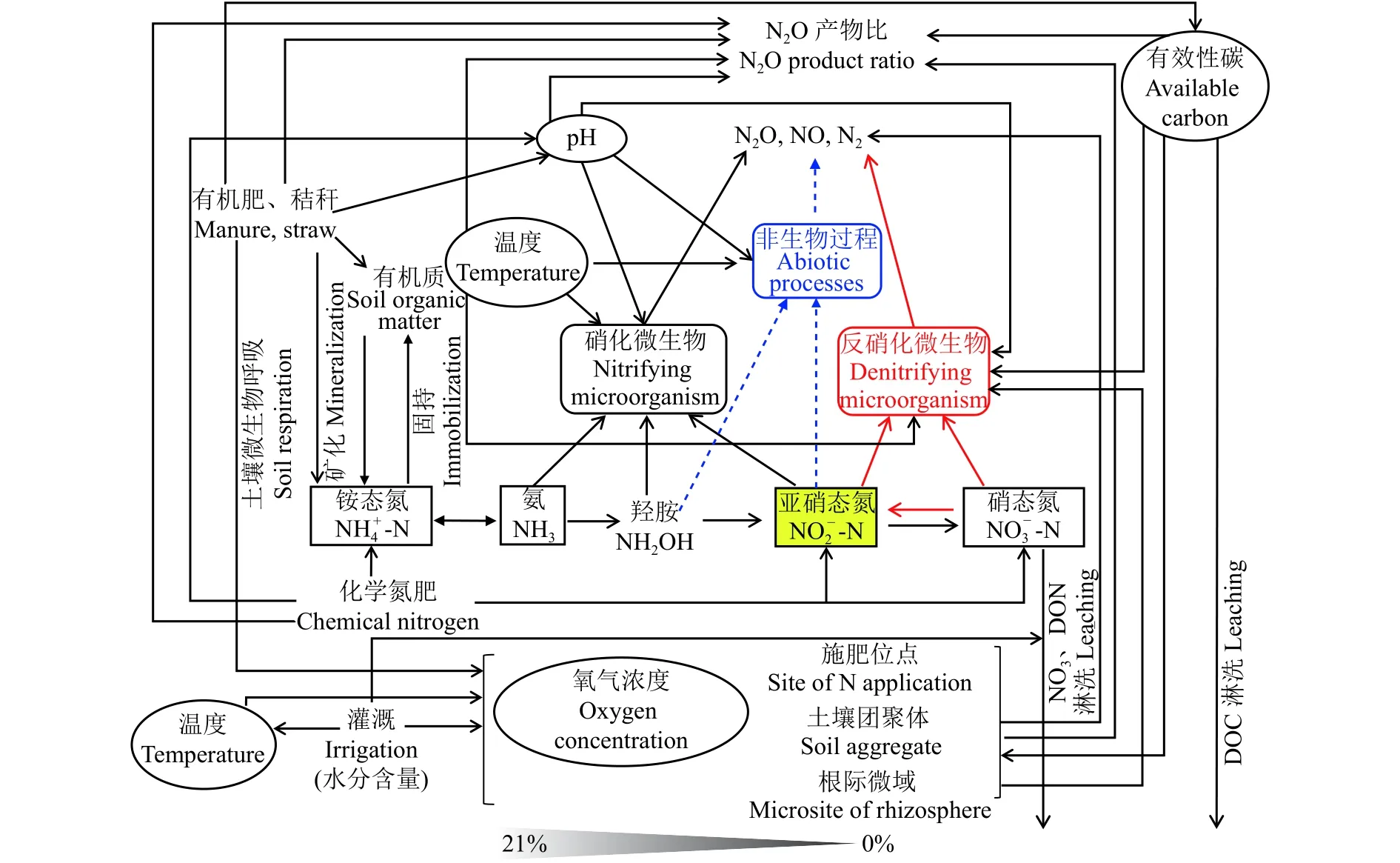
圖2 農田土壤主要調控因子對N2O排放綜合影響的概念圖Fig. 2 Conceptual diagram of comprehensive influences of main regulatory factors on N2O emissions in soils
在農田土壤水肥管理中,有機肥施入和灌水是造成N2O劇烈排放的主要誘因。以設施菜田土壤種植體系為例,有機肥極大地促進土壤中異養微生物的呼吸作用,顯著降低土壤孔隙中氧氣濃度;同時大量灌水降低了土壤相對氣體擴散系數 (RD),造成土壤出現低氧甚至厭氧的土體環境,尤其在土壤施肥位點、土壤團聚體及根際微域等區域中更易形成,這為反硝化微生物活動提供了厭氧條件。此外,土壤有機氮或有機肥礦化形成NH4+后,硝化作用對土壤氧氣的消耗也有貢獻 (NH3+ 2O2→NO3-+H2O + H+)。有機肥施入土壤后為反硝化微生物提供了其所需的有效性碳,保障了反硝化作用過程發生所需的能源。值得注意的是,與大田土壤相比,設施菜田土壤硝態氮含量已不是反硝化過程發生的限制因子,因此,在其施用有機肥導致土壤有效性碳含量增加的短期時間內,將極大地促進以反硝化作用過程為主導途徑的N2O峰值排放。
在土壤含水量較低 (質量含水量25%左右) 條件下,銨態氮肥施入可增加硝化作用過程N2O的排放,但其整體排放系數較低 (1%左右),且長期施用銨態氮肥會造成土壤酸化。土壤pH值的改變又將影響土壤微生物種群結構的變化。以氨氧化微生物細菌 (AOB) 和古菌 (AOA) 為例,由于它們在不同的土壤環境條件下占據不同的生態位[199-201],其對土壤pH值的響應也不相同。一般認為,AOB在中性、堿性和高氮素投入的條件下是驅動硝化過程進行的主體,而AOA在酸性的自然生態系統中更能發揮作用[202]。同時,對于反硝化微生物來說,低pH阻礙N2O還原酶的形成[203],導致N2O產物比值增加。值得注意的是,非生物學過程在低pH土壤中對N2O的貢獻不可忽略,特別是在過量施肥導致土壤出現NO2-累積時,非生物學過程對N2O排放的貢獻更加明顯。此外,溫度也是影響農田土壤N2O排放的重要因子,在全球氣候變暖的大背景下會受到更多關注。在農田土壤水肥管理措施中,硝化抑制劑、緩控釋肥等高效施氮 (見2.1部分) 和間歇灌溉等技術的應用,有利于農田土壤N2O的減排。
4 結論與展望
綜上所述,雖然土壤N2O產生途徑有反硝化、硝化、硝化細菌的反硝化和硝化-反硝化耦合、真菌反硝化、化學反硝化,以及硝酸異化還原為銨等,但就一般農田土壤而言,生物反硝化過程或許仍然是N2O產生的主要途徑。支持這一觀點的依據既表現在環境因子和管理措施對農田土壤N2O排放的影響機理方面,而且也有分子生物學的證據。而硝化細菌的反硝化、硝化-反硝化耦合過程等,實質上也是生物反硝化過程的一部分。硝化過程本身對農田土壤N2O排放的直接貢獻較小,在許多情況下可能僅僅是背景排放。然而,由于硝化過程為生物反硝化和化學反硝化提供了底物,特別是中間產物NO2-的釋放,其對N2O排放具有很大的間接貢獻。此外,真菌反硝化和化學反硝化在酸性土壤以及DNRA過程在高有機質和厭氧的土壤環境中,也對土壤N2O排放具有不可忽視的重要作用。合理管理有機肥和水分,輔之以硝化抑制劑的利用[204-205],可在很大程度上減少農田土壤N2O排放。
目前人們對農田土壤N2O的產生和消耗方面的認識還面臨諸多挑戰。主要表現在:首先,農田土壤N2O排放主要來自于自然降水后,特別是施肥后立即灌水而產生的排放峰。在這一階段的N2O產生和消耗過程進行深入研究,對農田土壤N2O減排措施的提出具有重要意義。其次,降低土壤反硝化過程N2O/N2的產物比,是N2O減排的有效措施之一。為此,需要深入了解環境因子和調控措施對反硝化產物比的影響及其機理,以便為通過降低產物比實現N2O減排提供依據。再者,加強對N2O還原過程及其影響因素的了解,也具有重要意義。最后,在尋找與N2O排放有關的關鍵微生物方面人們遇到了很大挑戰,這與反硝化微生物功能類群的廣譜性和生理類型的多樣性有密切關系,相信隨著分子生物學和基因芯片技術的發展,這一問題能夠逐步得到解決。與此同時,綜合利用新技術方法,如平面光極技術[148]、Robot自動培養技術[206]、氦環境培養—氣體同步直接測定技術[207]、宏基因組測序技術等進一步探究土壤物理、化學和生物學因素對氮素轉化過程、N2O關鍵位點排放及關聯微生物多樣性的影響,構建氮素平衡和相關N2O排放模型,可進一步為N2O排放機制及相關影響因素提供理論依據。此外,通過對反硝化過程中N2O/N2產物比產生規律及其影響因素的深入了解,將為利用田間N2O監測數據定量估算氮的反硝化損失提供一種新的途徑。

