SOCS1過表達的樹突細胞對慢性阻塞性肺疾病小鼠肺組織中Th17及Treg相關細胞因子的影響
劉茂茂 鄭相如 歐陽瑤
遵義醫科大學附屬醫院呼吸一科(貴州遵義563000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一種發病機制尚不明確且嚴重危害人類健康的慢性呼吸系統疾病,其具有高患病率、高致殘率、高病死率[1]。許多研究表明患有自身免疫性疾病的患者合并COPD 的概率增高,免疫的紊亂也許會進一步加重COPD 病程[2],此揭示COPD 也許是自身免疫性疾病中的一種[3]。
輔助性T細胞和樹突細胞(dendritic cells,DCs)是參與COPD 的重要免疫細胞。Th17 分泌IL-22、IL-21、IL-17 及影響IL-23 等細胞因子加入到炎癥和自身免疫疾病的發生發展中[4]。Treg 通過分泌IL-10 和TGF-β 等抗炎及抑制性細胞因子參與并維持免疫穩態及耐受[5]。據報道,COPD 氣道放大的炎癥反應與Th17 及Treg 異常反應有關,Th17/Treg 的失衡及相關細胞因子參與了COPD 發病機制[6]。本課題組前期研究發現Th17/Treg 失衡及DCs 在COPD 發病中扮演重要角色[7]。DCs 能捕獲、遞呈抗原到初始的T 細胞,其對特異性免疫應答起到一個很關鍵的作用[8]。細胞因子信號轉導抑制因子(suppressors of cytokine signaling,SOCS)蛋白能參與到負性調節酪氨酸激酶信號轉導及轉錄激活因子(janus kinase-signal transducers and activators of transcription,JAK-STAT)信號傳導途徑中,主要傳導細胞因子轉導信號,參與免疫調節,其中SOCS1 能影響DCs 分化及功能[9]。報道示過表達SOCS1 使DCs 偏向imDCs,減低T 細胞的活性,呈現免疫耐受,從而參與自身免疫性疾病[6],但COPD 中尚未報道。鑒于Th17 及Treg 在COPD中的作用及DC-SOCS1 對T 細胞的影響,因此,本研究擬通過DC-SOCS1 干預COPD 模型小鼠,闡明肺組織中IL-17,IL-23,IL-10 和TGF-β 變化,希望為COPD 的防治提供新思路及策略。
1 材料與方法
1.1 實驗動物及和主要試劑C57BL/6 小鼠,6 ~8 周,80 只[第三軍醫大學的動物實驗中心提供,小鼠許可證號:SCXK(渝)2017-0001]。胎牛血清(FBS)、RPMI 1640 培養基(Gibco 公司),小鼠白細胞介素-17(IL-17)、白細胞介素-23(IL-23)、白細胞介素-10(IL-10)、轉化生長因子β(TGF-β)ELISA kit(北京麗科創欣生物科技有限公司),GMCSF、IL-4(PEPROTECH 公司),一抗為兔來源的SOCS1(Abcam 公司),二抗為羊抗兔IgG(sigma 公司),質粒小量抽提試劑盒(Promega 公司),DH5α感受態(TaKaRa 公司)。
1.2 小鼠骨髓源性DCs的提取及培養處死小鼠,分離去除股骨和脛骨的骨骺端,用PBS對骨髓沖洗,用離心機1 000 r/min 離心5 min,丟棄上清液體,再次用PBS 混勻底部細胞沉淀,用混勻的細胞液同淋巴細胞分離液一起離心(2 000 r/min 20 min),抽出骨髓基質細胞層部分,PBS 洗3 次。對細胞進行接種培養并于第7天加LPS(100 ng/μL)誘導成熟。
1.3 掃描電鏡觀察LPS 誘導成熟的DCs對鋪片培養的細胞進行PBS 漂洗,先后用戊二醛、鋨酸4 ℃固定,以醋酸異戊酯脫水、取樣。真空噴鍍法對樣品進行導電處理,鏡下觀察。
1.4 SOCS1 慢病毒及空載慢病毒的構建及感染骨髓源性imDCs原代分離培養DC,第5 天行慢病毒感染。取出4 ℃保存的病毒,離心20 s。據預實驗確認MOI=100 進行試驗,慢病毒用量=MOI×細胞數目/慢病毒滴度,吸取病毒液加入細胞,并加5 μg/mL 的Polybrene 助轉染劑。混勻后將24 孔板放在37 ℃度培養箱中孵育。24 h 更換培養基。感染4 h 后,熒光顯微鏡觀察熒光表達。
1.5 Western blot 分析DC-SOCS1 表達效果BCA法蛋白定量按照1:50 比例稀釋樣品液,加BCA工作液,37 ℃孵箱孵育30 min,酶標儀在562 nm 波長處測定待測樣品液濃度,蛋白變性后-20 ℃保存。SDS-PAGE 電泳:配膠及灌膠、上樣、轉膜,封閉,孵育一抗過夜(內參一抗稀釋濃度1∶1 000,DC-SOCS1 一抗稀釋濃度1∶500)。孵育二抗1.5 h(1∶1 000)清洗,顯色。
1.6 COPD 造模及DCs 回輸48 只雄性6 ~8 周齡體質量20 ~25 g 的C57BL/6 小鼠予以隨機分組,每組各6 只共8 組。A:正常空氣對照組;B:生理鹽水回輸組(煙熏第1 天);C:早期低劑量DCSOCS1 回輸組(煙熏第1 天);D:早期高劑量DCSOCS1 回輸組(煙熏第1 天);E:imDCs 1×106回輸組(煙熏第1 天);F:低劑量DC-SOCS1 回輸組(煙熏第7 天);G:高劑量DC-SOCS1 回輸組(煙熏第7 天);H:imDCs 1×106回輸組(煙熏第7 天),以上回輸均以0.1 mL/10 g 進行回輸。置于12 ~12 h 晝夜交替動物房,小鼠適應性喂養1 周后進行實驗(低劑量:1 × 106高劑量:2 × 106)。以28 d 煙熏法COPD 模型小鼠[10]制模型,將小鼠放在自制的煙熏箱(45 cm × 30 cm × 30 cm)中,使它們人為被動地吸煙,每次3 支,每次1 h,每天4 次,每周7 d,煙熏28 d。對照組則于空氣中正常飼養。余7 組進行上述差異化處理。
1.7 肺組織標本的處理及HE 染色建模28 d 后,通過腹腔注射7%的水合氯醛(5 mL/kg)麻醉小鼠,用冰PBS 洗凈獲取的新鮮肺組織,左上葉肺組織用于HE 染色:切片烘烤、脫臘、染色、封片、鏡檢。
1.8 ELISA 測肺組織中IL-17、IL-23、IL-10 和TGF-β收集肺組織勻漿上清液,ELISA 檢測肺組織中IL-17、IL-23、IL-10 和TGF-β的水平做標準曲線(IL-17、IL-23:240、160、80、40、20 μg/mL;IL-10:600、400、200、100、50 μg/mL;TGF-β:180、120、60、30、15 μg/mL)、加入待測樣品、溫育、洗滌、酶標試劑、洗滌、顯示、終止、450 nm 波長測OD值。
1.9 統計學方法運用GraphPad Prism 6、SPSS 18.0 分析所得的實驗數據。運用Kolmogorov-Smirnov 方法檢驗計量資料的分布正態性。結果顯示,本實驗的計量資料都符合正態分布,用表示,多組間的比較使用單因素方差分析。以析因設計資料的方差分析實驗中回輸細胞類型及回輸時間對細胞因子的作用。以LSD-t、Dunnett-t檢驗均數間多重比較。P<0.05 表示差異存在統計學意義。
2 結果
2.1 培養及鑒定小鼠骨髓源性DCs從小鼠股骨及脛骨中沖洗提取骨髓源性DCs。于含GM-CSF、IL-4 的培養基中培養,誘導前體細胞向imDCs 分化,于第7 天加LPS 成熟刺激24 h,用掃描電鏡觀察,鏡下見樹枝狀突起不規則的典型DCs 形態特征(圖1)。這表明骨髓源性DCs 的成功提取、培養及鑒定,且經LPS 刺激后能正常成熟。

圖1 掃描電鏡:LPS 誘導成熟的DCsFig.1 Scanning electron microscope:LPS-induced mature DCs
2.2 構建DC-SOCS1 模型熒光顯微鏡觀察熒光表達,圖2中綠色熒光表示載有過表達SOCS1 的imDCs 及空轉慢病毒的imDCs。
使用WB 測定SOCS1 的表達情況,結果顯示:SOCS1 在DC-SOCS1 中的表達(43.77 ± 3.73)較DCs-Lv-GFP(17.29 ± 4.47)和imDCs 組(18.88 ±3.22)明顯增加,且均具有統計學意義(P<0.01,見圖3)。

圖2 過表達SOCS1 的imDCs 及空轉慢病毒的imDCs(×100)Fig.2 Lentiviral transfection into bone marrow-derived imDCs(×100)
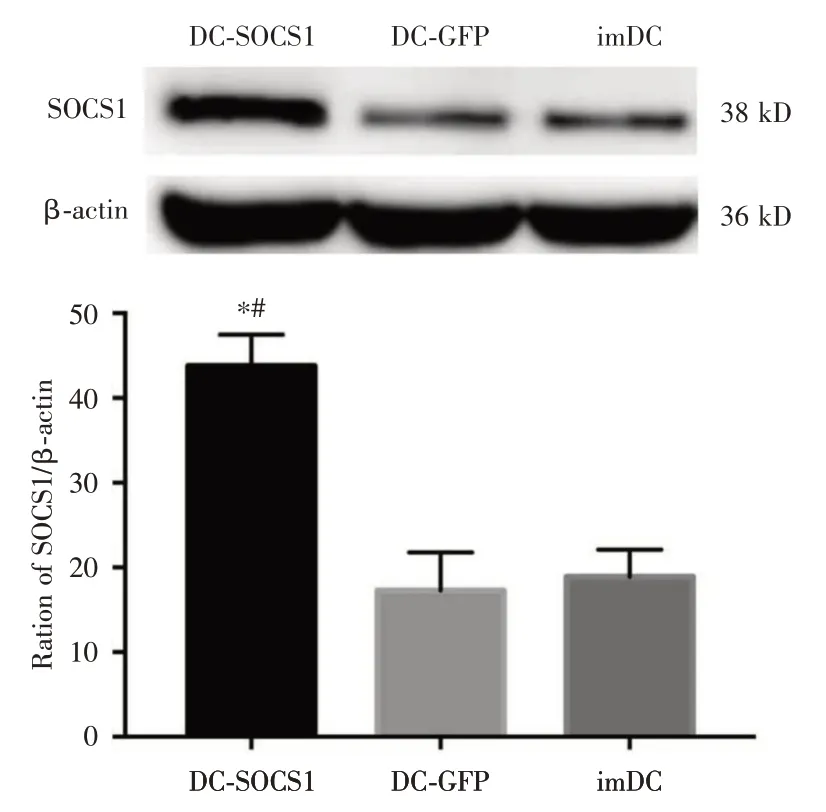
圖3 Western blot 測DC-SOCS1 中SOCS1 表達水平Fig.3 Expression level of SOCS1 in DC-SOCS1 detected by Western blot
2.3 煙熏28 d 后小鼠肺組織病理變化特征本研究采用28 d 煙熏法構建COPD 模型,將空氣對照組和回輸生理鹽水組肺組織進行HE 染色。如圖4A示,空氣對照組小鼠肺組織的肺泡結構清晰,肺泡壁完整,無斷裂、融合,其間僅見少許浸潤的炎性細胞。COPD 煙熏模型組(圖4B)肺組織中可見大量炎性細胞浸潤,肺泡壁結構破壞,斷裂,相鄰肺泡腔相互融合擴大,構成典型肺氣腫征象,此煙熏小鼠模型具有COPD 典型的病理學特征,包括肺實質炎癥和肺氣腫。
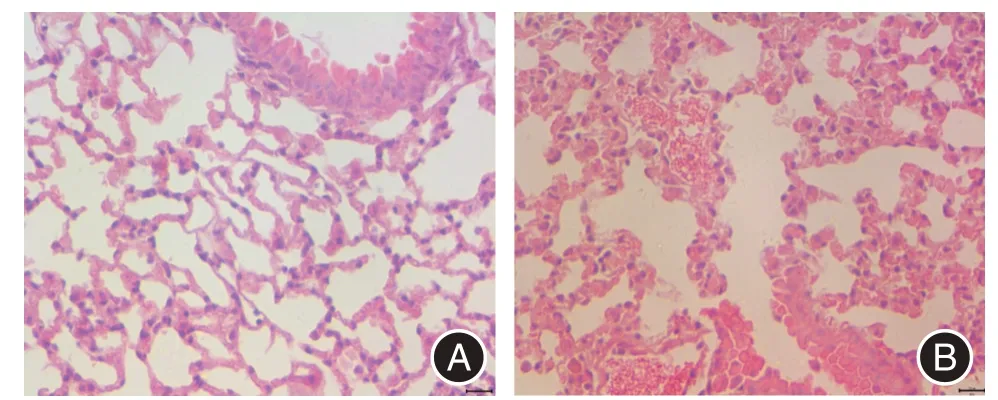
圖4 COPD 小鼠模型肺組織的HE 染色(×400)Fig.4 HE staining of lung tissue in COPD mice(×400)
2.4 過表達SOCS1的DCs干預COPD小鼠后肺組織Th17相關細胞因子IL-17及IL-23表達減少煙熏第1 天回輸后,小鼠肺組織IL-17 及IL-23 表達水平在生理鹽水組、imDCs 組、低劑量DC-SOCS1 組(1 × 106)和高劑量DC-SOCS1 組(2 × 106)間的差異具有統計學意義(P<0.05)。和生理鹽水組比,IL-17 及IL-23 在肺組織的表達水平在其他三組均顯著降低。析因設計方差分析顯示,各組小鼠肺組織中IL-17 及IL-23 的表達水平存在差異。DC-SOCS1 組 和imDCs 組 比,IL-17 及IL-23 表 達水平降低(P<0.05),且DC-SOCS1(2 × 106)組較DC-SOCS1(1 × 106)組降低更顯著(P<0.05);煙熏早期(第1 天)較第7 天降低(P<0.05);此外,煙熏后不同回輸的分組和時間共同起作用,本研究發現IL-17、IL-23 最低水平時是發生在回輸DC-SOCS1(2×106)第1 天后。見表1、2。
表1 IL-17 在COPD 小鼠肺組織中的表達(n=6)Tab.1 Expression of IL-17 in lung tissue of COPD mice±s
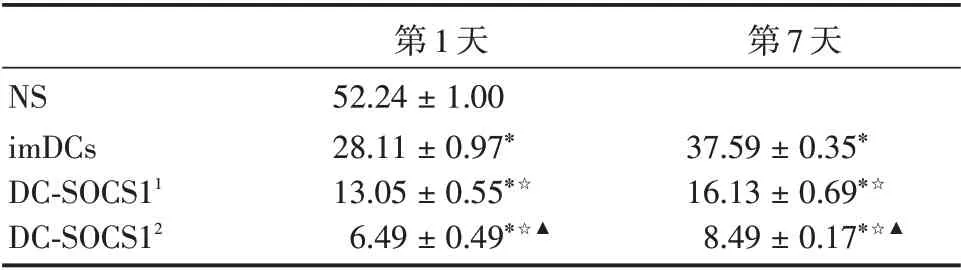
表1 IL-17 在COPD 小鼠肺組織中的表達(n=6)Tab.1 Expression of IL-17 in lung tissue of COPD mice±s
注:與NS 組比較,*P <0.05 ;與同imDCs 組比較,☆P <0.05 ;與同DC-SOCS11 組比較,▲P <0.05;DC-SOCS11 代表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
第7 天NS imDCs DC-SOCS11 DC-SOCS12第1 天52.24±1.00 28.11±0.97*13.05±0.55*☆6.49±0.49*☆▲37.59±0.35*16.13±0.69*☆8.49±0.17*☆▲
表2 COPD 小鼠模型肺組織中IL-23 的表達(n=6)Tab.2 Expression of IL-23 in lung tissue of COPD mice±s

表2 COPD 小鼠模型肺組織中IL-23 的表達(n=6)Tab.2 Expression of IL-23 in lung tissue of COPD mice±s
注:與NS 組比較,*P <0.05 ;與imDCs 組比較,☆P <0.05 ;與同DC-SOCS11 組 比 較,▲P <0.05;DC-SOCS11 代 表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
第7 天NS imDCs DC-SOCS11 DC-SOCS12第1 天224.1±1.1 176.3±4.4*139.9±1.4*☆92.2±2.2*☆▲195.4±0.9*152.3±1.1*☆126.3±1.1*☆▲
2.5 過表達SOCS1的DCs干預COPD小鼠后肺組織Treg 相關細胞因子IL-10 及TGF-β表達增加煙熏第1 天回輸后,小鼠肺組織IL-10 及TGF-β表達水平在生理鹽水組、imDCs 組、低劑量DC-SOCS1組(1×106)和高劑量DC-SOCS1 組(2×106)間的差異具有統計學意義(P<0.05)。和生理鹽水組比,余三組中IL-10 和TGF-β在小鼠肺組織中均顯著增加。析因設計方差分析示,各組小鼠肺組織IL-10及TGF-β存在差異。DC-SOCS1 組IL-10 和TGF-β的表達水平較imDCs 組增加(P<0.05),且高劑量DC-SOCS1(2 × 106)組較低劑量DC-SOCS1(1 ×106)組IL-10 及TGF-β水平增加更明顯(P<0.05);煙熏早期(第1 天)較第7 天增加(P<0.05)。其中,TGF-β在煙熏后不同回輸的分組和時間共同起作用,即第1 天回輸DC-SOCS1(2 × 106)后水平最高,而對于IL-10 不存在交互作用。見表3、4。
表3 IL-10 在COPD 小鼠肺組織中的表達(n=6)Tab.3 Expression of IL-10 in lung tissue of COPD mice±s

表3 IL-10 在COPD 小鼠肺組織中的表達(n=6)Tab.3 Expression of IL-10 in lung tissue of COPD mice±s
注:與NS 組比較,*P <0.05 ;與同imDCs 組比較,☆P <0.05 ;與同DC-SOCS11 組比較,▲P <0.05;DC-SOCS11 代表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
第7 天NS imDCs DC-SOCS11 DC-SOCS12第1 天35.05±2.01 43.56±1.95*54.08±1.78*☆71.64±1.57*☆▲40.00±2.35*48.18±1.52*☆66.53±4.91*☆▲
表4 COPD 小鼠模型肺組織中TGF-β 的表達(n=6)Tab.4 Expression of TGF-β in lung tissues of COPD mice±s
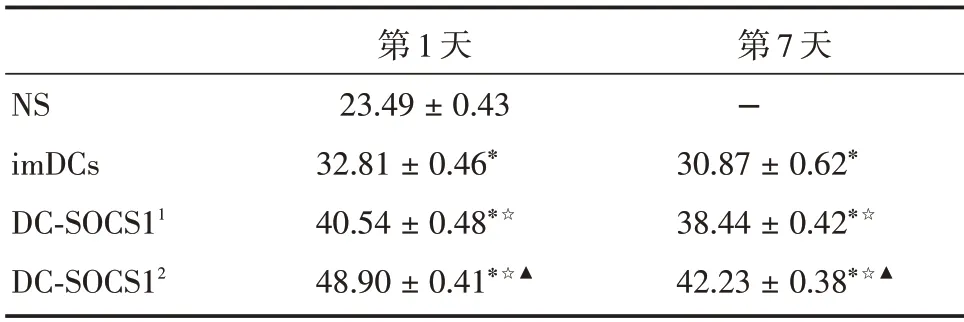
表4 COPD 小鼠模型肺組織中TGF-β 的表達(n=6)Tab.4 Expression of TGF-β in lung tissues of COPD mice±s
注:與NS 組比較,*P <0.05 ;與同imDCs 組比較,☆P <0.05 ;與同DC-SOCS11 組比較,▲P <0.05;DC-SOCS11 代表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
NS imDCs DC-SOCS11 DC-SOCS12第1 天23.49±0.43 32.81±0.46*40.54±0.48*☆48.90±0.41*☆▲第7 天-30.87±0.62*38.44±0.42*☆42.23±0.38*☆▲
3 討論
Th17 具強烈的促炎活性,可招募巨噬細胞和中性粒細胞,產生IL-17 放大炎癥反應,促進炎性疾病的發展,也可通過IL-23 促進自身分泌IL-17,維持及放大其功能,在許多炎癥及自身免疫性疾病中發揮重要作用[11]。研究發現Th17 相關細胞因子在COPD 模型中是增加的,且與疾病的嚴重程度及FEV1%呈正相關[12]。本實驗用DC-SOCS1 及imDC 對COPD 小鼠進行干預,通過ELISA 測Th17相關細胞因子IL-17 及IL-23 的變化。與對照組比,imDCs、低劑量DC-SOCS1(1 × 106)和高劑量DC-SOCS1(2 × 106)回輸后均能減少COPD 小鼠肺組織IL-17 和IL-23 的表達,其中DC-SOCS1 效果顯著,且在本實驗中與濃度及時間有關。鑒于Th17及其相關細胞因子在COPD 中的促炎作用,推測DC-SOCS1 干預后可能通過減少Th17 相關細胞因子的表達,減輕COPD 的肺部炎癥反應,從而減輕或延緩COPD 的病情進展。當然,這有待本課題組進一步的肺組織病理結果證實。
Treg 通過細胞間的直接接觸或間接分泌細胞因子,主要是IL-10 和TGF-β等抑制T 細胞的增殖分化,從而在免疫耐受及機體穩態中發揮重要作用。有報道示免疫微環境改變刺激細胞因子產生,引起Th17/Treg 的失衡并參與COPD 的發生發展,且Treg 及其細胞因子IL-10 和TGF-β是減少的[13]。在本實驗中經DC-SOCS1 或imDC 干預后IL-10 及TGF-β表達增加,且DC-SOCS1效果較imDC顯著,并與時間及濃度有關。推測其可能通過增加Treg 相關細胞因子IL-10 及TGF-β的表達,增強機體的抗炎或誘導免疫耐受的能力,延緩COPD 的病情。
研究發現原花青素減輕支氣管哮喘的氣道炎癥是通過抑制imDC 的成熟及誘導免疫耐受實現[14]。本實驗發現DC-SOCS1 的干預效果均優于imDC,結合抗原刺激DC 成熟及SOCS1 對imDC抑制成熟作用,推測可能是imDC 回輸入體后經體內抗原等刺激,逐漸成熟,其誘導免疫耐受的能力減弱或消失,而過表達SOCS1 能持續抑制imDC 成熟,使DC-SOCS1 傾向于imDC 從而誘導免疫耐受所致。此外,本實驗中亦發現,DC-SOCS1 的干預效果可能與濃度及時間有關,即早期高濃度對Th17及Treg 相關細胞因子的影響更明顯,推測其可能原因為高濃度下越早干預,越能及時抑制imDC 的成熟并較好地誘導免疫耐受所致。
DC-SOCS1 對T 細胞增殖分化及功能的影響,在腫瘤、移植物抗宿主病及自身免疫性疾病中已被廣泛研究,但在COPD 中尚未報道,本實驗以DC-SOCS1 干 預COPD 小 鼠 模 型,發 現COPD 小 鼠肺組織中Th17 相關細胞因子IL17 及IL-23 是減少的,而Treg 相關細胞因子IL-10 及TGF-β是增加的,可能為COPD 的干細胞防治提供新思路。當然,本實驗有局限性,如僅從細胞因子層面反映了DC-SOCS1 對COPD 小鼠的影響,缺乏各組肺組織病理改變予以證實,且缺乏其具體的作用機制,這也是本課題組正在進行的實驗,以期找到延緩或改善COPD 病情的新策略。

