經腹膜外腹腔鏡前列腺癌根治術圍術期指標觀察及其對患者的影響
農 健,吳新潮,何慈聰,黃文林,李 濤,楊愛宏
(云南省文山州人民醫院,云南文山 663000)
前列腺癌是男性泌尿生殖系統常見的惡性腫瘤之一,其發病率隨中國人口老齡化的加重,呈逐年上升趨勢[1]。前列腺癌好發于大于55歲的男性,70~80歲為發病高峰期,其發病原因主要與遺傳因素、性活動、飲食習慣等有關[2]。前列腺患者早期癥狀多不明顯,漏診率高,隨病情發展,患者可出現進行性排尿困難、大便困難、射精缺乏、會陰部疼痛等壓迫癥狀以及腫瘤轉移引起的血尿、雙下肢水腫、病理性骨折等轉移癥狀[3-4]。前列腺癌的治療包括手術治療、放化療、內分泌治療等。其中前列腺癌根治術是早期前列腺癌患者最主要的治療方法之一,隨著腹腔鏡下前列腺癌根治術的廣泛應用,有效減輕了開放手術對患者機體造成的損傷,但部分患者術后仍有尿失禁、勃起功能障礙、免疫功能降低等并發癥發生,嚴重影響患者生活質量。目前,臨床逐漸開展了經腹膜外入路方案腹腔鏡前列腺癌根治術,但關于其臨床應用效果報道較少,本研究就經腹膜外腹腔鏡前列腺癌根治術圍術期指標情況及其對患者總前列腺特異抗原(TPSA)、游離前列腺特異抗原(FPSA)及免疫功能的影響展開研究,現將研究情況報道如下。
1 資料與方法
1.1一般資料 選取2016年3月到2017年3月在云南省文山州人民醫院行前列腺癌根治術的患者92例。納入標準[5]:(1)經前列腺穿刺活檢及影像學檢查確診前列腺癌;(2)未進行糖皮質激素治療以及放療、化療等相關治療;(3)符合前列腺癌根治術適應證,即臨床分期為T1~T2c,PSA<20 ng/mL、Gleason評分≤7分、預期壽命≥10年;(4)對本研究內容知情,自愿參加本項研究并簽署知情同意書。排除標準:(1)合并嚴重的心、腦、肺、腎等實質器官疾病的患者;(2)發生骨轉移、淋巴結轉移等遠處轉移的患者;(3)合并凝血功能障礙、免疫系統疾病的患者;(4)既往有后尿路、前列腺等手術史。本研究經本院醫學倫理委員會批準進行。
采用隨機數字法將患者平均分為觀察組與對照組各46例,2組患者在年齡、前列腺體積、臨床分期、PSA水平以及Gleason評分等方面比較差異均無統計學意義(P>0.05)。見表1。
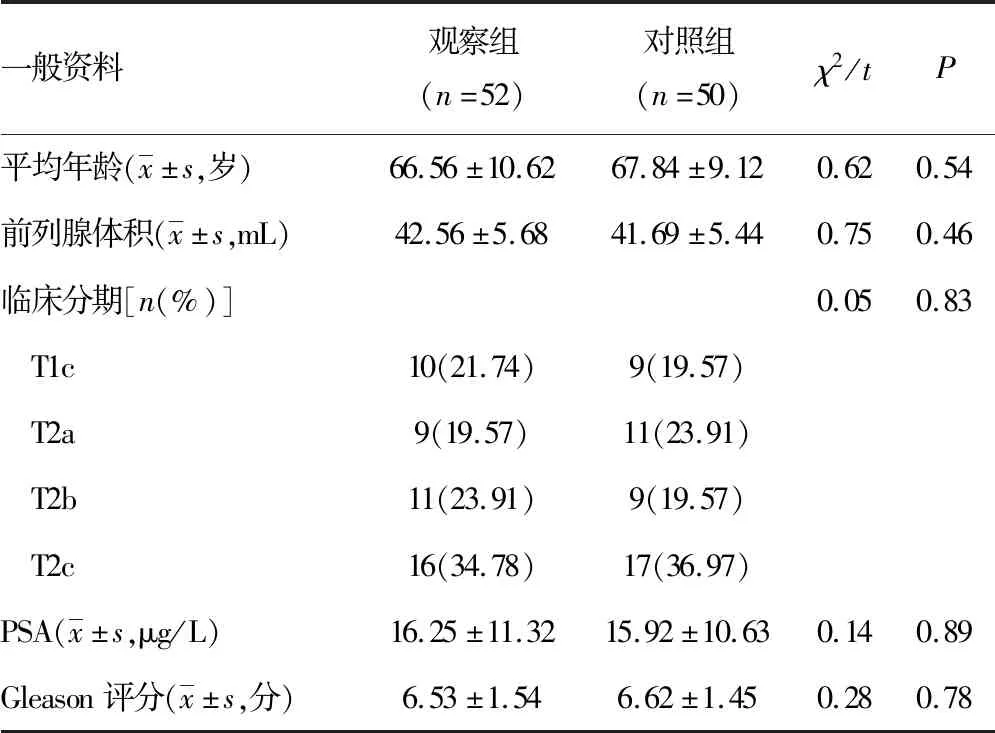
表1 一般資料比較
1.2方法 對照組采用腹腔入路腹腔鏡前列腺癌根治術方案,觀察組采用經腹膜外入路腹腔鏡前列腺癌根治術方案,具體步驟為:采用靜脈與吸入復合全身麻醉法麻醉患者,將患者置于15~30°頭低足高仰臥位,于臍下緣弧形切開皮膚,并逐層切開至腹直肌后鞘,手指分離腹膜外間隙,必要時進行氣囊擴張,在手指引導下穿刺置人Hasson套管,并縫合固定。分別于臍周圍扇形置入10 mm、5 mm的Trocar套管,建立CO2氣腹,氣腹壓力維持在10~15 mm Hg。行常規雙側盆腔淋巴結清掃,使用超聲刀由外向內依次切開盆腔內筋膜和恥骨前列腺韌帶,將輸精管離斷,并對前列腺的兩側壁及前列腺尖部進行分離,采用可吸收線結扎縫合陰莖背血管復合體。將前列腺尖部尿道切斷,進行尿道和膀胱單針連續吻合完成膀胱頸重建,常規留置引流管。2組患者術后均進行對癥支持治療,常規抗感染,常規護理。腹腔引流管于術后3 d拔除,尿管于術后14 d拔除。
血清學檢測于術前、術后1 d及術后7 d分別抽取2組患者空腹靜脈血5 mL,高速離心機3 000 r/min離心15 min,分離血清并放置于-70 ℃超低溫冰箱內,待測。血清IgG、IgA及IgM水平采用免疫透射比濁法依次進行檢測;血清TPSA、FPSA水平采用化學發光法依次進行檢測;血清IgG、IgA、IgM以及TPSA、FPSA水平均采用羅氏Cobas6000全自動電化學分析儀及配套試劑進行檢測;血清CD4+、CD8+、CD4+/CD8+百分比采用直接免疫熒法依次進行檢測,儀器為EPICS-XL流式細胞儀,購自美國Coulter公司。CD4+、CD8+單克隆抗體購自美國雅培公司 。
1.3觀察指標 (1)2組患者圍術期指標情況;(2)2組患者術前、術后1 d及術后7 d血清TPSA、FPSA水平;(3)2組患者術前、術后1 d及術后7 d血清IgG、IgA、IgM水平以及CD4+、CD8+、CD4+/CD8+百分比;(4)2組患者并發癥情況。
2 結 果
2.12組患者圍術期指標情況比較 觀察組患者圍術期手術時間、術中出血量、胃腸功能恢復時間以及住院時間均明顯低于對照組,差異有統計學意義(P<0.05)。見表2。
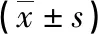
表2 2組患者圍術期指標情況比較
2.22組患者術前、術后1 d及術后7 d血清TPSA、FPSA水平比較 2組患者術前血清TPSA、FPSA水平比較差異均無統計學意義(P>0.05);2組患者術后1 d及術后7 d血清TPSA、FPSA水平較術前均明顯降低,且觀察組明顯低于對照組,差異均有統計學意義(P<0.05)。見表3。
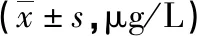
表3 2組患者術前、術后1 d及術后7 d血清TPSA、FPSA水平比較
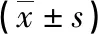
表4 2組患者術前、術后1 d及術后7 d其他臨床指標比較
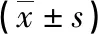
續表4 2組患者術前、術后1 d及術后7 d其他臨床指標比較
2.32組患者術前、術后1 d及術后7 d血清IgG、IgA、IgM水平以及CD4+、CD8+、CD4+/CD8+百分比比較 2組患者術后1 d血清IgG、IgA水平較術前均明顯降低,組間比較差異均有統計學意義(P<0.05);2組患者術后7 d血清IgG、IgA水平較術后1 d均明顯升高,組間比較差異均有統計學意義(P<0.05);2組患者血清IgM水平術前術后及組間比較差異無統計學意義(P>0.05);2組患者術后1 d血清CD4+及CD4+/CD8+百分比較術前均明顯降低,CD8+百分比較術前均明顯升高,且組間比較差異均有統計學意義(P<0.05);2組患者術后7 d血清CD4+及CD4+/CD8+百分比較術后1 d均明顯升高,CD8+百分比較術后1 d均明顯降低,且組間比較差異均有統計學意義(P<0.05)。見表4。
2.42組患者并發癥情況比較 觀察組患者術后尿失禁、尿道狹窄、尿潴留、勃起功能障礙發生率明顯低于對照組,差異有統計學意義(χ2=9.95,P=0.00)。見表5。

表5 2組患者并發癥情況比較[n(%)]
注:-表示該項無數據
3 討 論
腹腔鏡下前列腺癌根治術應用腹腔鏡微創技術,具有清晰的手術視野,并能放大手術視野,從而更有利于進行精細操作,有效減少了對神經、血管的損傷,與以往開放前列腺癌根治術相比,顯著減輕了患者的手術創傷,加快了患者術后的恢復[6-9]。目前,腹腔鏡下前列腺癌根治術已成為前列腺癌根治術的主要手術方案,但由于前列腺位于人體空間狹小的盆腔內,且其周圍組織結構復雜,大大增加了手術操作難度。隨著腹腔鏡下前列腺癌根治術在臨床的廣泛開展,患者術后發生尿潴留、尿失禁、勃起功能障礙等并發癥的報道不斷增多,如何進一步改進前列腺癌根治術手術方案,成為臨床研究的熱點[10-11]。
經腹膜外腹腔鏡下前列腺癌根治術是基于腹腔鏡下前列腺癌根治術改進的新的手術入路方案,相比常規腹腔入路手術方案,經腹膜外入路腹腔鏡下前列腺癌根治術同樣具有手術切口小、手術視野清晰、術中出血少,術后恢復快等優勢[12]。此外,經腹膜外入路方案減少或避免了對患者腹腔器官組織的損傷和刺激,且經腹膜外入路可更快顯露前列腺組織,減少了對周圍組織的損傷,即減少手術時間,又進一步降低了神經、血管損傷的概率[13-15]。本研究中,不同手術入路組患者圍術期指標顯示:經腹膜外入路組患者圍術期手術時間、術中出血量、胃腸功能恢復時間以及住院時間均明顯低于對照組,表明經腹膜外入路手術方案可進一步改善患者圍術期指標,促進患者術后康復。TPSA及FPSA為前列腺上皮細胞分泌的一種單鏈糖蛋白,是診斷前列腺癌以及評價其術后療效的重要指標[16]。本研究結中,觀察組患者術后TPSA及FPSA水平顯著低于對照組,表明經腹膜外腹腔鏡下前列腺癌根治術可有效切除病灶組織,具有更好的臨床療效。
無論是經腹腔入路還是經腹膜外入路腹腔鏡前列腺癌根治術作為一種創傷手術,不可避免會對機體造成不同程度損傷,手術的損傷及應激反應可導致機體產生炎性反應以及免疫功能的可逆性改變,通過監測患者機體IgG、IgA、IgM免疫球蛋白水平以及CD4+、CD8+、CD4+/CD8+T淋巴細胞亞群百分比可有效觀察患者機體免疫功能狀況。本研究結果顯示:2組患者術后1 d血清IgG、IgA、CD4+、CD4+/CD8+水平均明顯降低,CD8+水平升高,但觀察組患者下降/升高幅度小于對照組,表明術后患者機體免疫系統均受一定抑制,但經腹膜外入路組患者免疫功能受損程度較小,而術后7 d 2組患者IgA、IgG以及CD4+、CD8+、CD4+/CD8+水平逐漸趨近于術前水平,且觀察組改善水平顯著優于對照組,提示腹膜外入路手術方案能使患者免疫功能得到更快速的恢復。上述患者免疫球蛋白指標的變化與張明艷等[1]的研究結果相似,但在其他的研究中顯示,除IgA、IgG發生了變化外,IgM也出現了改變,并且實施腹膜外入路手術的患者的IgM水平要優于腹腔鏡組[3]。筆者認為,由于這兩種手術方案在手術創傷方面要遠低于于傳統開腹手術,因此對免疫功能的影響也較小,而對于機體功能狀態較好患者,其影響是不明顯的,但也不排除在研究中由于樣本檢測不準確等因素的干擾導致了IgM水平的變化不明顯。此外,在并發癥情況方面,觀察組患者術后并發癥明顯少于對照組,表明經腹膜外腹腔鏡下前列腺癌根治術可有效減少患者術后并發癥的發生。
4 結 論
綜上所述,經腹膜外腹腔鏡下前列腺癌根治術在前列腺癌患者的治療中,臨床療效顯著,手術創傷更小,對患者腹腔影響更小,同時更能有效地保護患者免疫功能,減少并發癥發生率,從而促進患者術后康復,提高患者生活質量。

