二氧化鈦納米顆粒的肝細胞毒性及分子機制研究
洪鴻翔,陳勁宇,鄧宏健,孫郁雨,袁 錕,王祥宇,崔志明
目前,老齡化已成為世界范圍公認的社會問題,衰老導致人體骨量下降、骨質疏松、關節炎癥、關節退變,并由此引起重要關節部位疾病、甚至功能的喪失。骨骼問題引起的疾病是最普遍存在的人類健康問題,而生物醫用金屬材料成為解決這些問題的重要方法之一。二氧化鈦(TiO2)是一種具有耐化學腐蝕性、光化學催化特性的無機化工材料,被廣泛用于醫藥、日化、化妝品、食品中。研究表明[1]TiO2能夠通過呼吸、消化等途徑進入體內,并且在特定部位富集,從而對機體產生毒性。文獻報道[2],TiO2在肝中沉淀最多,隨著TiO2濃度的升高,肝功能受到明顯損害,并導致抗氧化系統、免疫系統衰竭、全身出現炎癥反應等一系列綜合征。PD-1/PD-L1信號通路是動物體中較為保守的信號通路,對機體免疫調控起著重要的作用[3]。本研究從PD-1/PD-L1信號通路入手,探討TiO2對小鼠肝細胞的毒性作用,從而為了解TiO2毒性及其防治提供理論依據。
1 材料與方法
1.1 實驗動物及主要試劑與設備 清潔級ICR小鼠由南通大學實驗動物中心提供,合格證號:SYXK(蘇)20020022;TiO2購自上海醫藥集團;兔抗小鼠 PD-1、 兔抗小鼠 PD-L1、Rat anti-mouse-CD19-FITC、Rat anti-mouse-CD4-FITC、Rat anti-mouse-CD8-PE、兔抗GAPDH及山羊抗兔IgG購自美國abcam公司;IL-6、IL-10、TNF-α、CRP 試劑盒購自上海西唐生物科技有限公司;生化自動分析儀(日本日立,型號:7170),高速冷凍離心機(德國eppendorf,型號:5180),電泳槽(北京六一儀器廠,型號:DYY-Ⅲ),凝膠成像系統(美國 Bio-Rad,型號:GEL DOC2000)。
1.2 模型構建和分組處理 實驗前小鼠適應性飼喂5 d,然后隨機分為4組,每組30只,分別為空白組、TiO2(低、中、高劑量)組,TiO2組每天分別尾部靜脈注射10、50、150 mg/kg的TiO2, 空白組注射10 ml/kg生理鹽水,連續注射2 w。
1.3 檢測指標
1.3.1 體重及肝臟系數 注射給藥2 w后,稱量實驗小鼠體重后,麻醉、處死,取肝臟,吸水紙吸干水分,準確稱量肝臟重量,肝臟系數=肝臟濕重(mg)/體重(g)。
1.3.2 肝功能 上述小鼠處死后,采用摘眼球取血法采集血液,25000 r/min離心10 min分離血清,采用全自動生化分析儀檢測谷丙轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、亮氨酸氨酸肽酶(ALP)、乳酸脫氫酶(LDH)水平。
1.3.3 血清炎癥因子含量 采用上述血清標本,檢測白細胞介素 -6(IL-6)、IL-10、腫瘤壞死因子(TNF-α)、C-反應蛋白(CRP)水平。
1.3.4 肝組織抗氧化酶活性 小鼠處死后,取新鮮肝組織研磨,加入1%聚乙稀吡咯烷酮,5000 r/min離心30 min,取上清液,測定超氧化物歧化酶(SOD),過氧化氫酶(CAT),抗壞血酸過氧化物酶(APx),谷胱甘肽過氧化物酶(GSHPx)活性。
1.3.5 檢測PD-1、PD-L1蛋白表達水平 稱取200 mg肝組織,加入裂解液,超聲裂解30 s,12000 r/min、4℃離心10 min,收集上清,BCA檢測蛋白濃度;待測樣品與Loading buffer混合,加入至制備好的SDS-PAGE 凝膠上樣孔中,25 μl/孔,4 ℃轉膜 1.5 h,采用5%脫脂奶粉封閉PVDF膜2 h,分別加入一抗兔抗小鼠PD-1或兔抗小鼠PD-L1,4℃過夜;TBST洗膜后,加入辣根過氧化物標記的羊抗兔IgG,37℃孕育2 h,ECL顯影,以GAPDH作為內參,采用蛋白免疫印跡法檢測PD-1和PD-L1蛋白水平。
1.4 統計學方法 應用SPSS 16.0統計軟件分析,計量數據以±s表示,組間比較采用方差分析和t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 TiO2對小鼠肝臟系數的影響 空白組、低劑量TiO2組、中劑量TiO2組和高劑量TiO2組的肝臟系數分別為(39.87±4.32)、(51.12±4.78)、(63.81±5.04)和(72.95±5.29)mg/kg,各 TiO2組肝系數均顯著高于空白組(P<0.05),且隨著劑量增加,肝臟系數逐漸增大(P< 0.05)。
2.2 TiO2對小鼠肝功能的影響 各TiO2組血清ALT、AST、ALP、LDH 水平均明顯高于空白組(P<0.05), 且劑量越大,ALT、AST、ALP、LDH 水平越高(P< 0.05,表 1)。
2.3 TiO2對肝組織抗氧化酶活性的影響 各TiO2組肝組織抗氧化酶活性均明顯低于空白組(P<0.05),且劑量越大,肝組織抗氧化酶活性越低(P<0.05,表 2)。
2.4 TiO2對小鼠血清炎癥因子含量的影響 各TiO2組血清炎癥因子含量均明顯高于空白組(P<0.05),且劑量越大,炎癥因子含量越高(P<0.05,表3)。
2.5 TiO2對小鼠肝組織PD-1、PD-L1蛋白表達的影響 與空白組比較,各TiO2組肝組織PD-1、PD-L1蛋白表達水平明顯升高,且呈劑量效應依賴關系(P<0.05,圖 1)。
3 討論
隨著TiO2的廣泛應用,其安全性越來越受重視。TiO2可以通過口腔、鼻腔、皮膚等途徑進入機體,通過血液循環、淋巴轉運在機體的各器官中沉積,如肝腎等,并對器官產生毒性作用。研究表明[4],靜脈注射TiO21 w后,肝臟明顯腫大,肝組織細胞損傷變性,AST和ALT活性上升。本研究采用TiO2構建小鼠肝損傷模型,結果也顯示,TiO2能夠明顯提高肝臟系數,ALT、AST、ALP、LDH 活性明顯升高,且劑量越大,ALT、AST、ALP、LDH 水平越高。

表1 各實驗小鼠肝功能比較(n=30)
正常情況下,機體內ROS產生和清除處于動態平衡,而TiO2會打破平衡,造成ROS大量積累,進而導致過氧化損傷[5]。研究表明[6],TiO2在肝細胞中的積累導致ROS和Cyp1a1的表達水平增加,并抑制CAT等多種過氧化物酶的活性,進而導致肝臟的氧化損傷。本研究結果發現,各TiO2組肝組織抗氧化酶活性均明顯低于空白組(P<0.05),且劑量越大,肝組織抗氧化酶活性越低,提示TiO2能夠使肝臟抗氧化系統遭受破壞,其毒性效果與劑量呈正相關。

表2 各組肝組織抗氧化酶活性比較(n=30)

表3 各組血清炎癥因子含量比較(n=30)
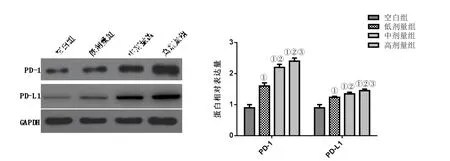
圖1 各組PD-1、PD-L1肝組織PD-1、PD-L1蛋白表達水平比較
文獻報道[7],肝內炎癥反應會導致肝功能障礙,同時還會加重肝臟重構。既往研究結果顯示[8-9],TiO2能顯著激活 MIF、TNF-a、IL-6、IL-1β、CRP、IL-4 和 IL-10等細胞炎癥因子 mRNA和蛋白表達水平。本研究結果也顯示,TiO2會引起 TNF-α、IL-6、IL-10、CRP水平升高,且劑量越大,炎癥因子含量越高,證實TiO2會引起小鼠機體炎癥反應。
文獻報道[10],PD-1/PD-L1信號通路在T細胞活化、增殖、免疫細胞和炎癥因子產生的過程中起重要的作用,該信號通路激活會抑制免疫系統功能,促進免疫耐受。經典的PD-1/PD-L1信號通路活化表現為PD-1在細胞質中增多,進而調節Th1細胞Th2的反應。本研究結果顯示,與空白組比較,各TiO2組肝組織PD-1、PD-L1蛋白表達水平明顯升高,且呈劑量效應依賴關系,提示TiO2對肝細胞的毒性作用可能是通過調節PD-1/PD-L1信號通路實現。
綜上所述,TiO2可能通過PD-1/PD-L通路對小鼠肝細胞產生毒性作用,且其毒性具有劑量效應關系。

