香遠合劑對橋本氏甲狀腺炎大鼠Th1/Th2細胞平衡的影響及意義①
肖新懷
(廣州醫科大學附屬第二醫院,廣州510250)
橋本氏甲狀腺炎是一種比較常見的內分泌疾病以及器官特異性自身免疫性疾病,也稱為自身免疫性甲狀腺炎[1],在橋本氏甲狀腺炎的發病過程中Th1/Th2細胞的免疫失衡發揮重要作用,是Th1占優勢的疾病[2];西醫治療橋本氏甲狀腺炎具有一定效果,但西醫治療副作用大、容易復發,是臨床治療需要解決的難題之一;中醫治療橋本氏甲狀腺炎療效穩定,且無明顯毒副作用,在臨床橋本氏甲狀腺炎治療中得到醫生的認可[3],香遠合劑具有軟堅散結、益氣扶正、養心安神的功效[4],雷公藤在治療自身免疫性疾病上具有較好療效,本文建立實驗性自身免疫甲狀腺炎大鼠模型,以雷公藤作為陽性對照,觀察香遠合劑對其Th1/Th2細胞平衡的影響,探討香遠合劑對橋本氏甲狀腺炎的治療機制。
1 材料與方法
1.1材料 實驗動物:7周齡、雌性、清潔級、體重(140~150)g、大鼠64只,購自北京生命科學研究所,動物許可證號SYXK(京)2015-0002。主要試劑:雷公藤多苷片(湖南千金協力藥業有限公司),香遠合劑(湖北民族學院附屬民大醫院藥房),甲狀腺球蛋白、完全弗氏佐劑、不完全弗氏佐劑(美國Sigma公司),TG-Ab、TPO-Ab、TSH、IFN-γ、IL-10 ELISA試劑盒(天津索羅門生物實驗有限公司),伊紅、蘇木素(中國病理試劑成套中心),IFN-γ、IL-10、β-actin引物(上海生工生物工程公司設計合成),Trizol(美國MBI公司),β-actin抗體、IFN-γ單克隆抗體、IL-10單克隆抗體、HRP標記的山羊抗兔抗體、兔抗人IFN-γ多克隆抗體、兔抗人IL-10多克隆抗體、免疫組化試劑盒、BCA試劑盒(美國Tocris公司)等。
1.2方法
1.2.1動物分組及建立橋本氏甲狀腺炎模型 將64只大鼠根據隨機數字法分為對照組、模型組、雷公藤多苷片組、香遠合劑組,每組16只。模型組、雷公藤多苷片組、香遠合劑組建立動物模型,初次免疫時將甲狀腺球蛋白溶解到生理鹽水中制成濃度為2 mg/ml 的甲狀腺球蛋白溶液,等體積和完全弗氏佐劑混合乳化成油包水制劑,第0天,在大鼠尾根和足墊皮下注射甲狀腺球蛋白(100 μg),對照組大鼠同樣部位注射等量生理鹽水;加強免疫時在第2周,將濃度為2 mg/ml的甲狀腺球蛋白溶液和不完全弗氏佐劑混合制成乳化劑,每只大鼠尾根和足墊皮下注射甲狀腺球蛋白(100 μg),每周1次至第7周,期間給予高碘水(0.64 g/L碘化鈉)喂養,對照組大鼠相同部位注射等量生理鹽水,給予普通飼料和自來水喂養。
1.2.2各組大鼠處理 實驗第6周開始,雷公藤多苷片組給予雷公藤多苷片(將雷公藤多苷片研磨成粉狀并用溫開水制成懸濁液)灌胃(劑量等同人每日用藥量×0.018×5),1次/d至第10周;香遠合劑組大鼠給予香遠合劑(4 ml)灌胃,1次/d至第10周;模型組繼續每周皮下注射造模至第10周。
1.2.3動物取材 實驗結束后處死大鼠,經眼球取血離心后用于血清學檢查;取大鼠甲狀腺組織固定于福爾馬林中進行病理分析。
1.2.4各組大鼠血清抗甲狀腺抗體、甲狀腺功能及血清IFN-γ、IL-10水平測定 采用ELISA法測定各組大鼠血清TG-Ab、TPO-Ab、TSH、IFN-γ、IL-10水平(實驗步驟按照試劑盒說明書進行)。
1.2.5各組大鼠甲狀腺組織HE染色 將各大鼠甲狀腺標本常規脫水、透明、浸蠟,石蠟包埋后切成厚 4 μm切片,常規進行HE染色,顯微鏡下觀察染色情況。
1.2.6各組大鼠甲狀腺組織免疫熒光染色 將甲狀腺切片于多聚甲醛固定液中固定4 h,PBS漂洗3次,加入小鼠抗CD45R(1∶500),于4℃孵育過夜。二抗采用Aleax 555標記的羊抗鼠IgG(1∶500),孵育30 min。于激光共聚焦顯微鏡拍照成像。
1.2.7各組大鼠甲狀腺組織IFN-γ、IL-10 mRNA水平測定 將各大鼠甲狀腺組織勻漿后,12 000 g離心15 min,取上清液提取甲狀腺組織總RNA,采用RT-PCR法測定大鼠甲狀腺組織IFN-γ、IL-10 mRNA水平,β-actin為內參對照,反應條件為94℃ 3 min;94℃ 45 min、46℃ 45 min、72℃ 45 min,共32個循環;72℃ 5 min。采用四星凝膠圖像分析系統對IFN-γ、IL-10、β-actin產物條帶密度進行半定量分析。
1.2.8各組大鼠甲狀腺組織IFN-γ、IL-10蛋白水平測定 提取各組大鼠甲狀腺組織總蛋白質,采用BCA法測定甲狀腺組織總蛋白質濃度,采用Western blot測定甲狀腺組織IFN-γ、IL-10蛋白水平。目標蛋白相對表達量=目標蛋白條帶灰度值/β-actin條帶灰度值。
1.2.9各組大鼠甲狀腺組織IFN-γ、IL-10免疫組化染色 采用免疫組化SP法染色測定,具體操作嚴格按照說明書進行。陽性細胞為細胞中出現黃褐色或棕黃色顆粒,采用捷達801形態分析軟件對結果進行平均光密度、灰度值、陽性面積進行測定,并計算相對表達量。

2 結果
2.1各組大鼠抗甲狀腺抗體、TSH和細胞因子水平比較 各組大鼠TG-Ab、TPO-Ab、TSH、IFN-γ、IL-10、IFN-γ/IL-10比較差異均有統計學意義(P<0.05)。與對照組比較,模型組、雷公藤多苷片組、香遠合劑組TG-Ab、TPO-Ab、IFN-γ、IFN-γ/IL-10升高(P<0.05),TSH、IL-10水平降低(P<0.05);與模型組比較,雷公藤多苷片組、香遠合劑組TG-Ab、TPO-Ab、IFN-γ、IFN-γ/IL-10降低(P<0.05),TSH水平、IL-10升高(P<0.05);與雷公藤多苷片組比較,香遠合劑組TG-Ab、TPO-Ab、IFN-γ、IFN-γ/IL-10降低(P<0.05),TSH、IL-10水平升高(P<0.05)。見表1。
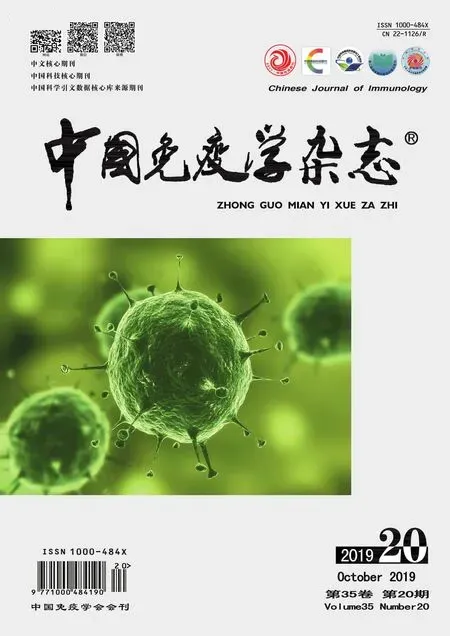
2.2各組大鼠甲狀腺組織HE染色比較 對照組大鼠甲狀腺濾泡呈橢圓形或圓形,未見漿細胞和淋巴細胞浸潤;模型組大鼠甲狀腺濾泡排列紊亂,被大量破壞,濾泡周圍有淋巴細胞浸潤,濾泡內有漿細胞浸潤;雷公藤多苷片組濾泡破壞減少,濾泡內及濾泡周圍漿細胞和淋巴細胞浸潤減少;香遠合劑組大鼠甲狀腺濾泡較雷公藤多苷片組減少,漿細胞和淋巴細胞浸潤較雷公藤多苷片組減少。見圖1。
本研究顯示建模大鼠甲狀腺自身抗體水平升高,甲狀腺組織出現淋巴細胞浸潤和濾泡結構破壞,表明建模成功。
2.3各組大鼠甲狀腺組織CD45R免疫熒光染色結果 為了進一步證實甲狀腺組織存在淋巴細胞浸潤,利用抗大鼠CD45R抗體行免疫熒光染色,結果顯示,與對照組相比,模型組大鼠CD45R表達顯著增加。與模型組相比,雷公藤多苷片組和香遠合劑組大鼠CD45R表達明顯減少。見圖2。
2.4各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10 mRNA比較 各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10 mRNA比較差異均有統計學意義(P<0.05)。與對照組比較,模型組、雷公藤多苷片組、香遠合劑組IFN-γ、IFN-γ/IL-10 mRNA表達升高(P<0.05),IL-10 mRNA表達降低(P<0.05);與模型組比較,雷公藤多苷片組、香遠合劑組IFN-γ、IFN-γ/IL-10 mRNA表達降低(P<0.05),IL-10 mRNA升高(P<0.05);與雷公藤多苷片組比較,香遠合劑組IFN-γ、IFN-γ/IL-10 mRNA表達降低(P<0.05),IL-10 mRNA表達升高(P<0.05)。見表2。
2.5各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10蛋白表達比較 Western blot結果顯示,各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10蛋白表達比較差異均有統計學意義(P<0.05)。與對照組比較,模型組、雷公藤多苷片組、香遠合劑組IFN-γ、IFN-γ/IL-10蛋白表達升高(P<0.05),IL-10蛋白表達降低(P<0.05);與模型組比較,雷公藤多苷片組、香遠合劑組IFN-γ、IFN-γ/IL-10蛋白表達降低(P<0.05),IL-10 蛋白表達升高(P<0.05);與雷公藤多苷片組比較,香遠合劑組IFN-γ、IFN-γ/IL-10 蛋白表達降低(P<0.05),IL-10蛋白表達升高(P<0.05)。見表3和圖3。
圖1 各組大鼠甲狀腺組織HE染色(×200)Fig.1 HE staining of thyroid tissue in each group of rats (×200)Note: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
表1 各組大鼠抗甲狀腺抗體、TSH和細胞因子水平比較
Tab.1 Comparison of antithyroid antibody,TSH and cytokine levels in each group
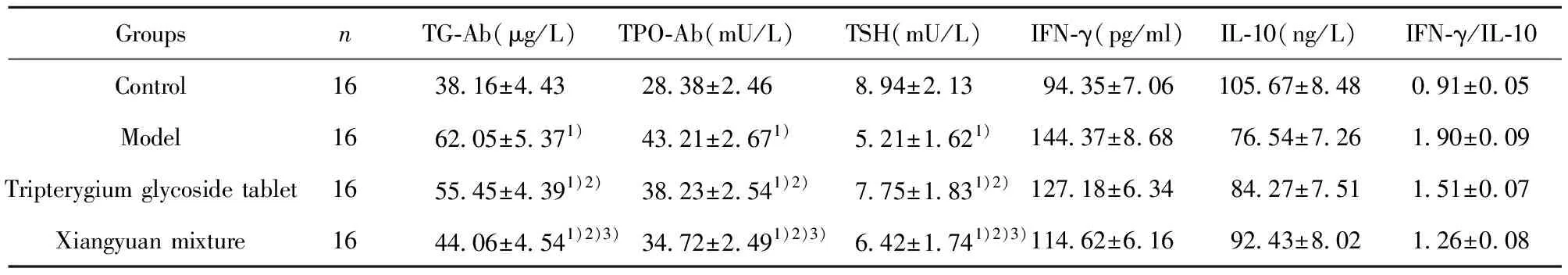
GroupsnTG-Ab(μg/L)TPO-Ab(mU/L)TSH(mU/L)IFN-γ(pg/ml)IL-10(ng/L)IFN-γ/IL-10Control1638.16±4.4328.38±2.468.94±2.1394.35±7.06105.67±8.480.91±0.05Model1662.05±5.371)43.21±2.671)5.21±1.621)144.37±8.6876.54±7.261.90±0.09Tripterygium glycoside tablet1655.45±4.391)2)38.23±2.541)2)7.75±1.831)2)127.18±6.3484.27±7.511.51±0.07Xiangyuan mixture1644.06±4.541)2)3)34.72±2.491)2)3)6.42±1.741)2)3)114.62±6.1692.43±8.021.26±0.08
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.
表2 各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10 mRNA比較
Tab.2 Comparison of IFN-γ,IL-10 and IFN-γ/IL-10 mRNA in thyroid tissue of rats in each group

GroupsnIFN-γIL-10IFN-γ/IL-10Control160.32±0.070.63±0.110.51±0.06Model160.81±0.121)0.27±0.081)3.01±0.091)Tripterygium glycoside tablet160.64±0.091)2)0.39±0.071)2)1.64±0.101)2)Xiangyuan mixture160.49±0.081)2)3)0.52±0.101)2)3)0.94±0.081)2)3)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.
表3 各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10蛋白比較(Western blot)
Tab.3 Comparison of IFN-γ,IL-10 and IFN-γ/IL-10 protein in thyroid tissue of each group of rats (Western blot)
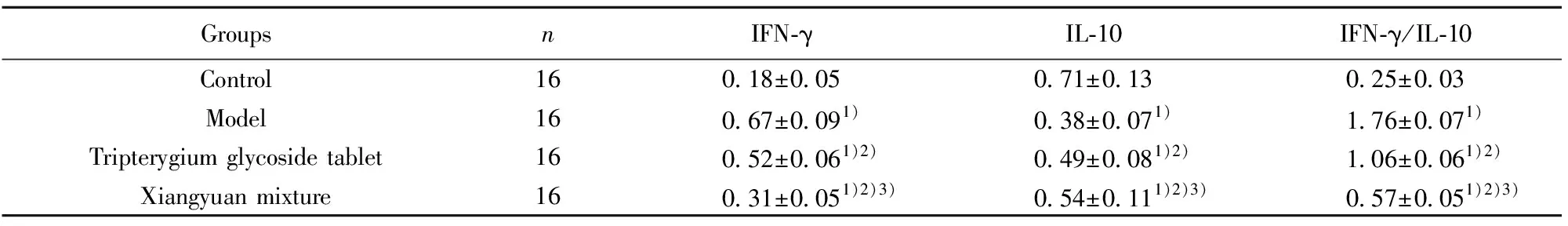
GroupsnIFN-γIL-10IFN-γ/IL-10Control160.18±0.050.71±0.130.25±0.03Model160.67±0.091)0.38±0.071)1.76±0.071)Tripterygium glycoside tablet160.52±0.061)2)0.49±0.081)2)1.06±0.061)2)Xiangyuan mixture160.31±0.051)2)3)0.54±0.111)2)3)0.57±0.051)2)3)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.

圖2 各組大鼠甲狀腺組織CD45R染色結果(×200)Fig.2 Immunofluorescent staining of thyroid tissue in each group of rats (×200)Note: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
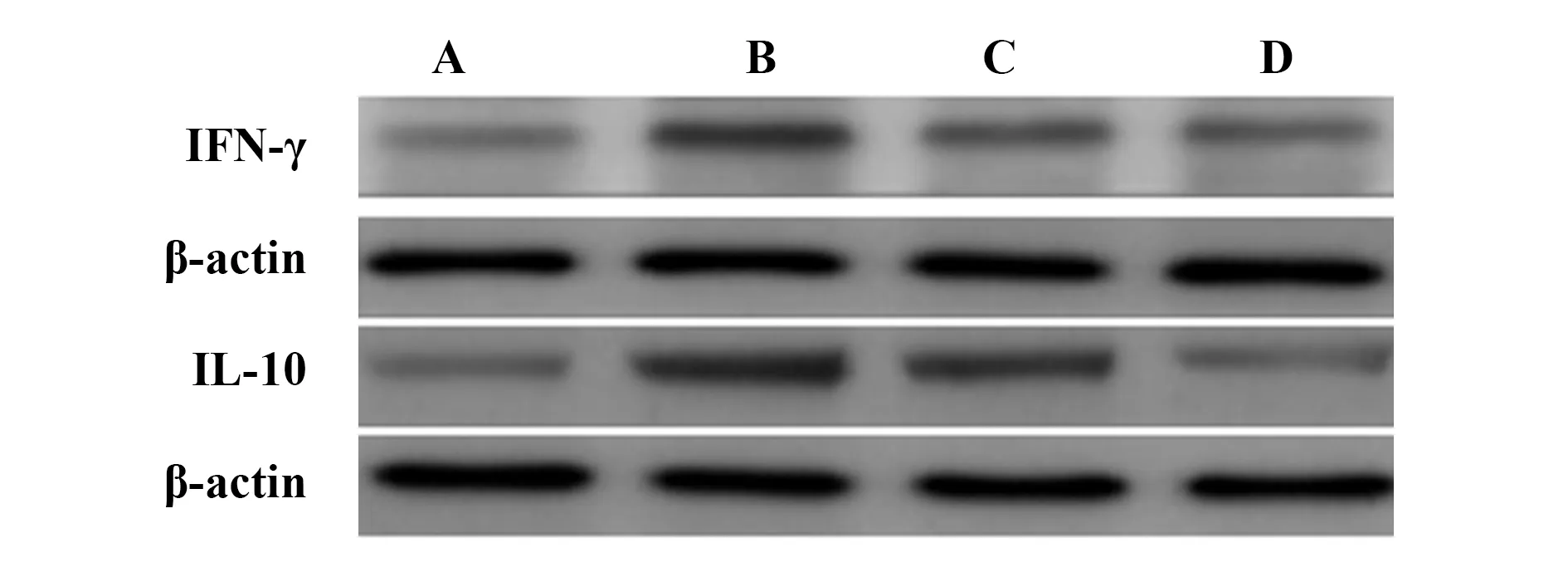
圖3 3各組大鼠甲狀腺組織IFN-γ蛋白、IL-10蛋白Western blot電泳圖Fig.3 3 Western blot analysis of IFN-γ protein and IL-10 protein in thyroid tissue of rats in each groupNote: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
2.6各組大鼠甲狀腺組織IFN-γ、IL-10蛋白免疫組化染色 免疫組化結果顯示,IFN-γ、IL-10蛋白陽性為細胞胞漿中出現黃褐色或棕黃色顆粒,模型組大鼠IFN-γ 染色最深,其次為雷公藤多苷片組,再次為香遠合劑組,對照組IFN-γ染色最弱;模型組大鼠IL-10染色最弱,其次為雷公藤多苷片組,再次為香遠合劑組,對照組IL-10染色最深,見圖4、圖5。各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10蛋白相對表達量比較差異均有統計學意義(P<0.05)。與對照組比較,模型組、雷公藤多苷片組、香遠合劑組IFN-γ、IFN-γ/IL-10蛋白相對表達量升高(P<0.05),IL-10蛋白相對表達量降低(P<0.05);與模型組比較,雷公藤多苷片組、香遠合劑組IFN-γ、IFN-γ/IL-10蛋白相對表達量降低(P<0.05),IL-10蛋白相對表達量升高(P<0.05);與雷公藤多苷片組比較,香遠合劑組IFN-γ、IFN-γ/IL-10 蛋白相對表達量降低(P<0.05),IL-10 蛋白相對表達量升高(P<0.05)。見表4。
表4 各組大鼠甲狀腺組織IFN-γ、IL-10、IFN-γ/IL-10蛋白相對表達量比較(免疫組化染色)
Tab.4 Comparison of IFN-γ,IL-10 and IFN-γ/IL-10 protein relative expressin in thyroid tissue of each group of rats (immunohistochemical staining)

GroupsnIFN-γIL-10IFN-γ/IL-10Control group167.21±0.8514.63±1.740.49±0.21Model group1618.96±2.311)3.21±0.671)5.91±1.381)Tripterygium glycoside tablet group1614.35±1.421)2)6.78±1.121)2)2.12±0.821)2)Xiangyuan mixture group1611.73±1.161)2)3)10.96±1.311)2)3)1.07±0.471)2)3)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with tripterygium glycosides group,3)P<0.05.
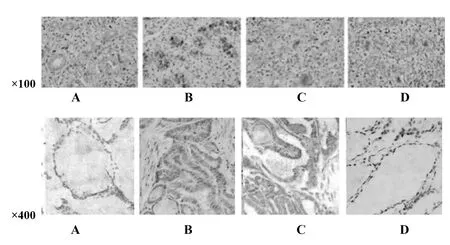
圖4 各組大鼠甲狀腺組織中IFN-γ 免疫組化染色Fig.4 IFN-γ immunohistochemical staining in thyroid tissue of each group of ratsNote: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
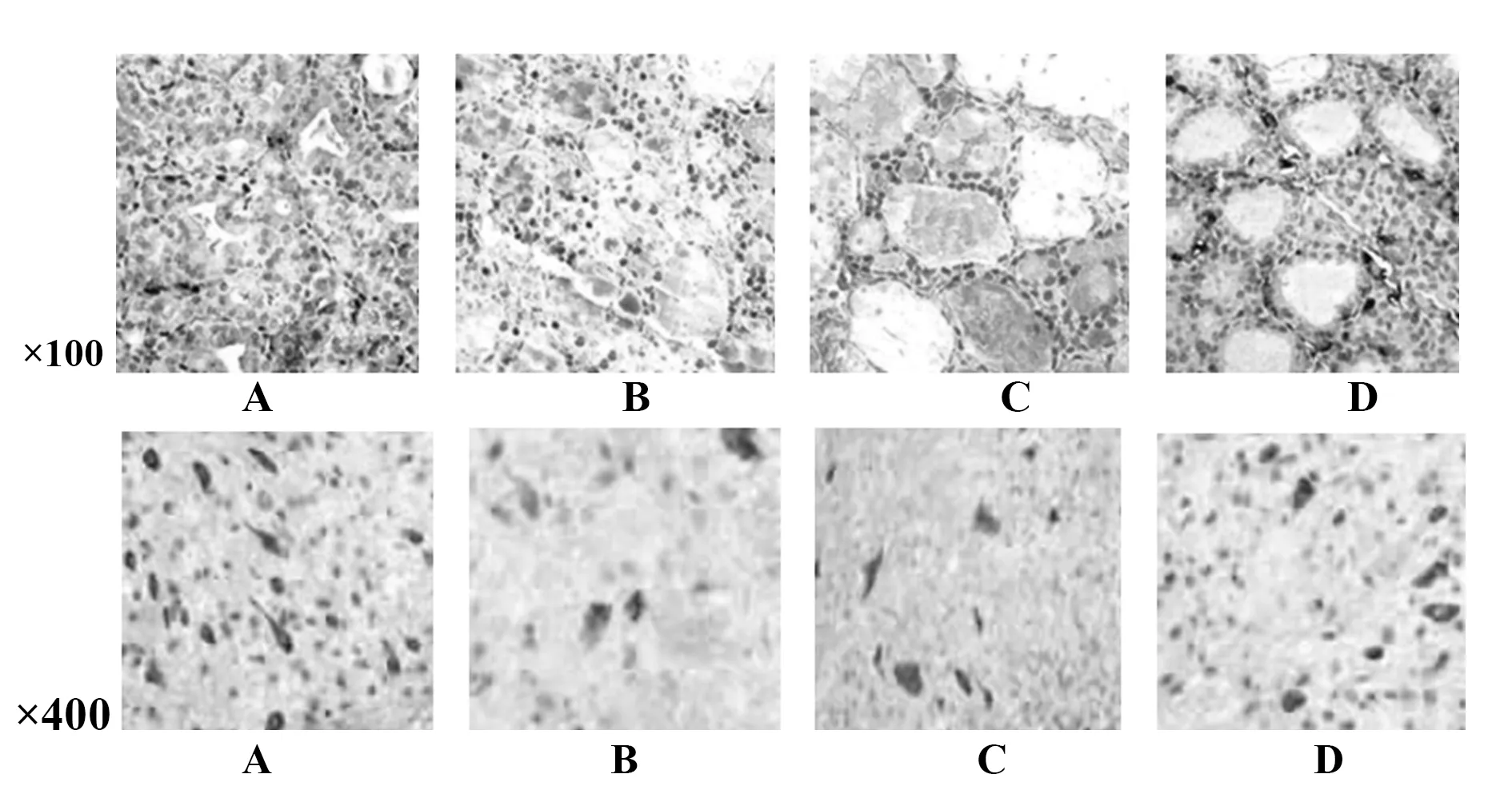
圖5 各組大鼠甲狀腺組織中IL-10免疫組化染色Fig.5 Immunohistochemical staining of IL-10 in thyroid tissue of each group of ratsNote: A.Control group;B.Model group;C.Tripterygium glycoside tablet group;D.Xiangyuan mixture group.
3 討論
橋本氏甲狀腺炎和實驗性自身免疫性甲狀腺炎具有相同的病理學基礎和臨床表現,典型的病理特征包括甲狀腺內有彌漫的漿細胞、淋巴細胞、巨噬細胞浸潤以及產生特異性的TG-Ab、TPO-Ab抗體,最終引起甲狀腺濾泡的破壞。本研究通過建立實驗性自身免疫性甲狀腺炎大鼠模型,發現建模大鼠甲狀腺濾泡被破壞,出現大量漿細胞和淋巴細胞浸潤,血清TG-Ab、TPO-Ab抗體水平顯著升高,表明自身免疫性甲狀腺炎大鼠模型建立成功。
祖國醫學認為橋本氏甲狀腺炎歸屬“癭病”范疇,發病機制和飲食水土、情志失調、體質因素等有關,橋本氏甲狀腺炎的氣虛血瘀、氣滯痰凝、肝郁化火等病理機制導致血瘀、痰凝、氣滯壅結于頸前引起該病的發病[5],根據中醫理論將中藥結合當地民族藥物組方研制成香遠合劑,香遠合劑包括172味中藥,具有軟件散結、益氣扶正、養心安神的功效[6],在臨床橋本氏甲狀腺炎的治療中具有較好效果[7]。雷公藤多苷片具有較好的抑制炎癥反應、調節體液免疫和細胞免疫的作用,在治療自身免疫性疾病中療效顯著[8]。本文通過建立實驗性自身免疫性甲狀腺炎大鼠模型,給予香遠合劑治療,并以雷公藤多苷片為陽性對照,發現香遠合劑和雷公藤多苷片治療橋本氏甲狀腺炎療效均顯著,可使甲狀腺濾泡組織基本恢復正常,淋巴細胞和漿細胞浸潤程度明顯降低,血清TG-Ab、TPO-Ab抗體水平降低,甲狀腺功能異常有所恢復,但與雷公藤多苷片比較,香遠合劑的治療效果更加顯著。本研究證實了香遠合劑對橋本氏甲狀腺炎的治療效果顯著。
香遠合劑通過何種機制治療橋本氏甲狀腺炎尚不十分清楚,尚待進一步研究。橋本氏甲狀腺炎是由于抑制性T細胞存在遺傳性缺陷、輔助性T細胞和抗原結合抵抗甲狀腺上皮細胞,誘導細胞介導、抗體依賴的細胞毒作用的免疫機制,在橋本氏甲狀腺炎發病過程中Th1細胞因子亢進、占據優勢,Th1/Th2細胞平衡失調具有重要作用[9,10]。T淋巴細胞分為CD4和CD8 T淋巴細胞兩大亞群,正常情況下,CD4 T淋巴細胞處于前體狀態,表達少量的IL-2,當特異性抗原刺激抗原遞呈細胞后誘導其成為前體細胞,在細胞因子的作用下分化為Th1細胞和Th2細胞,Th1細胞分泌IFN-γ、IL-2、TNF-α等細胞因子介導細胞免疫;Th2細胞分泌IL-4、IL-10等細胞因子介導體液免疫,Th1/Th2細胞平衡反映機體免疫傾向,兩者在正常情況下相互調節、相互抑制,處于動態平衡狀態,維持正常的細胞和體液免疫,當兩者之間的平衡被打破時可引起橋本氏甲狀腺炎的發生[11]。IFN-γ為Th1細胞因子,可增強甲狀腺上皮細胞表達HLA-Ⅱ類抗原的表達,該抗原表達可使甲狀腺細胞轉化為抗原遞呈細胞,激活CD4 T淋巴細胞IL-2受體,并引起IL-2細胞因子分泌釋放,IL-2細胞因子激活分泌其他細胞因子,趨化大量T淋巴細胞和單核細胞進入甲狀腺內增加細胞毒性作用,從而誘導B細胞分化成熟并促進自身抗體產生[12-14]。IL-10為一種Th2型細胞因子,在細胞免疫過程中發揮負向調節因子作用,IL-10在甲狀腺組織浸潤的單核細胞和淋巴細胞內,表達量隨著免疫疾病的進展而減少,免疫疾病越嚴重,IL-10表達量越低,在終末期橋本氏甲狀腺炎患者的甲狀腺組織中幾乎沒有IL-10細胞因子的表達[15-17]。本研究中自身免疫性甲狀腺炎的模型大鼠的血清和腦組織IFN-γ、IFN-γ/IL-10升高,IL-10水平下降,表明自身免疫性甲狀腺炎大鼠模型存在Th1/Th2細胞平衡失調;香遠合劑治療后大鼠血清和腦組織IFN-γ、IFN-γ/IL-10下降,IL-10水平升高。分析香遠合劑治療橋本氏甲狀腺炎機制可能為通過糾正Th1/Th2細胞平衡失調在橋本氏甲狀腺炎的治療中發揮作用。