‘西拉’葡萄果實發育過程中糖代謝相關基因的表達分析
權桂蓉,惠竹梅,
(1.西北農林科技大學 葡萄酒學院,陜西楊凌 712100;2.陜西省葡萄與葡萄酒工程中心,陜西楊凌 712100)
糖類是果實生長發育的物質基礎,是果實品質成分和風味物質等合成的基礎原料;糖還作為信號分子,與激素、N等信號聯成網絡,通過復雜的信號轉導機制調節植物生長發育與基因表達[1-2]。葡萄果實中的可溶性糖主要包括葡萄糖和果糖,蔗糖的質量分數很少,糖類物質的代謝及其變化決定了成熟葡萄果實中的糖類組成和質量分數。葡萄葉片作為源組織通過光合作用合成糖類物質,糖類物質以蔗糖的形式經過韌皮部長距離運輸至庫組織——葡萄漿果中,蔗糖的運輸主要依靠蔗糖轉運蛋白(sucrose transporter,SUT)[3]。隨后蔗糖在轉化酶的作用下水解成葡萄糖和果糖后運輸進入中果皮細胞的液泡中儲存,糖分積累主要受糖代謝關鍵酶,包括轉化酶(Invertase,Ivr)、蔗糖合成酶(Sucrose synthase,SS)和蔗糖磷酸合成酶(Sucrose phosphate,SPS)的調控[4]。糖分進入液泡積累須跨越質膜和液泡膜,位于膜上的糖運輸蛋白在介導糖向韌皮部裝載、從韌皮部卸出及運輸進入果實細胞和液泡中貯藏和代謝等決定光合產物分配的跨膜運輸進程中起重要作用[5]。現已從葡萄果實中鑒定出6個單糖運輸蛋白cDNA、VvHT1-6、以及3個蔗糖運輸蛋白cDNA、VvSUC11、VvSUC12和VvSUC27[6-7]。
Zhang等[8]研究表明,在葡萄果實發育過程中,前期可溶性糖的積累很慢,果實韌皮部卸載方式為共質體卸載;進入轉色期以后,大量的糖轉運到葡萄漿果果皮細胞,己糖開始迅速積累,果實韌皮部卸載轉化為質外體卸載。葡萄果實在轉熟之前,己糖主要用于代謝;轉熟之后,己糖主要用于積累;果實中糖的積累首先取決于漿果內在遺傳特性[9]。
盡管已有研究表明酸性轉化酶、蔗糖合成酶、蔗糖磷酸合成酶和糖轉運蛋白與葡萄果實糖積累有關,但由于葡萄品種間的差異,‘西拉’葡萄果實糖積累的分子機制還不清楚。‘西拉’葡萄果實發育過程中可溶性糖的積累與糖代謝有關的基因表達量關系的研究尚未見報道。因此,本研究通過設計實時熒光定量PCR引物,研究‘西拉’葡萄進入轉色期以后,與糖代謝相關的15個基因和可溶性糖在葡萄果實發育過程中的變化規律,為揭示‘西拉’葡萄果實中可溶性糖代謝與積累的分子機制和葡萄果實品質的調控機制奠定研究基礎。
1 材料與方法
1.1 試驗材料
試驗于2017年7月13日-8月30日在山西省襄汾縣堯京酒莊(111.57°E,35.92°N)進行,該地區屬半干旱、半濕潤季風氣候區,年均氣溫為9.0~12.9 ℃,全年日照數平均為1 748~2 513 h,無霜期為127~280 d,年均降水量為420.1~550.6 mm。試材為‘西拉’(Syrah)葡萄,植株定植于2012年,東西行向栽培,株行距為1 m× 3 m,斜拉“廠”字形單籬架,半機械化管理,冬季埋土防寒。
1.2 試驗設計
2017年7月13日‘西拉’葡萄進入轉色期進行第1次采樣,直至果實成熟共采樣5次(分別對應花后57 d、64 d、71 d、85 d、100 d)。“Z”字形采樣,南北方向兼顧,采用穗采方式,6穗為1個重復,設置3個重復。再采用粒采的方式,兼顧每穗葡萄的各部位采集葡萄80粒,放于液氮中速凍,隨后儲存于-80 ℃冰箱中,用于表達量的測定。其余果實置于-20 ℃冰箱中儲存,用于生理指標的測定。
1.3 測定指標及方法
1.3.1 還原糖和總酸質量濃度 用斐林試劑滴定法測定還原糖質量濃度,結果以葡萄糖計;用氫氧化鈉直接滴定法測定總酸質量濃度,結果以酒石酸計。
1.3.2 果皮酚類物質質量分數 酚類物質的提取采用Di等[10]的方法并稍做修改。分離果皮,擦干并稱量,放入50 mL離心管中,加入30 mL提取液(體積分數12%乙醇,600 mg/L焦亞硫酸鈉,5 g/L酒石酸,蒸餾水,用1 mol/L NaOH調節pH至3.20)。在25 ℃搖床中避光提取3 d,分離上清液并記錄體積為30 mL, -20 ℃避光保存,以備總花色苷、單寧和總酚的測定。
總酚的測定按照福林酚法Folin-Ciocalteus[11]進行,結果以沒食子酸表示(mg/g);花色苷的測定采用pH示差法[12],以錦葵色素-3-葡萄糖苷(CGE,mg/L)表示;單寧用蛋白質沉淀法測定[11-12],以兒茶素計(mg/g)。
1.3.3 可溶性糖質量分數的測定 可溶性糖的提取參照徐凡等[15]的方法并加以改進,取果實加液氮研磨后稱取3 g,加入6 mL 80%的乙醇, 35 ℃下提取20 min,6 500 r/min下離心15 min,取上清液。重復提取3次,合并上清液,定容至20 mL。取1 mL于旋轉蒸發儀蒸干(35 ℃)后,用1 mL重蒸水溶解,0.22 μm水系濾頭過濾后,采用島津LC-30A超高效液相色譜進行測定。色譜條件:色譜柱為ZORBAX Carbohydrate(4.6 150 mm,5 μm);流動相為乙腈∶水=80∶20(體積比);流速1.2 mL/min;進樣量20 L;柱溫 40 ℃;示差折光檢測器。試驗所用葡萄糖和果糖標準品購自Sigma公司。
1.4 數據處理
使用Excel 2016對試驗數據進行整理和計算,使用SPSS 20.0軟件進行方差及顯著性分析,使用Origin 2016軟件繪圖。所有指標均重復測定3次,取平均值。
2 結果與分析
2.1 ‘西拉’葡萄果實生長發育過程中糖酸質量濃度的變化
‘西拉’葡萄生長發育過程中還原糖及總酸質量濃度的變化見圖1。還原糖質量濃度在果實成熟的整個階段整體呈現先升高后趨于穩定的趨勢。隨著果實的成熟可滴定酸的質量濃度快速降低,隨后趨于穩定。成熟期可滴定酸的質量濃度為5.2 g/L。
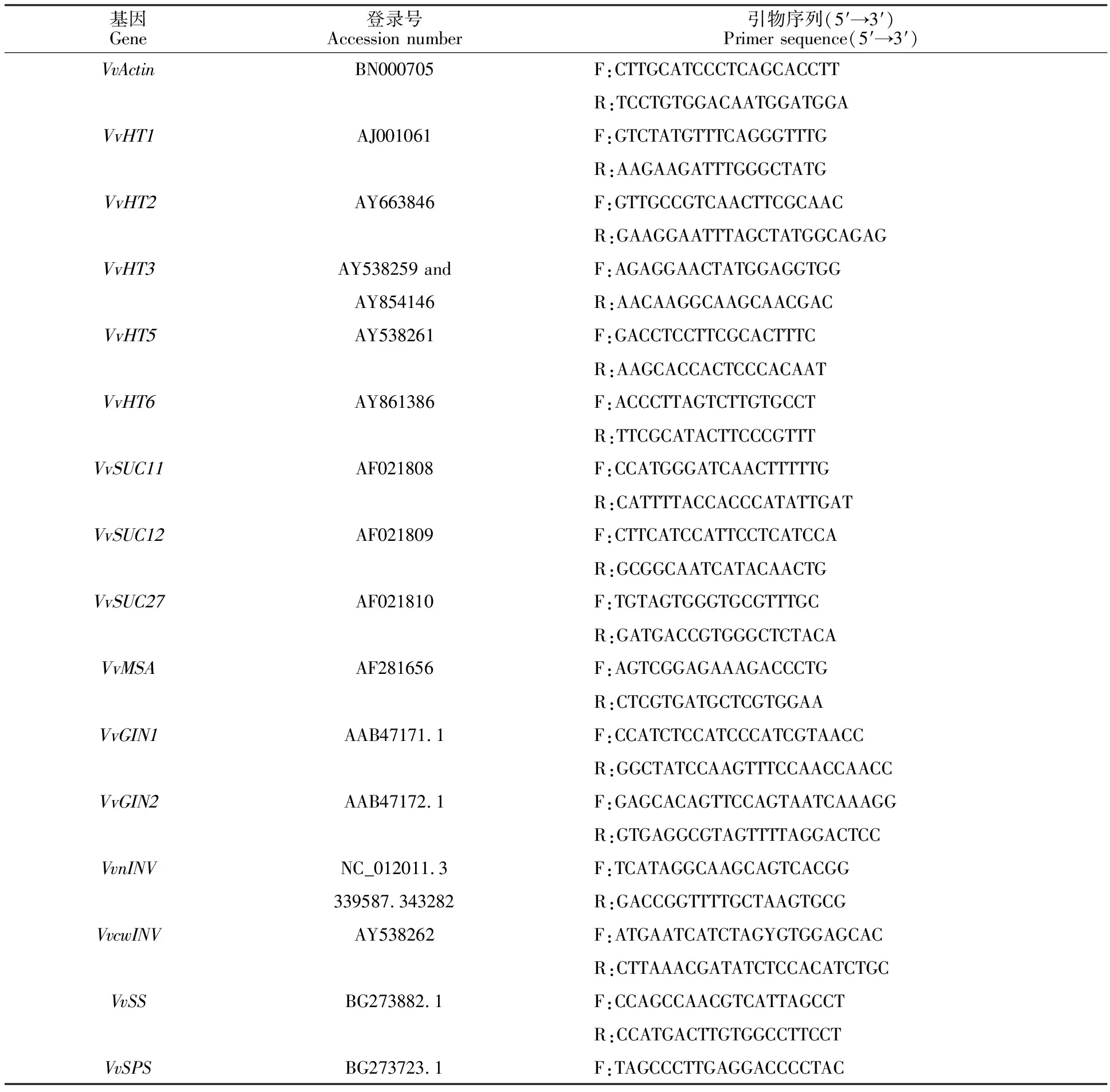
表1 實時熒光定量PCR引物序列Table 1 Primers of real-time quantitative PCR

圖1 ‘西拉’葡萄果實發育過程中糖酸質量濃度Fig.1 Sugar and total acid during‘Syrah’ grapes development
2.2 ‘西拉’葡萄果實生長發育過程中葡萄果皮總酚、單寧和花色苷質量分數的變化
酚類物質是反映葡萄果實品質和葡萄酒質量的重要次級代謝產物。圖2顯示,總酚質量分數在花后57~64 d有所降低,花后64~71 d緩慢上升,花后71~85 d迅速上升,隨后又迅速降低。單寧的質量分數在花后57~64 d較穩定,花后 63~100 d呈下降的趨勢。總花色苷在花后57~64 d的積累較慢,在花后64~71 d快速積累,隨后保持穩定。

圖2 ‘西拉’葡萄果實發育過程中的總酚、單寧和花色苷質量分數Fig.2 Mass fraction of total phenol, tannin and anthocyanin during ‘Syrah’ grapes development
2.3 ‘西拉’葡萄果實生長發育過程中果實可溶性糖質量濃度的變化
‘西拉’葡萄果實發育過程中葡萄糖和果糖質量濃度的變化如圖3所示。葡萄糖和果糖質量濃度整體呈增加的趨勢。葡萄糖的質量濃度在花后57~71 d迅速升高,在花后71~100 d趨于穩定。果糖質量濃度的變化趨勢與葡萄糖一致。葡萄糖質量濃度在果實發育的各個時期均大于果糖。
2.4 ‘西拉’葡萄果實生長發育過程中果實糖代謝相關基因表達水平的變化
對‘西拉’葡萄果實中15個基因表達量進行檢測,包括5個單糖運輸蛋白合成基因(VvHT1-3,VvHT5-6),1個ASR家族基因(VvMSA), 3個蔗糖運輸蛋白合成基因(VvSUC11,VvSUC12,VvSUC27)以及6個蔗糖代謝酶合成基因(VvcwINV,VvnINV,VvSS,VvSPS,VvGIN1,VvGIN2)。
2.4.1 葡萄果實單糖運輸蛋白合成基因及VvMSA基因表達量變化趨勢 通過實時熒光定量PCR(qRT-PCR)檢測,轉色后葡萄果實單糖轉運蛋白合成基因的表達如圖4所示。隨著葡萄果實成熟,VvHT1的表達量在花后57~71 d較高,隨后急劇下降,在花后85 d表達量呈現最低值,然后到采收期即花后100 d略有回升。VvHT2的表達量在花后57 d較低,之后快速升高,在花后71 d表達量達到最大值,之后略有降低并趨于穩定。VvHT3的相對表達量在果實成熟過程中有明顯的波動,先降低再升高到最大值,隨后又降低并維持穩定,在花后71 d表達量達到最大值。VvHT5的表達量呈上升的趨勢,在花后57~71 d較低,在花后85 d迅速升高,花后 100 d達到最大值。VvHT6的表達表現為先升高后降低再升高,在花后64 d時表達量最高,花后85 d最低,其他3個時期表達量大致相同。VvMSA可調控VvHT1表達,它是ASR(ABA,脅迫和成熟誘導)蛋白家族成員。在葡萄成熟過程中,VvMSA的表達呈現先升高后降低的趨勢。花后71 d時,VvMSA的表達量最高。

圖3 ‘西拉’葡萄果實果實發育過程中可溶性糖質量濃度Fig.3 Mass concentration of soluble sugars during ‘Syrah’ grapes development
2.4.2 葡萄果實蔗糖運輸蛋白合成基因表達量變化趨勢 蔗糖轉運蛋白基因的表達如圖5所示。VvSUC11整體呈上調的表達趨勢。花后 57~71 d,VvSUC11的表達量維持在穩定的較低水平,花后85 d,VvSUC11的表達量迅速增加,并維持在同一水平至花后100 d。VvSUC12的表達水平在葡萄轉色至成熟的整個階段存在波動,表達量先降低,在花后64 d的表達量最低,之后再升高,在花后85 d達到最高水平后,至花后100 d又降低。VvSUC27的表達整體呈下調趨勢。在花后57 d的相對表達量較高,之后迅速降低,至成熟期,VvSUC27相對表達水平最低。

圖4 ‘西拉’葡萄果實單糖轉運蛋白合成基因及VvMSA基因表達量Fig.4 Relative expression changes of monosaccharide transporters and VvMSAin‘Syrah’ grapes

圖5 ‘西拉’葡萄果實蔗糖轉運蛋白合成基因表達量Fig.5 Relative expression changes of sucrose transporters in ‘Syrah’ grapes
2.4.3 葡萄果實中蔗糖代謝相關酶基因表達量的變化趨勢 圖6顯示,VvGIN1整體呈下調的表達模式。在轉色初期即花后57 d,表達量最高,隨后表達量逐漸降低,至成熟期即花后100 d,VvGIN1的表達量最低。VvGIN2的表達量呈先升高后降低的趨勢,花后71~85 d的表達量較高,在成熟期的表達量最低。VvSS的表達量呈先升高再降低再升高的趨勢,花后57~85 d的表達量較低,成熟期即花后100 d 的表達量最高。VvSPS的表達量在果實成熟過程中呈先升高后降低的趨勢,在花后57~71 d,以及花后100 d的表達量較低,在花后85 d表達量最高。VvnINV在花后57 ~71 d的表達水平趨于穩定,隨后逐漸降低,在花后100 d的表達量最低。VvcwINV整體呈上調的表達趨勢。花后57~71 d,VvcwINV的表達量較低,隨后迅速升高,至成熟期其表達量最高。
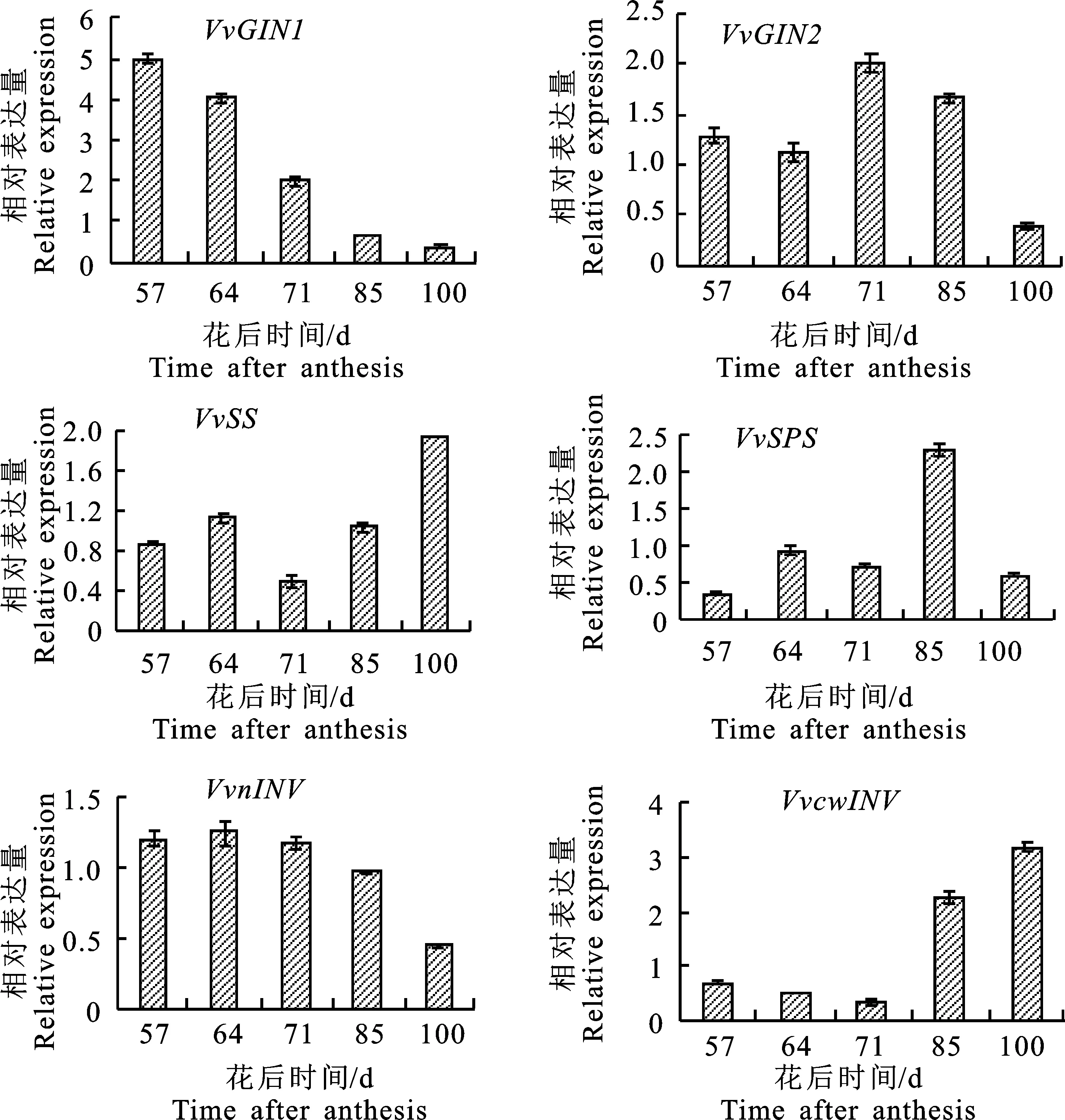
圖6 ‘西拉’葡萄果實編碼蔗糖代謝相關酶基因表達量Fig.6 Relative expression changes of related genes encoding sucrose metabolic enzymes in ‘Syrah’ grapes
3 討論與結論
果實中可溶性糖的組分、質量分數及其比例在很大程度上決定了果實的品質與風味,研究葡萄果實中可溶性糖的種類及代謝,可以為調控果實糖代謝、提高果實以及葡萄酒品質及進一步開展相關研究提供理論依據。果實糖積累水平最終取決于相關基因的表達與調控,糖代謝的過程非常復雜,由多個基因表達及相關酶綜合調控,因此明確葡萄果實生長發育過程中糖代謝相關基因表達對于研究釀酒葡萄糖代謝及提高葡萄品質十分必要。本研究中,‘西拉’葡萄果實糖積累主要為葡萄糖和果糖,其質量分數隨著葡萄果實的發育而不斷升高,葡萄糖質量分數始終高于果糖。
近年來,參與葡萄糖代謝的相關酶和基因引起許多研究者的關注。隨著分子生物學技術的快速發展,葡萄果實中編碼細胞壁酸性轉化酶(VvcwINV)和液泡酸性轉化酶(VvGIN1、VvGIN2)的基因已經被克隆[13]。各種單糖和蔗糖運輸蛋白共同承擔著果實中糖類物質的跨膜運輸[14],同時它們的表達具有時空特異性,不同生長時期的表達水平不同。
己糖運輸蛋白參與果實糖類從質外體運輸進入果肉細胞的過程,己糖運輸蛋白基因的表達與庫組織從質外體卸載運輸糖類物質關系密切[15]。對‘西拉’葡萄果實中5個單糖運輸蛋白基因的表達分析表明,這幾個基因在成熟過程中被差異表達。有研究發現,VvHT基因的表達與己糖的積累沒有直接聯系,表明轉錄水平不是轉運活性的主要決定因素,或者其他轉運途徑也很活躍[13]。一種可能的解釋是,糖類在成熟葡萄漿果中的運輸不受基因轉錄水平的調節,而是受到轉錄后調節[16]。Conde等[17],Céline等[18]的研究表明葡萄細胞培養物中VvHT1的轉錄水平受到葡萄糖的抑制,表明VvHT1可能不會介導轉色后糖類輸送至漿果細胞的過程,但VvHT1在幼果期的表達水平很高,表明VvHT1可能參與了細胞分裂和生長的能量供應[17-18]。Fillion等[19]的研究表明,VvHT2基因的表達與漿果己糖積累起始及快速升高同時發生,而VvHT1的表達與果實含糖量的增加沒有密切關系。本研究中,VvHT1的表達水平在轉色期較高,在成熟后期的表達較低,VvHT2與之相反。VvHT3的表達模式與VvMSA相似,在花后71 d的表達量最高,其他幾個時期均較低。VvHT5的表達在轉色期至成熟中期較低,在成熟后期的表達水平很高。各基因的表達模式存在差異,表明在不同生長時期,可能是由不同的基因發揮作用,進行葡萄糖和果糖的轉運。VvHT基因的表達與己糖的積累與運輸是否具有直接聯系可能還與葡萄品種、自然環境因素以及栽培措施等因素有關。
在葡萄果實中鑒定的 3 個蔗糖運輸蛋白cDNA 中[6-7],VvSUC11和VvSUC12在果實中的表達隨液泡中己糖積累的起始而增強,而VvSUC27的表達模式則相反,其轉錄隨著果實成熟而下降。本研究中,VvSUC11和VvSUC12表達水平上調,而VvSUC27呈下調的表達趨勢,這與前人在‘西拉’葡萄中的研究結果較一致[6]。果實中多個蔗糖運輸蛋白在發育過程中的差異表達表明蔗糖運輸與積累的調節是十分復雜的。
VvGIN是編碼液泡內蔗糖水解酶的基因,VvGIN1和VvGIN2在果實生長發育前期轉錄、表達增加,但成熟后期卻降低,mRNA積累模式與可溶性轉化酶活性的增加一致[6,20-21]。本研究中VvGIN1呈下調的表達趨勢,VvGIN2的表達量表現為先升高后降低,兩者相比,VvGIN2的表達較弱,兩者在成熟后期的表達量降低,與前人的研究結果較一致。
SS和SPS與葡萄果實中蔗糖的合成與分解密切相關。SS的主要功能為分解蔗糖,催化如下的反應:蔗糖+UDP→果糖+UDPG;SS的活性水平在轉色期后略有增加,但仍然比轉化酶低約100倍[22]。SPS是植物中調控蔗糖合成的關鍵酶,是光合產物向蔗糖和淀粉分配的一個關鍵調控點,其主要功能是合成蔗糖。大量研究表明VvSPS基因只有在一定的發育階段及組織中才會開始表達[23-24]。冷翔鵬等[25]以‘夏黑’葡萄果實cDNA為模板,通過對葡萄EST數據庫糖代謝途徑有關基因的分析表明,VvSS在葡萄漿果的整個發育過程中均有強烈的表達,VvSPS在整個漿果生長期的表達相對較弱。高表達的VvSS和低表達的VvSPS使得葡萄漿果積累己糖,分解蔗糖,這與前人關于葡萄漿果主要積累葡萄糖與果糖,蔗糖質量分數極微[9,26]的研究結論一致。本研究中VvSS的表達水平在轉色期到成熟中期較低,在成熟后期升高。VvSPS的表達在花后85 d最高,在其他時期較低。與前人研究認為的VvSS在整個葡萄漿果發育過程中均有強的表達有所差別,這可能與葡萄品種有關。
綜上所述,葡萄漿果中糖的積累伴隨著蔗糖轉運蛋白合成基因、編碼轉化酶基因和單糖轉運蛋白合成基因等的協同表達。‘西拉’葡萄果實中可溶性糖代謝相關基因表達模式存在差異,相關基因的表達和調控共同促進果實中糖的積累。VvHT基因的表達與己糖的積累沒有直接聯系,隨著液泡中己糖的積累,葡萄漿果中VvSUC11和VvSUC12表達水平上調,而VvSUC27呈下調的表達趨勢。果實中糖的積累首先取決于漿果內在遺傳特性,此外,還可能與氣候條件及栽培措施等因素有關[9]。

