臭氧氧化乙硫氮的效率、能耗及中間產物生成研究
傅平豐,馬艷紅,林小鳳,李 根
(北京科技大學土木與資源工程學院,北京 100083)
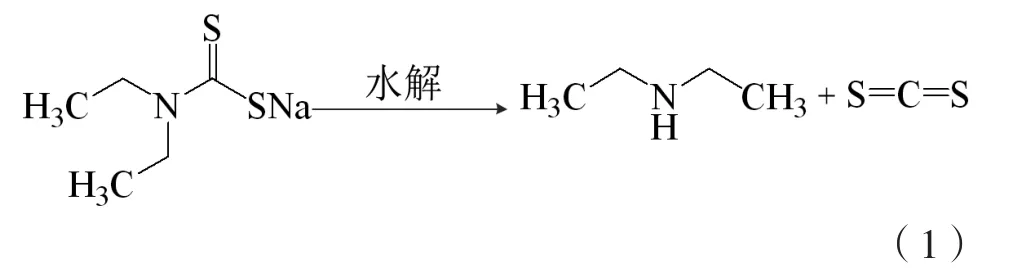
乙硫氮是硫化礦浮選常用捕收劑,代號SN-9,易與重金屬離子絡合,增加重金屬在生物體中的累積量,例如,乙硫氮會增加斑馬魚、虹鱒體內重金屬鎘的累積量,表現出較高的生物毒性[1-3]。乙硫氮在酸性介質中易水解,產物為二硫化碳與二乙胺,在pH=5時,其水解速率常數為9.2×10-4s-1,半衰期為0.2 h,二乙胺經消毒劑(如Cl2和O3)氧化,會生成劇毒的消毒副產物N-亞硝基二乙胺(NDEA),是典型的亞硝胺類物質,具有潛在細胞毒性、遺傳毒性和致癌性[4]。因此,浮選廢水排放前需有效去除殘留的乙硫氮捕收劑。
浮選廢水中有機藥劑凈化方法主要有物理化學法(如吸附、混凝沉淀)、生化法、化學氧化和高級氧化法(臭氧氧化、光催化、Fenton氧化等)。物理化學法能去除浮選廢水中絕大部分有藥劑,但吸附劑成本高,會產生二次污泥[5]。生化法運行成本較低,但有機浮選藥劑屬于人工合成產物,生物可降解性差,例如,苯胺黑藥等捕收劑對微生物有較高的毒性。以次氯酸鈉為氧化劑的化學氧化法雖然凈化效率高,但在凈化體系中因引入氯而產生氯苯等二次污染物。臭氧氧化法已應用于市政給水和工業污水處理,隨著產臭氧設備的大型化,該工藝的能耗不斷降低。O3具有很強的氧化性,氧化還原電位達2.07 V,O3分解可產生·OH自由基,其氧化還原電位達2.85 V,可無選擇性與多種有機污染物反應,氧化生成醛類和羧酸類等易生物降解的小分子產物,提高浮選廢水可生化性[6-9]。張萌等使用臭氧降解丁基黃藥,丁基黃藥去除率達95%,COD去除率達42%[10]。馬洪濤用臭氧氧化100 mg/L乙硫氮模擬廢水,乙硫氮去除率可達100%,但TOC去除率僅為20.8%[11]。本文研究在較低臭氧投加量(1.16 mg/(min·L))下臭氧氧化乙硫氮的效率、能耗及中間產物生成規律,為臭氧氧化工藝應用于硫化礦浮選廢水的高效處理提供理論基礎。
1 試驗方法
1.1 試驗材料與藥劑
乙硫氮(C5H10NS2Na·3H2O),分析純,購自上海阿拉丁生化科技股份有限公司,其余化學試劑如重鉻酸鉀、二乙胺等購自國藥集團化學試劑有限公司,純度為分析純。試驗過程中用水均為去離子水。
1.2 試驗裝置
試驗裝置如圖1所示,圓柱形反應器高為1 240 mm,內徑為53 mm,有效容積為2 L。O3氣體由空氣源臭氧發生器(青島維斯特電子凈化設備有限公司,SW-004型)產生,通過多孔玻璃板進入反應器。
模擬廢水中乙硫氮濃度為100 mg/L,以0.05 mol/L NaOH或HCl溶液將初始pH調至10.0;調節臭氧氣體的流量,控制臭氧投加速率為0.62~1.27 mg/(min·L),當2 L乙硫氮模擬廢水注入反應器后,通入臭氧氣體開始降解試驗。乙硫氮降解試驗的溫度控制在25±2℃;臭氧氧化乙硫氮的時間為90 min,每隔一定時間取水樣,測定水樣中乙硫氮、TOC、及離子的濃度。

圖1 臭氧氧化降解乙硫氮的試驗裝置
1.3 分析方法與計算
使用紫外-可見分光光度計(UV-5500PC,上海精密儀器儀表有限公司)測定水樣中乙硫氮濃度,最大吸收波長為256 nm;使用TOC測定儀(TOC-V,日本島津公司)測量水樣中TOC;以鉻酸鋇分光光度法測定水樣中濃度;使用離子色譜儀(792 BASIC IC,瑞士萬通中國有限公司)測定水樣中濃度。以二乙胺乙酸銅分光光度法測定水樣中CS2濃度,用碘量法測定水樣中H2S濃度,用固相微萃取/氣相色譜-質譜(SPE/GC-MS,GCMS-QP2010,日本島津公司)定性鑒定乙硫氮降解過程中有機產物的類型。
有機污染物礦化是指分子中有機態碳、氮、磷、硫轉變為無機態小分子或離子的過程,因此礦化率是評價有機物轉化為無機物的一個重要指標。本文中,碳元素礦化率定義為:

式中,γC為碳元素礦化率,%;TOC0為總有機碳初始濃度,mg/L;TOCt為總有機碳在時刻t的濃度,mg/L。
硫、氮元素礦化率計算公式為:

式中,γ為元素硫或氮的礦化率,%;Manion為或的相對分子量;N為乙硫氮分子中硫原子或氮原子的個數;Canion為或離子在時刻t的濃度,mg/L;C0為乙硫氮初始濃度,%。
2 結果與討論
2.1 臭氧氧化乙硫氮的效率與水質參數變化
當臭氧投加速率為1.16 mg/(min·L)時,臭氧氧化100 mg/L乙硫氮(SN-9)模擬廢水,乙硫氮濃度、COD及水質參數(溶液pH和電導率)隨時間的變化如圖2所示。結果表明,隨著臭氧氧化時間的延長,乙硫氮的濃度快速下降,當時間達到60 min時,乙硫氮的濃度已從100 mg/L下降到0.87 mg/L,90 min時,乙硫氮濃度進一步降低到0.13 mg/L,此時乙硫氮去除率達99.87%;與乙硫氮不同的是,溶液COD濃度下降較慢,降解90 min時,乙硫氮溶液COD只從96.89 mg/L降到57.71 mg/L,COD去除率為40.44%。以上結果表明,乙硫氮較易被臭氧氧化,而其產生的中間產物卻較難被臭氧或·OH自由基進一步分解。
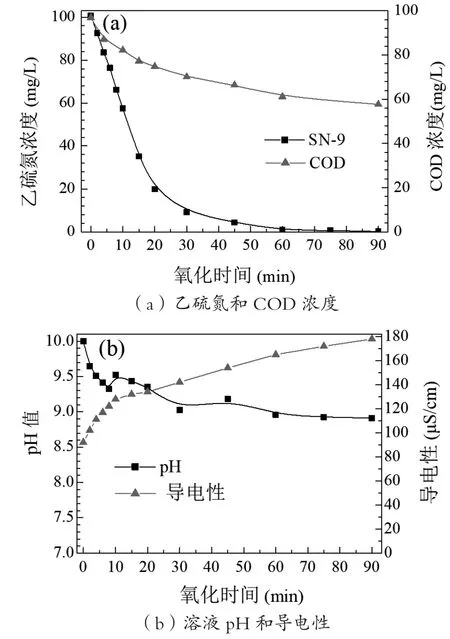
圖2 O3氧化乙硫氮的效率
從圖2(b)可知,隨著乙硫氮的降解,溶液pH值不斷降低,表明有水溶性有機酸或無機酸生成,如H2S、H2SO3、H2SO4等。此外,因O3分解生成·OH自由基需要有OH-離子作為鏈式反應的激發劑,會消耗水中OH-離子,可降低溶液的pH值。在溶液pH下降的時間內,溶液的電導率卻不斷上升,降解90 min后,溶液的電導率從92 μS/cm上升到178 μS/cm,電導率的上升直接證明乙硫氮溶液中離子數量增加,結合乙硫氮的分子結構式,可以判斷乙硫氮中C=S、-CN斷裂,進而被氧化為S2-、、等離子,導致溶液電導率的不斷增加。
臭氧與乙硫氮反應有兩種途徑。一是直接反應,在酸性條件下,具有偶極型的臭氧在有機分子的雙鍵位置發生選擇性強的環加成反應,從而使有機物得到降解,反應速度慢。二是間接反應,在堿性條件下,臭氧分解產生的·OH自由基參與降解過程,氧化能力強且沒有選擇性,可降解絕大部分有機污染物[11-14]。
2.2 臭氧投加速率對乙硫氮降解效率和能耗的影響
為比較不同高級氧化工藝降解有機物的去除能耗,Bolton等提出了Electrical Energy Per Order(EE/O)以衡量降解過程中的能耗,此參數是指在1 m3被污水中使污染物溶液降低一個數量級所需的電能(kW·h)[15]。當EE/O值小于10 kW·h/m3時,此高級氧化工藝在能耗上是可接受的。EE/O值(kW·h/(m3·order))按式(4)計算,本文中產生1 kg的臭氧按15 kW·h電能消耗計[16]。不同O3投加速率下臭氧氧化乙硫氮的速率常數及EE/O值如表1所示。
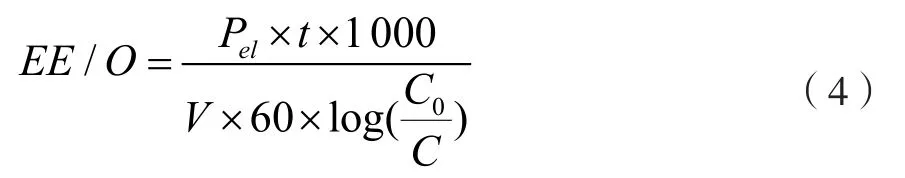
式中,Pel為耗電量,kW·h;t為降解時間,min;V為乙硫氮模擬廢水溶積,L;C為時刻t乙硫氮的濃度,mg/L;C0為初始時刻乙硫氮的濃度,mg/L。
由圖3可知,當臭氧投加速率由0.62 mg/(min·L)增至1.27 mg/(min·L)時,乙硫氮的降解速率常數由0.019 9 min-1增至0.082 6 min-1,表明增加臭氧投加量可顯著強化乙硫氮的降解;此時,降解能耗EE/O值由2.076 kW·h/(m3·order)降至0.247 kW·h/(m3·order),臭氧投加量增加,但EE/O值下降,主要原因是乙硫氮的降解速率常數有顯著增加。以上結果表明,在較低臭氧投加速率下,適當增加臭氧投加量,可以提高乙硫氮的降解效率,并降低其處理能耗。臭氧投加速率增加,會增加乙硫氮與臭氧分子和·OH自由基等強氧化性物種的接觸機會,從而提高降解反應速率。但從圖3可見,當臭氧投加速率從1.16 mg/(min·L)增加到 1.27 mg/(min·L)時,臭氧氧化乙硫氮降解的能耗相差不大,表明進一步提高臭氧投加速率,可能不會降低工藝能耗,原因是臭氧在水中溶液度較低,投加過多的臭氧并不會全部溶解于水中,可能從反應器中逸出而造成浪費。
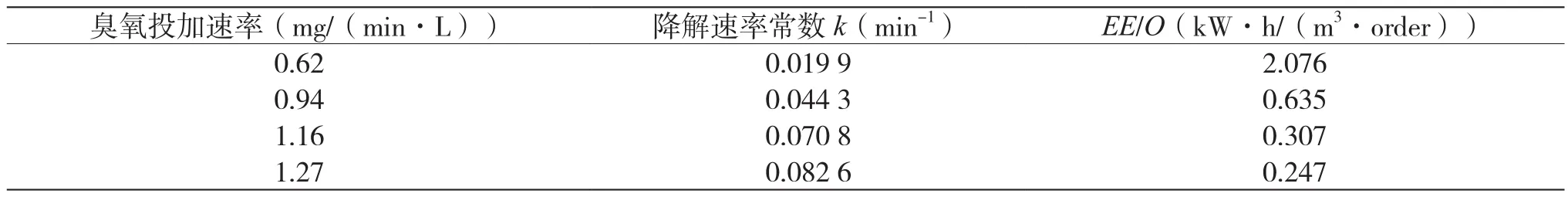
表1 不同O3投加速率下臭氧氧化乙硫氮的速率常數及EE/O值
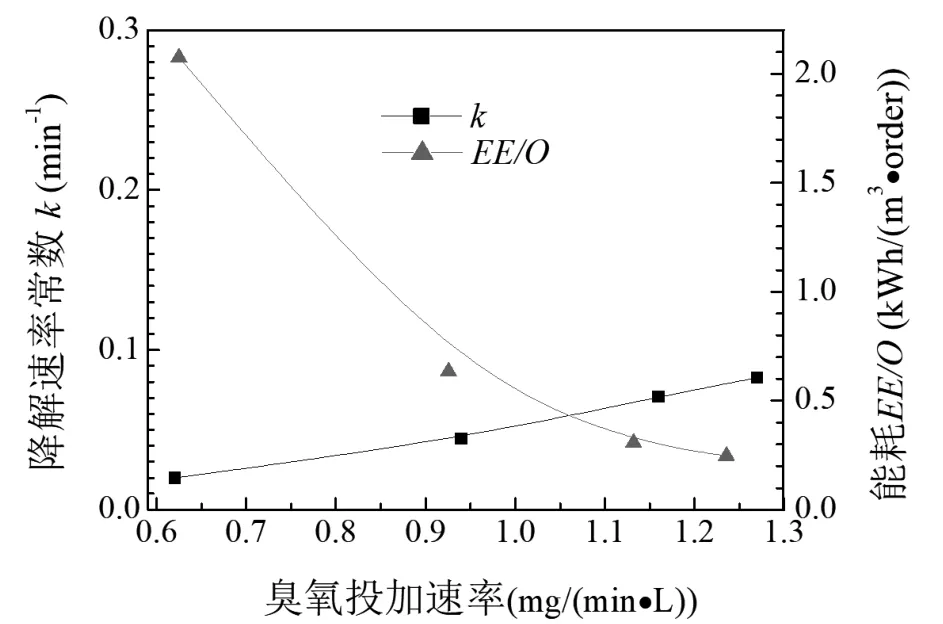
圖3 O3投加速率對乙硫氮降解速率和EE/O值的影響
2.3 乙硫氮中碳、硫和氮元素的礦化
當臭氧投加速率為1.16 mg/(min·L)時,臭氧氧化乙硫氮過程中溶液TOC、和濃度隨時間變化關系如圖4所示。可見,隨著臭氧氧化時間延長,TOC濃度不斷降低,同時和離子濃度不斷增加,表明乙硫氮及有機中間產物可以被徹底礦化成無機離子、H2O和CO2,乙硫氮分子中有機態的硫和氮經歷一系列氧化過程,可以轉化高價態的和離子。

圖4 O3氧化乙硫氮時TOC、和濃度變化
如表2所示,降解90 min后,乙硫氮的C元素礦化率只有17.85%,而此時乙硫氮降解率高達99.87%,根據圖2(a)數據,COD去除率也只有40.44%,結果表明,臭氧氧化可以徹底分解乙硫氮捕收劑,但是絕大部分都轉化成各種中間有機產物,表現出較高濃度的TOC和COD值。乙硫氮降解后會生成小分子的有機酸、酫和酯類中間產物,此類有機物與臭氧反應的速率常數小,導致O3氧化此類有機物的效率較低[9-10]。
表2 降解90 min后TOC、和濃度及C、S和N的礦化率

表2 降解90 min后TOC、和濃度及C、S和N的礦化率
檢測成分 濃度(mg/L)元素 礦化率(%)TOC 50.56 C 17.85 SO42- 18.66 S 16.62 NO36.82 N 18.81-
2.4 含硫副產物CS2和H2S的生成
當臭氧投加速率為1.16 mg/(min·L)時,臭氧氧化乙硫氮時溶液中CS2和H2S濃度隨降解時間的變化情況如圖5所示,在90 min的降解過程中,溶液中CS2濃度整體較低,降解90 min時其濃度只有0.298 mg/L,表明中間產物CS2不易于溶液中累積起來,O3和·OH自由基可快速分解CS2產物。與CS2不同的是,隨著乙硫氮的降解,溶液中H2S濃度快速增加,60 min時達到4.825 mg/L,達到CS2濃度的近20倍,反應60 min后,其濃度開始下降,結果表明,在乙硫氮降解過程中,H2S產物累積明顯。溶液中累積了CS2和H2S,表明乙硫氮中-CSS-基團確實可被氧化成CS2和H2S等含硫副產物,此類含硫副產物再經過一系列的氧化過程,可最終轉成為離子。雖然乙硫氮被臭氧氧化分解,但被轉化CS2和H2S等含硫副產物,導致降解90 min時硫元素礦化率較低。

圖5 乙硫氮降解過程中CS2和H2S濃度變化規律
2.5 有機中間產物鑒定分析
當臭氧投加速率為1.16 mg/(min·L)時,臭氧氧化乙硫氮20 min和90 min后取樣,水樣經固相微萃取(SPE)富集有機物,萃取產物用GC-MS法測定分析有機中間產物。SPE/GC-MS法分析水樣中的中間產物結果如圖6、表3和表4所示。

圖6 乙硫氮降解20 min和90 min的GC-MS總離子色譜圖
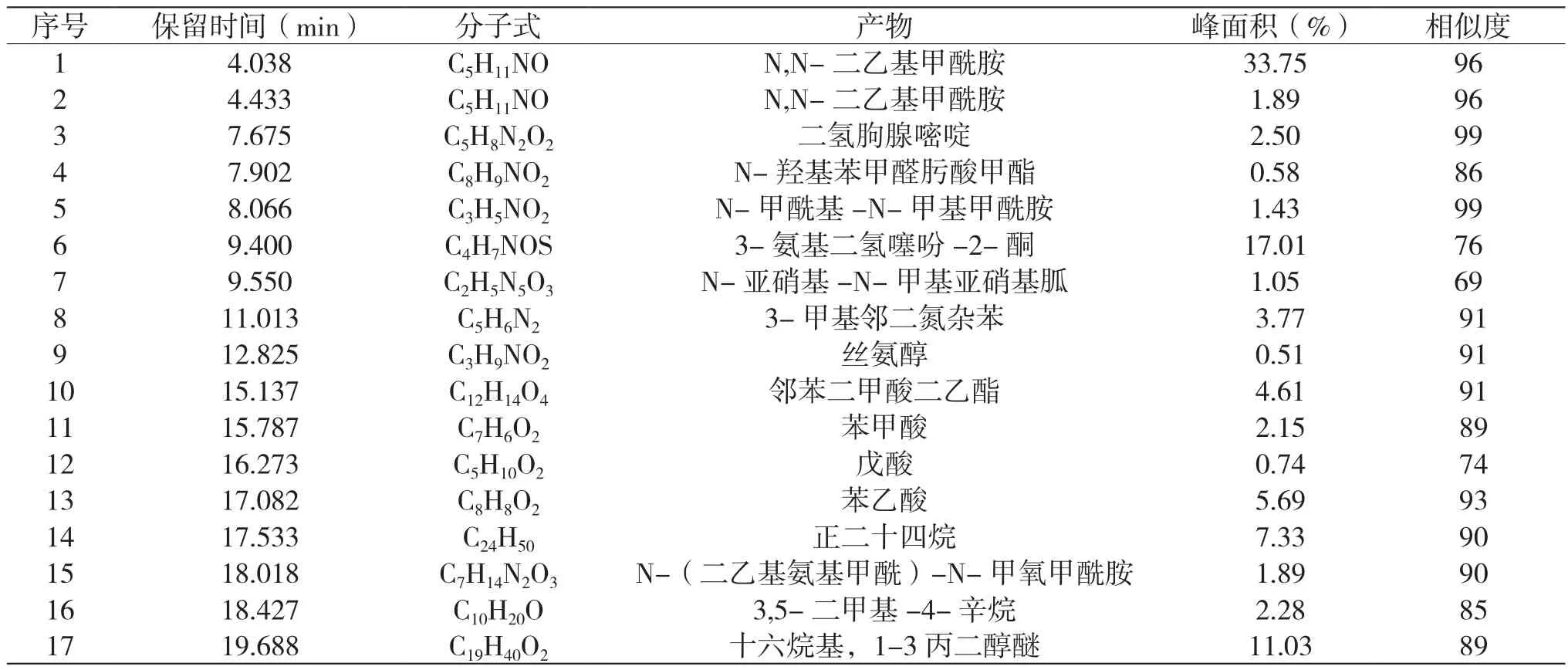
表3 乙硫氮降解20 min時中間產物分布
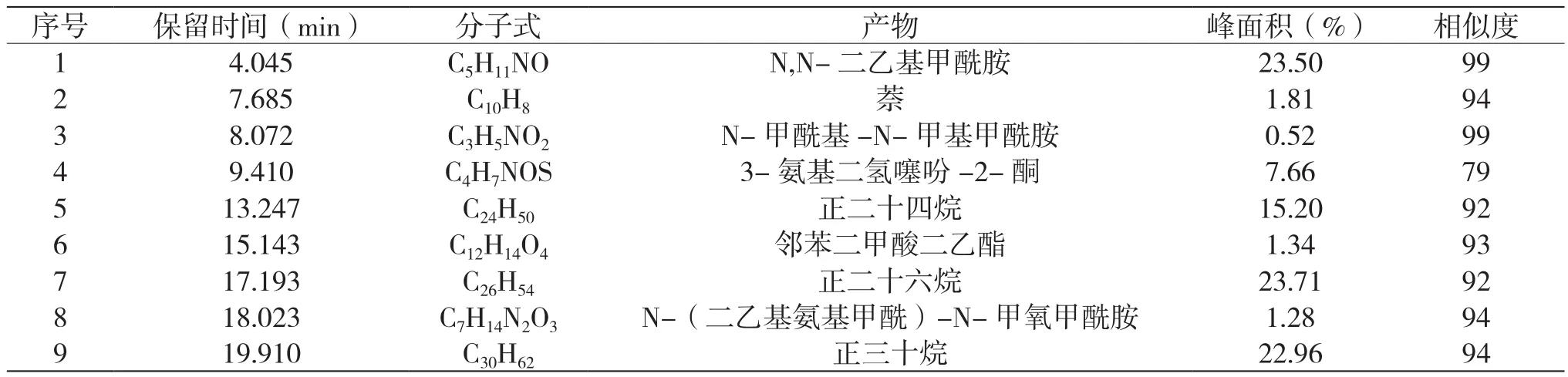
表4 乙硫氮降解90 min時中間產物分布
可見,降解20 min時檢測到4種酰胺副產物,N,N-二乙基甲酰胺是主要有機副產物,還有如絲氨醇、3-甲基鄰二氮雜苯等其他含氮有機產物,此外,也檢測到苯甲酸和戊酸等有機酸和酯類產物。當降解時間延長到90 min時,GC-MS沒有檢測到二氫朐腺嘧啶、N-羥基苯甲醛肟酸甲酯等含氮有機物,有機物的種類也大幅減小,表明在乙硫氮降解過程中,此類有機物也被同步降解,轉化成其他有機物或無機離子。當降解時間由20 min延長至90 min時,N,N-二乙基甲酰胺的峰面積百分比由33.75%減少到23.5%,表明主要副產物N,N-二乙基甲酰胺也被快速降解。結合圖4和表2中有機碳和氮的礦化率,可見,降解90 min時,雖然乙硫氮捕收劑已經徹底被分解,但是仍然有N,N-二乙基甲酰胺、3-氨基二氫噻吩-2-酮和正二十六烷等大量有機產物存在,導致較低的碳元素礦化率。
3 結論
乙硫氮捕收劑易被臭氧氧化,臭氧投加速率為1.16 mg/(min·L)時,降解90 min乙硫氮和COD的去除率分別達99.87%和40.44%;臭氧投加速率增加,乙硫氮的降解速率快速增加,能耗EE/O值降低,當臭氧投加速率為1.16 mg/(min·L)時,EE/O值為0.307 kW·h/(m3·order),表明臭氧氧化乙硫氮在能耗上是可接受的。臭氧氧化乙硫氮90 min時,乙硫氮中碳、硫和氮元素的礦化率分別為17.85%、16.62%和18.81%,乙硫氮被去除后殘留有較多有機中間產物;乙硫氮經臭氧氧化過生成CS2和H2S含硫副產物,但溶液中H2S濃度約為CS2的20倍,中間產物CS2被易被氧化,不易在溶液中累積。SPE/GC-MS分析表明,臭氧氧化乙硫氮時生成大量如N,N-二乙基甲酰胺等酰胺類含氮有機中間產物,延長降解時間可大幅減少中間產物的種類,降低中間產物的濃度,但即使乙硫氮去除率達99.87%,降解液中仍有大量中間產物存在。

