鹽酸地爾硫卓與七八元瓜環的包合作用及體外釋藥性能
方權輝, 林友文
瓜環(cucurbit[n]uril, Q[n],n=5~10)又稱葫蘆脲,具有大小不同的疏水空腔及多個羰基端口,是一類新型的大環主體超分子藥物載體[1-2]。瓜環的穩定性及安全性均良好,被廣泛應用于藥物的包合及緩控釋領域[3-4]。瓜環根據其空腔大小可選擇性包合某些藥物分子,形成主-客體超分子包合物,以達到延長半衰期、改善藥物理化性質、提高藥物生物利用度以及降低不良反應等目的[5-8]。
鹽酸地爾硫卓(diltiazem hydrochloride,DIL)為鈣通道阻滯藥,可以有效緩解心絞痛,并降低血壓。但因其半衰期為3.5 h,生物利用度僅為40%,且常見惡心、浮腫、頭痛、皮疹等不良反應,限制了其在臨床上的應用[9-11]。因此,將DIL制成緩釋制劑有望減少服藥次數和血藥濃度波動,改善其生物利用度,降低藥物的不良反應。本研究通過光譜學方法研究Q[7]及Q[8]與DIL的主-客體包合作用,考察包合物在不同介質中的體外釋藥性能,對研發以瓜環為載體的pH敏感性藥物緩釋劑及應用具有重要意義。
1 材料與方法
1.1儀器和試劑 DIL(純度99.5%)(百靈威科技有限公司),瓜環Q[7]和Q[8](瑞士Fluka試劑公司),核磁共振儀(AVANCE Ⅲ,瑞士Bruker BioSpin公司),熒光光度計(Cary Eclipse,美國安捷倫公司),紫外-可見分光光度計(UV-2600,日本島津公司),高精密透析袋(MWCO:500-1000,美國光譜醫藥公司),恒溫振蕩器(SHA-B,常州國華儀器有限公司)。實驗用水為雙蒸水,其余試劑均為分析純。
1.2方法
1.2.1紫外光譜及熒光光譜的測定 參照文獻[12]的方法,分別配制1.0×10-4mol/L的Q[7]和Q[8]溶液以及4.0×10-4mol/L的DIL溶液。采用摩爾比法(即固定客體DIL濃度)以及Job法(即等物質的量連續變化法),進行測定。
1.2.21H NMR譜的測定 在25 ℃下,D2O為溶劑,稀DCl調節pH=2,在核磁共振儀上測定1H NMR譜。
1.2.3制備主-客體包合物 參照文獻[13]的方法,按n(Q[n])/n(DIL)=1∶1將Q[n]和DIL分別溶于雙蒸水中(超聲10 min),室溫攪拌6 h,蒸去溶劑、真空干燥,分別制得Q[7]-DIL及Q[8]-DIL包合物。
1.2.4Q[7]-DIL及Q[8]-DIL的包合比和包合平衡常數(Ka)測定 采用摩爾比法測定體系的包合比,以236 nm處的吸光度對n(Q[n])/n(DIL)作變化趨勢圖,并用Job法進行驗證。主-客體的Ka參照文獻[14]通過下列公式計算:
式中,m表示包合比,[Q]i為瓜環的濃度,ΔA為加入瓜環前后DIL的吸光度變化值,[DIL]是DIL的濃度,Ka為包合穩定常數,Δε為包合前后DIL的摩爾吸光系數變化值。
1.2.5DIL原藥及主-客體包合物的體外累積釋放度的測定 參照文獻[15]的恒溫振蕩法,準確稱取5.00 mg的DIL、17.9 mg的Q[7]-DIL包合物及19.7 mg的Q[8]-DIL包合物,分別置于透析袋內,

A:Q[7]-DIL體系;B:Q[8]-DIL體系. a~i: (NQ[n]/NDIL=0,0.25,0.5,0.75,1.0,1.25,1.5,1.75,2.0).圖1 瓜環-DIL包合作用的紫外圖譜Fig 1 UV spectra of Q[n]-DIL inclusion system
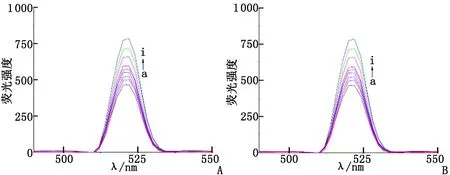
A:Q[7]-DIL體系;B:Q[8]-DIL體系. a~i: (NQ[n]/NDIL=0,0.25,0.5,0.75,1.0,1.25,1.5,1.75,2.0).圖2 瓜環-DIL作用體系的熒光圖譜Fig 2 Fluorescent emission spectra of Q[n]-DIL

A:Q[7]-DIL體系;B:Q[8]-DIL體系. 插圖:ΔA~n(Q[n])/[n(Q[n])+n(DIL)]變化曲線.圖3 Q[7]-DIL和Q[8]-DIL作用體系的吸光度對n(Q[n])/n(DIL)變化曲線圖Fig 3 Absorbance~n(Q[n])/n(DIL) curve of Q[7]-DIL and Q[8]-DIL
并放在20 mL鹽酸液(pH=1.2)、磷酸鹽緩沖液(pH=4.0)或磷酸鹽緩沖液(pH=6.8)中,控制釋放液溫度為(37±0.5)℃,在恒溫振蕩器中振蕩(100 r/min),分別于10,20,30,45,70,100,130,180,280,400 min等時間點各取樣1 mL(并補充同體積介質),稀釋25倍,于236 nm波長處分別測定吸光度(取3份平行試驗的平均值),根據線性范圍為c=5~25 μg/mL的標準曲線方程算得藥物的濃度及累積釋放度,繪制藥物累積釋放曲線。
2 結 果
2.1Q[7]及Q[8]與DIL相互作
用的紫外光譜 隨Q[7]及Q[8]濃度的增大,Q[7]-DIL及Q[8]-DIL體系的吸收強度均逐漸降低,在236 nm處的最大吸收峰處均出現明顯的紅移現象,并存在多個等吸收點(圖1)。
2.2Q[7]及Q[8]與DIL相互作用的熒光光譜 Q[7]及Q[8]與DIL發生超分子包合作用時,熒光光譜的最大發射波長(λem)和激發波長(λex)分別為270和260 nm,DIL和瓜環在上述波長范圍內均不發射熒光。圖2顯示DIL的熒光強度隨著Q[7]和Q[8]的濃度增大均顯著增強。
2.3Q[7]-DIL及Q[8]-DIL的包合比和Ka 以236 nm處的吸光度值對n(Q[n])/n(DIL)作變化趨勢圖(圖3),均在主-客體物質的量比為1∶1時出現拐點。用Job法進行驗證,即圖3中的插圖部分顯示,兩個體系的紫外吸收變化的最大值都對應于體系n(Q[n])/[n(Q[n])+n(DIL)]=0.5處。兩種方法均表明Q[7]-DIL和Q[8]-DIL體系的包合比均為1∶1,計算得兩種體系的Ka分別為6.28×103和8.69×103L/mol(線性相關系數r分別為0.997和0.995)。
2.4Q[7]及Q[8]與DIL相互作用的1H NMR譜 圖4中A,B,C分別為客體DIL、n(Q[7])/n(DIL)為1∶1時、n(Q[8])/n(DIL)為1∶1時的1H NMR譜圖,通過比較圖4B和圖4A,DIL結構中的H9,H10,H11,H12和H13質子峰化學位移由原來的δ 5.12,δ 4.05,δ 7.34,δ 6.96和δ 3.78分別移向高場δ 4.92,δ 2.68,δ 6.50,δ 6.06和δ 1.30,DIL其余位置上質子峰的化學位移沒有改變,表明Q[7]的空腔包合了DIL的甲氧苯基結構部分。比較圖4A和圖4C,DIL結構中的H9,H10,H11,H12和H13質子峰化學位移由原來的δ 5.12,δ 4.05,δ 7.34,δ 6.96和δ 3.78分別移向高場δ 4.90,δ 2.48,δ 6.27,δ 5.82和δ 1.30,DIL其余位置上質子峰的化學位移未發生位移,表明DIL的甲氧苯基結構單元進入瓜環,與Q[8]發生包合作用,推測Q[7]及Q[8]與DIL可能的包合作用模式如圖5所示。
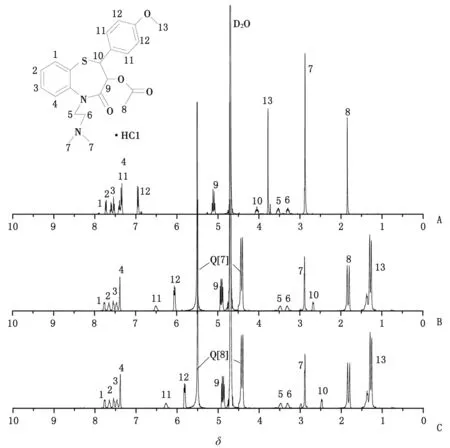
A:DIL體系;B:Q[7]-DIL體系;C:Q[8]-DIL體系.圖4 DIL,Q[7]-DIL及Q[8]-DIL體系的1H NMR譜圖Fig 4 1H NMR spectra of DIL, Q[7]-DIL and Q[8]-DIL system

圖5 Q[7]-DIL及Q[8]-DIL可能的包合作用模式Fig 5 Possible mode of interaction between DIL and Q[n](n=7, 8)
2.5DIL及其包合物的體外釋藥性能 DIL原藥及其包合物Q[7]-DIL和Q[8]-DIL在pH為1.2,4.0和6.8的介質中的體外藥物累積釋放曲線見圖6。DIL原藥在3種溶出介質的400 min累積藥物釋放度分別為98.51%,97.76%及97.80%;Q[7]-DIL分別為44.80%,56.16%及68.05%;Q[8]-DIL分別為39.28%,52.70%及58.34%。表明Q[7]-DIL及Q[8]-DIL在pH為1.2介質中的緩釋效果最明顯,在pH為4.0和6.8的介質中也有一定的緩釋作用。
3 討 論
光譜分析法是研究超分子包合作用的常用方法[14],DIL在波長236 nm處有強的紫外吸收(而瓜環在波長>210 nm沒有紫外吸收),加入Q[7]或Q[8]后,包合DIL結構中的苯環結構單元,從而使苯環結構單元E2紫外吸收譜帶受到影響,吸收峰位移并且吸收強度不斷降低,UV-Vis吸收光譜圖中出現多個等吸收點,表明Q[7]和Q[8]均對DIL有超分子包合作用。
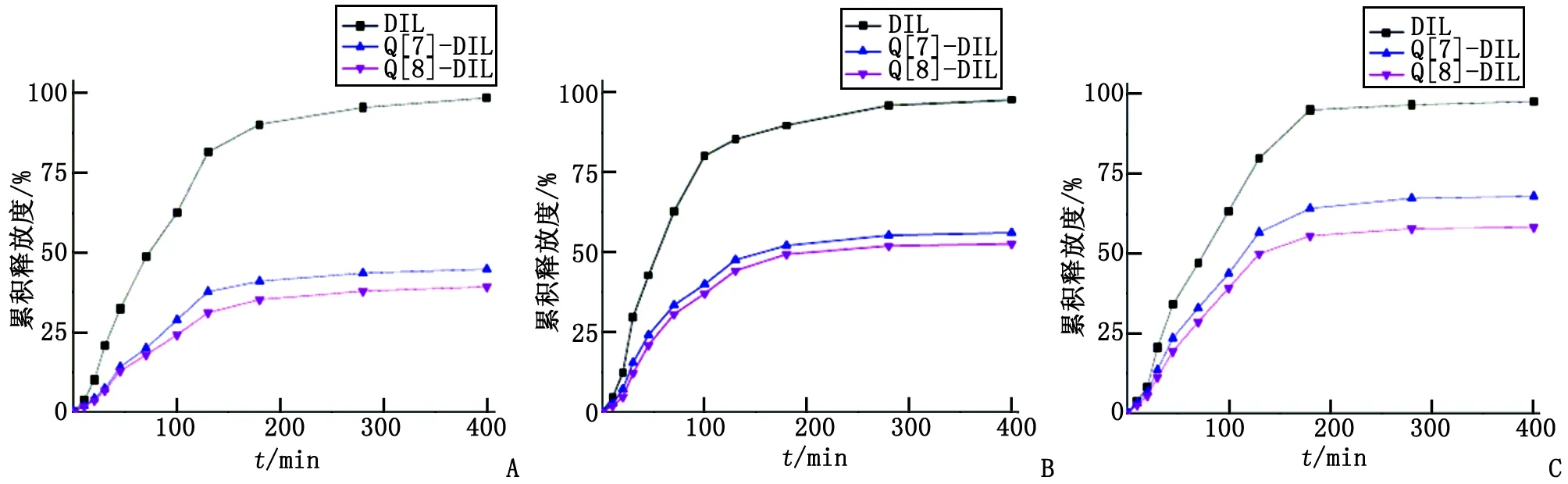
A:pH=1.2;B:pH=4.0;C:pH=6.8.圖6 DIL,Q[7]-DIL及Q[8]-DIL在不同pH介質中的體外累積釋放度Fig 6 The cumulative dissolution rate of DIL, Q[7]-DIL and Q[8]-DIL in different pH buffers
隨著主體瓜環濃度的增加,體系的熒光強度有規律的增強,這可能是由于瓜環的疏水性空腔為非極性環境,具有熒光的客體DIL部分結構單元進入瓜環疏水空腔后,客體分子的水分子的松弛效應和運動自由度顯著降低,從而阻止碰撞失活、降低了非輻射躍遷概率;同時DIL進入瓜環的空腔后,其熒光單重態受到屏蔽,減少了和碎滅劑接觸。兩個原因均使得客體DIL的熒光量子產率增大,熒光強度增強[16],也表明Q[7]和Q[8]對DIL產生超分子包合作用。
對客體DIL與包合物Q[7]-DIL及Q[8]-DIL的1H NMR譜圖進行比較,發現DIL的甲氧苯基結構部分質子峰化學位移向高場位移明顯,DIL其余位置上質子峰的化學位移沒有改變,均說明Q[7]及Q[8]與DIL的甲氧苯基結構單元發生包合作用。摩爾比法測定體系的包合比,并應用Job法進行驗證,Q[7]-DIL及Q[8]-DIL體系的包合比均為1∶1,Ka分別為6.28×103和8.69×103L/mol。結合熒光光譜、紫外光譜、1H NMR譜和主-客體作用包合比,提出了可能的Q[7]及Q[8]與DIL包合作用模式。
由體外藥物累積釋放結果顯示,DIL原藥在3種溶出介質中均快速釋放,這是由于DIL的水溶性較好所致。包合物Q[7]-DIL及Q[8]-DIL在pH為1.2的介質中的緩釋效果最明顯,400 min藥物累積釋放度分別為44.80%和39.28%;其次是在pH為4.0的介質中均有緩慢釋放,其400 min藥物累積釋放度分別為56.16%和52.70%;在pH為6.8的介質中的緩釋效果最小,分別為68.05%和58.34%。介質的酸性越強,400 min體外藥物累積釋放度越小,緩釋越明顯,顯示藥物緩釋作用具有明顯的pH敏感性。考察不同pH介質中對Q[7]-DIL和Q[8]-DIL體系包合作用的影響,結果也發現瓜環與DIL的主-客體包合作用具有pH敏感性,這與包合物的pH敏感性藥物緩釋一致。由于在強酸性的條件下,DIL分子中甲氧苯基的含氧結構單元(甲氧基)的氧原子具有孤電子對,易與氫質子結合發生質子化形成帶電陽離子,瓜環端口的羰基氧可以與質子化后的DIL陽離子結構單元之間產生較強的離子-偶極作用,產生較牢固的超分子包合作用,藥物分子DIL不易從主體空腔脫離釋放,從而減慢了釋藥速度。結果表明七元、八元瓜環對DIL產生1∶1的超分子包合作用,包合后對藥物DIL具有明顯的pH敏感性緩釋效果,有望應用于研發pH調控的超分子瓜環-藥物緩控釋系統。

