淺談基因編輯技術與豬遺傳改良
李嘉楠,顧 浩,徐在言,左 波
(華中農業大學動科動醫學院,農業農村部豬遺傳育種重點實驗室,農業動物遺傳育種與繁殖教育部重點實驗室,湖北 武漢,430070)
前言
從本質上講,轉基因技術是人為的在生物體原DNA 中引入一段外源DNA 序列,從而達到改變生物自身性狀并穩定遺傳的技術。而基因編輯技術則是對物種本身的基因進行各種 “粘貼復制” 或者 “剪切替換” 等修飾,從而抑制機體內 “不好” 基因的表達,促進機體內 “好” 基因的表達,且不具有引入未知成分的風險,相較于轉基因技術其安全性更高、可控性更強。目前,新興的CRISPR/Cas9 基因編輯技術在分子生物學中呈現出了巨大的潛力,將現代生物學研究推向了一個新的水平,幾乎所有的生物實驗室均可掌握這項技術并對任何物種進行研究,基因改變未來的時代已經到來。
1 CRISPR/Cas 系統
CRISPR/Cas 系 統 最 早 是1987 年日本學者在大腸埃希菌(Escherichia coli) 中 發 現 的, 并將其命名為規律性成簇間隔的短回文重復序列(CRISPR), 隨后又有大量學者證明多種細菌和古細菌中也存在這種系統,并預測該系統可能與DNA 修復和基因調控相關[1-3]。2007 年,研究人員首次使用細菌中CRISPR 系統對噬菌體進行適應性免疫,并證明了CRISPR 基因座附近存在的一系列相 關 蛋 白(CRISPR associated 蛋白;Cas 蛋白) 能對外源DNA 進行切割[4]。CRISPR 基因是由一段長度約為300 ~500 bp 富含AT 堿基序列的前導序列和一段具有發卡結構的重復序列以及多個捕獲外源基因的間隔序列組成;前導序列的上游為一系列多態型Cas 基因,目前已經發現了Cas1 ~Cas10 等多種類型的Cas 基因,與CRISPR 組合形成CRISPR/Cas 系統。根據不同Cas 基因編碼的蛋白功能不同,將CRISPR/Cas 系統分為三個類型,其中Ⅰ型和Ⅲ型CRISPR/Cas 系統都是由多種Cas 蛋白共同發揮作用, 參 與CRISPR RNA(crRNA)加工并促進其與DNA 雙鏈結合,形成R 環結構, 最終與反式激活CRISPR RNA(tracrRNA) 識別R 環結構切斷DNA 雙鏈;Ⅱ型CRISPR/Cas 系 統 僅 需 一 種Cas 蛋白,就可以在RNA 的介導下造成DNA 雙鏈斷裂,因此其成為了目前應用最廣泛的基因編輯系統,其中包括CRISPR/Cas9、CRISPR/Cas12(cpf1)、CRISPR/Cas13 系統等[5]。
2 新型基因編輯技術概述
2.1 CRISPR/Cas 基因編輯技術
Ⅱ型CRISPR/Cas 系統中CRISPR/Cas9 蛋白的基因編輯是由RNA 介導,主要結構包括Cas9 蛋白、crRNA和tracrRNA 組 成,tracrRNA 負 責激活RNase Ⅲ從而促進crRNA 成熟,成熟的crRNA 通過堿基配對與靶序列結合,引導Cas9 蛋白的兩個活性位點RuvC 和HNH 分別對靶序列的兩條鏈進行的切割,造成DNA雙鏈斷裂,從而使細胞發生非同源末端修復機制(NHEJ)和同源末端修復機制(HDR),實現目的基因的敲除和插入[6]。2012 年,Jinek 等將crRNA 和tracrRNA 的核心區連接在一起形成一個20 bp 長度左右的sgRNA(single guide RNA)去引導Cas9 蛋白,僅僅只需一個蛋白質和一個RNA 分子就可以實現基因編輯,這一改造大大簡化了CRISPR/Cas9 基因編輯系統在基因組中的應用[7,8]。但其自身存在的嚴重脫靶問題也被人們所詬病,因此,其同源蛋白也成為了研究熱點之一,其中CRISPR/Cas12a(cpf1)與CRISPR/Cas9 一樣都是由RNA 介導的基因編輯,但與CRISPR/Cas9 相比具有以下幾點不同:首先,該系統只由Cas12a(cpf1)和crRNA 組成,不需要tracrRNA 的參與,因為Cas12a(cpf1)蛋白自身就可以促進crRNA成熟, 進而識別靶序列。 其次,Cas12(cpf1)的PAM 識別區為5’-TTTN-3’,而Cas9 的PAM 識別區為5’-NGG-3’,兩者的結合能夠有效提高基因編輯在基因組中的識別范圍。 最后,Cas12a(cpf1) 蛋白與Cas9 蛋白同樣具有切割活性的RuvC 和特殊的HNH 結構域,不同的是Cas12a(cpf1)蛋白切割后會產生一個4 ~5bp 的黏性末端,有利于細胞發生同源末端修復機制,提高編輯效率,而Cas9 蛋白切割產生的是平末端[9]。同時,也有研究表明CRISPR/Cas12b 與CRISPR/Cas12a(cpf1) 發揮同樣的作用,只是Cas12b 蛋白分子量更小,編碼序列更短,具有更高的編輯效率和較低的脫靶率[10]。CRISPR/Cas13基因編輯系統也是由RNA 介導的基因編輯系統,與前幾種Cas 系統的不同之處在于,Cas13 蛋白具有兩個高度保守的HEPN endoRNase結構域,具有RNA 酶活性,能在crRNA 介導下對單鏈RNA 進行精確編輯[11]。
2.2 單堿基編輯技術
上述的CRISPR/Cas 基因編輯系統通常是通過堿基配對定位到目 標DNA 序 列 上, 在sgRNA 指定的特定位點造成雙鏈斷裂。通過細胞對DNA 雙鏈斷裂的同源末端修復或非同源末端修復機制造成目的基因的插入和敲除,達到改變生物性狀的目的,然而對于很多基因操作而言,不需要雙鏈斷裂,僅僅改變單個堿基就可以實現生物性狀的改變,這一技術稱為單堿基編輯技術。2016 年, 哈佛大學的研究學者將Cas9 蛋白的兩個結構域進行突變,得到兩種突變體,分別為Cas9 切口酶突變體(Cas9 nickase,Cas9n)和核酸酶缺陷Cas9(dead Cas9, dCas9), 其 中Cas9n 具有切割DNA 單鏈的能力,將Cas9n 與鼠源的胞嘧啶脫氨酶融合在一起構成了第一代胞嘧啶堿基編輯器(cytosine base editor, CBE),實 現 從C 到T 或G 到A 的 轉 換,造成錯義突變或者提前終止翻譯,達到目的基因的敲除[12]。隨后2018年該研究團隊在CBE 的基礎下,對大腸桿菌的腺苷脫氨酶進行改造獲得了第一代腺嘌呤堿基編輯器(adenine base editor, ABE),實現了單堿基從A 到G 或從T 到C 的轉換。與CRISPR/Cas9 系統相比,ABE 和CBE 單堿基編輯系統能夠在不切斷DNA 雙鏈的情況下實現四種堿基對之間的完美轉換[13]。目前,ABE 和CBE 單堿基編輯系統在擬南芥、小麥、水稻、大豆、玉米等植物的性狀改良和抗病性應用較為廣泛,但是在動物方面研究較少,尤其是應用于豬、牛、羊等大動物。2019 年,中國科學家通過胚胎注射和體細胞核移植首次在豬的細胞、胚胎和個體水平上對豬的多基因位點進行單堿基編輯,培育出了單基因突變的早衰豬模型和杜氏肌肉營養不良豬,同時也獲得了與免疫機能相關的多基因突變的免疫缺陷豬模型[14]。隨著對單堿基編輯技術的深入研究、系統的優化和完善,未來基因編輯定會進入一個精確編輯的時代。
2.3 基于CRISPR/Cas9 技術衍生的基因表達調控
在CRISPR/Cas9 系統廣泛應用之前,鋅指核酸內切酶(ZFNs)和類轉錄激活因子效應物核酸內切酶(TALENs) 的應用在基因轉錄調控方面已經取得了很大的進展,但是由于它們DNA 結構域對堿基識別的規律復雜性,在調控多個內源基因時出現了很大的阻礙[15-17]。但在CRISPR/Cas9 基因編輯系統中,Cas9 蛋白是由sgRNA 引導通過與靶位點進行堿基互補配對和DNA結合并發揮剪切作用,可以設計不同的sgRNA 同時引導Cas9 蛋白定位到多個基因組位點,實現多基因同時調控。也有研究學者發現Cas9蛋白的另一種突變體dCas9 具有只結合DNA 而不發揮剪切作用的能力[18], 可 以 將dCas9 與 轉 錄 抑 制域或轉錄激活域進行融合,形成CRISPR interference(CRISPR i)和CRISPR activator(CRISPR a) 系統實現對靶基因的抑制或激活[19]。dCas9 在調節表觀遺傳修飾上也發揮了一定的作用,有研究學者將dCas9 與人乙酰基轉移酶 p300 的催化核心融合,結果表明經過基因修飾后的增強子,其靶向到啟動子上時對乙酰化具有強有力的轉錄激活作用[20]。
3 基因編輯技術在豬遺傳改良中的應用
自CRISPR/Cas9 技術問世以來,基因組編輯已經迅速席卷整個生物醫學領域,包括畜牧業,尤其在豬基因組編輯中的研究已成為了一個勢不可擋的趨勢,它不僅克服了大動物傳統育種中育種周期長、遺傳效力低等問題,而且在抗病性、肉質改善、動物福利及動物疾病模型等研究上都有重要突破,基因編輯技術在豬基因組編輯中應用的部分實例見表1。
4 基因編輯技術的局限性及優化策略
近 幾 年,CRISPR/Cas9 基 因編輯技術在生物學領域發揮著巨大潛力,尤其是在功能基因研究和動物疾病模型上。但是該技術在應用過程中還存在脫靶效應、編輯效率低等一系列風險,給精確基因編輯造成一定的阻礙。基于此,科學家們在降低脫靶效應和提高基因編輯特異性等方面進行了很多研究:1)sgRNA 的選擇及優化:減少脫靶和提高sgRNA 特異性的首要任務是正確選擇活性高的sgRNA,目前有許多關于sgRNA 設計的軟件程序,研究人員可以根據2 ~3 個不同軟件綜合比較挑選出得分較高的sgRNA,有助于最大化的降低脫靶效應。更有研究者通過截短sgRNA的3’端或在sgRNA 的5’端加入兩個堿基,證明了截短和修飾后的sgRNA 特異性更高,且不影響靶基因組的編輯效率[34]。2)cas9 蛋白的結構改造:有研究證明SpCas9-HF1[35]、eSpCas9[36]及HypaCas9[37]等Cas9 核酸酶突變體,都具有較低的脫靶效應,同時還和野生型Cas9具有相同的基因編輯能力。除此之外,Hu 等研究團隊通過獲得Cas9的突變體xCas9 來拓寬Cas9 蛋白識別更廣泛的PAM 序列(NGG、NG、GAA、GAT 等),增加在基因組中的靶向范圍[38]。2014 年,Ran等研究團隊發明了一種雙切口編輯技術,通過將兩個成對的sgRNA與Cas9n 結合起來,分別切割DNA的兩條鏈,提高了sgRNA 對靶向基因組序列識別的特異性,證明了在基因組編輯效率不變的情況下,sgRNA 的脫靶效率顯著降低[39]。3)基因組位點、宿主細胞類型、培養條件、Cas9 及sgRNA 復合物濃度和Cas9 蛋白持續表達的時間等多種因素都會影響編輯的精確性[40-42]。宿主細胞中持續高水平的表達Cas9蛋白能夠提高靶基因編輯效率,但sgRNA 的錯配耐受數也在增加,脫靶效應的風險會更高。為了減少這種影響,2017 年,Rauch 等人通過添加Cas9 核酸酶抑制劑Acr ⅡA4調節Cas9 核酸酶在細胞中表達的時間[43]。
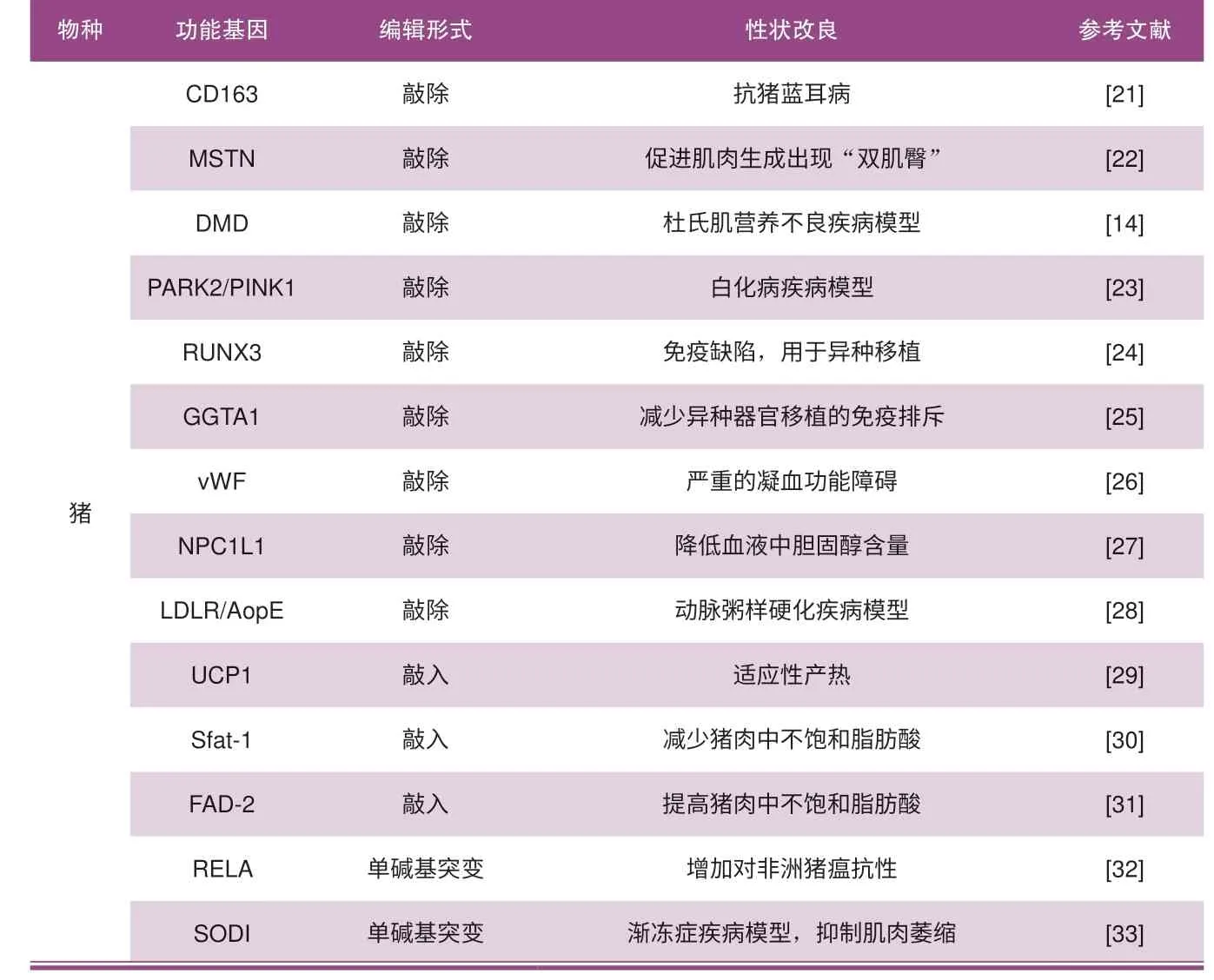
表1 基因編輯技術在豬基因組編輯中應用的部分實例
5 小結與展望
近年來,CRISPR/Cas9 基因編輯技術除了在小鼠、果蠅、斑馬魚等常見的實驗動物中應用之外,還在豬、牛、羊等大型動物以及靈長類動物—食蟹猴等都有廣泛應用,展現出基因編輯技術未來發展的無限可能,但編輯效率、脫靶效應和打靶特異性等許多問題亟待解決,尤其是需要克服脫靶效應,“零脫靶” 是未來基因編輯走向臨床應用上的重中之重。目前,CRISPR/Cas 系統所衍生出來的新技術正在逐步優化和改進,但開發更精準高效的基因編輯新技術仍是未來需要攻破的難題和努力的方向,這對于研究人員來說既是一種新的挑戰,同時也是基因編輯技術發展的機遇和重要突破。

