模擬四氫葉酸輔酶的結(jié)構(gòu)與功能生物體外轉(zhuǎn)移直鏈四個(gè)碳單元
郭文彥, 閆瑾, 郝靜, 陳建新,2*
1.山西師范大學(xué)現(xiàn)代文理學(xué)院, 山西 臨汾 041000;2.山西師范大學(xué)化學(xué)與材料科學(xué)學(xué)院, 山西 臨汾 041004
在生物體內(nèi),四氫葉酸輔酶(Tetrahydrofolate, 簡(jiǎn)寫(xiě)為T(mén)HF)的作用是傳遞與轉(zhuǎn)移一個(gè)碳單元.在生物化合物的合成和代謝過(guò)程中,離不開(kāi)一個(gè)碳原子化合物的參與,而這種過(guò)程除二氧化碳外, 主要靠THF輔酶把甲酸、甲醛、甲醇三種氧化態(tài)的一個(gè)碳單元傳遞,這也是生物體內(nèi)各種化合物甲基化的主要來(lái)源[1].現(xiàn)已發(fā)現(xiàn),天然四氫葉酸輔酶有6種結(jié)構(gòu), 其中4種為甲酸氧化態(tài),一種為甲醛氧化態(tài),一種為甲醇氧化態(tài)[2~4].圖1是THF的結(jié)構(gòu)和代表性的三種氧化態(tài)結(jié)構(gòu),1為T(mén)HF未接受一個(gè)碳單元時(shí)的結(jié)構(gòu),2、3、4為獲得一個(gè)碳單元后擬轉(zhuǎn)移時(shí)的結(jié)構(gòu).按照一個(gè)碳單元的結(jié)構(gòu)不同,2被稱(chēng)為T(mén)HF甲酸氧化態(tài),3被稱(chēng)為T(mén)HF的甲醛氧化態(tài),4被稱(chēng)為T(mén)HF的甲醇氧化態(tài).生物體內(nèi)THF甲酸氧化態(tài)一個(gè)碳單元轉(zhuǎn)移過(guò)程由圖2所示的方法進(jìn)行[5].
按這一例中的方法,次甲基可被轉(zhuǎn)移到甘氨酰胺核苷酸合成酶、絲氨酸轉(zhuǎn)羥甲基酶、胸苷酸合成酶和轉(zhuǎn)甲酰酶等分子中.
通過(guò)研究甲酸氧化態(tài)的四氫葉酸輔酶的結(jié)構(gòu)和轉(zhuǎn)移次甲基的作用機(jī)理,發(fā)現(xiàn)反應(yīng)的活性中心是包括N5和N10在內(nèi)的咪唑啉五元環(huán)(圖1結(jié)構(gòu)2),其活性大小與N5和N10的pKa有關(guān).在THF中,N5和N10由于連有不對(duì)稱(chēng)的嘧啶環(huán)和苯甲酸,使其二者的pKa產(chǎn)生很大差別(分別為4.8和-1.3)[6],導(dǎo)致咪唑啉環(huán)有較大的活性,容易打開(kāi),因而為轉(zhuǎn)移次甲基提供了條件.將這種反應(yīng)機(jī)理應(yīng)用于有機(jī)合成中,在生物體外實(shí)現(xiàn)基團(tuán)的轉(zhuǎn)移,無(wú)疑是一個(gè)具有重要理論意義和應(yīng)用價(jià)值的研究課題.最早對(duì)THF模擬研究的是荷蘭的Pandit教授研究小組,他們選擇咪唑啉環(huán)作為結(jié)構(gòu)中心,合成了碘化1,4,4-三甲基-3-對(duì)甲苯磺酰基咪唑啉作為甲酸氧化態(tài)的THF模型,然后研究了它的反應(yīng)性能,實(shí)現(xiàn)了體外一個(gè)碳單元的轉(zhuǎn)移反應(yīng)[7~9].之后山西大學(xué)夏熾中教授課題組合成了幾種2-甲基取代的咪唑啉鹽作為甲酸氧化態(tài)模型化合物,實(shí)現(xiàn)了體外兩個(gè)碳單元的轉(zhuǎn)移反應(yīng),轉(zhuǎn)移基團(tuán)的功能擴(kuò)展到了兩個(gè)碳單元[10~13].西北大學(xué)的史真教授課題組以苯并咪唑啉鹽作為四氫葉酸輔酶模型化合物,通過(guò)與格氏試劑反應(yīng),得到相應(yīng)的醛和酮[14],但反應(yīng)只能與強(qiáng)親核試劑進(jìn)行,轉(zhuǎn)移反應(yīng)受到了限制.本課題組已合成了兩種模型化合物,含有擬轉(zhuǎn)移的三個(gè)碳的次丙基單元和四個(gè)碳的次異丁基單元,實(shí)現(xiàn)這些碳單元的全轉(zhuǎn)移和部分轉(zhuǎn)移[15~17].但至今還沒(méi)有發(fā)現(xiàn)四個(gè)碳的次丁基單元通過(guò)四氫葉酸甲酸氧化態(tài)模型進(jìn)行轉(zhuǎn)移的研究.本文合成了甲酸氧化態(tài)的新模型化合物碘化1-甲基-2-丙基-3-苯磺酰基咪唑啉,探索其轉(zhuǎn)移次丁基單元的功能,發(fā)現(xiàn)轉(zhuǎn)移反應(yīng)能夠順利進(jìn)行,實(shí)現(xiàn)了次丁基的全轉(zhuǎn)移和半轉(zhuǎn)移,下面將介紹這一研究工作.
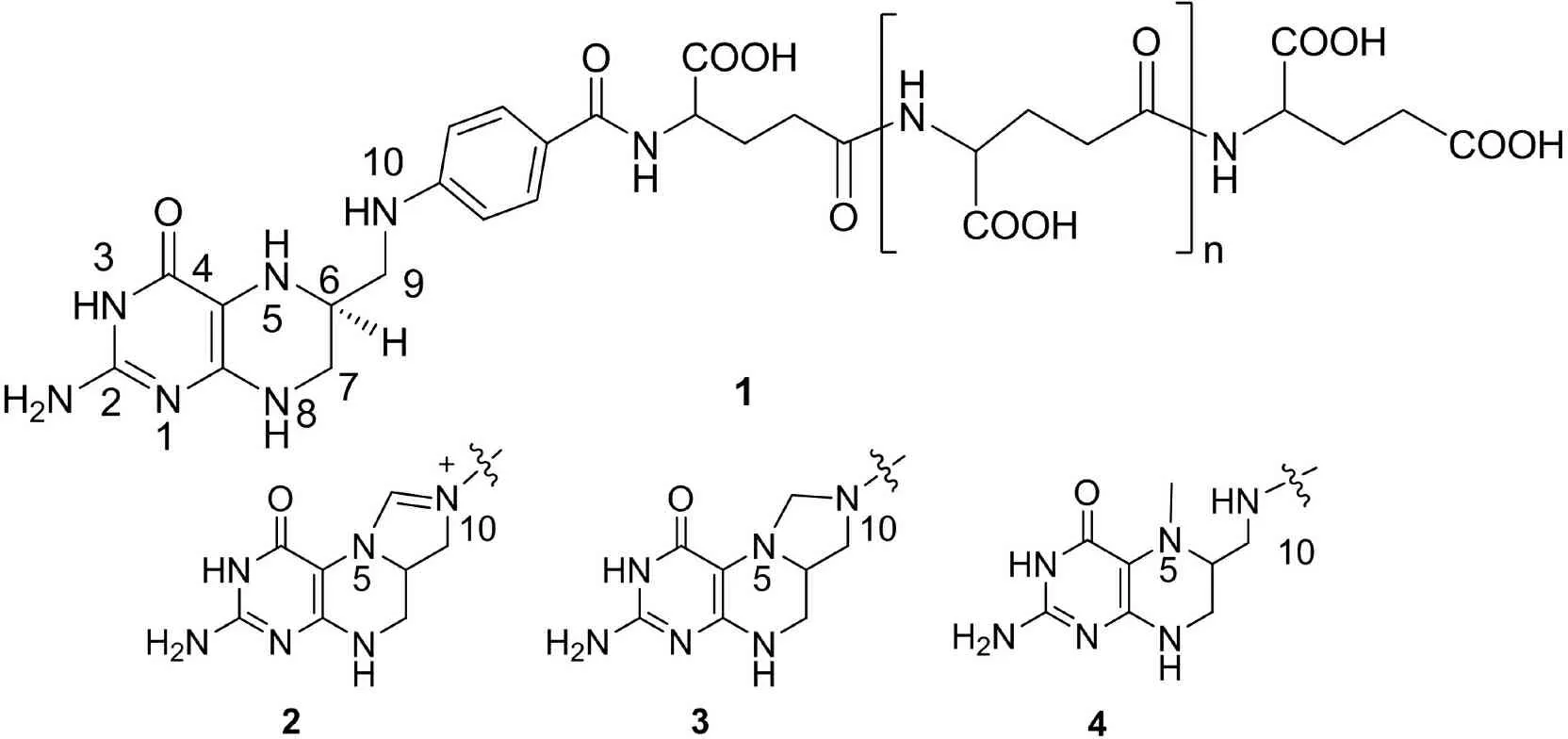
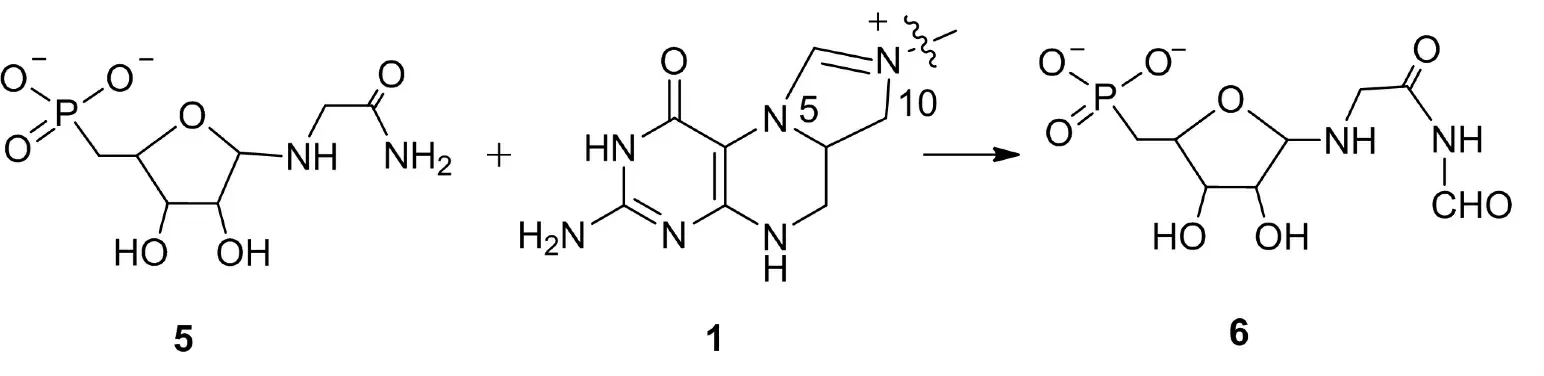
圖1 四氫葉酸輔酶的結(jié)構(gòu)和它的三種氧化態(tài)的結(jié)構(gòu)Fig.1 The structure of THF and three kinds of oxidation levels of THF
圖2 甲酸氧化態(tài)的四氫葉酸輔酶一碳單元轉(zhuǎn)移反應(yīng)
Fig.2 The transfer reaction of one carbon units of THF at the oxidation level of formate
1 實(shí)驗(yàn)部分
1.1 儀器和試劑
Bruker AV600型核磁共振波譜儀(瑞士布魯克公司), TMS為內(nèi)標(biāo);EA-1108型四元素分析儀(意大利卡勞爾巴公司);IMPACT-410傅里葉變換紅外光譜儀(KBr壓片); WP-2型熔點(diǎn)測(cè)定儀(北京第三光學(xué)儀器廠),溫度未經(jīng)校正.
1.2 模型化合物碘化1-甲基-2-丙基-3-苯磺酰基咪唑啉的合成
化合物7、8 、9和10參照文獻(xiàn)[15] 合成.模型化合物10: 淡黃色固體, 產(chǎn)率87 %, m.p. 128.0 ℃~129.0 ℃.1H NMR (600 MHz, CDCl3) δ: 8.13~7.70 (m, 5H), 4.29 (br s, 4H), 3.40 (s, 3H), 3.01 (t,J= 7.8 Hz, 2H),1.68~1.77 (m, 2H), 1.11(t,J= 7.8 Hz, 3H).13C NMR (151 MHz, CDCl3)δ:169.7,136.0,135.0, 130.4,128.6, 52.1,47.3,36.6,28.7,20.4,14.4.IR (KBr)ν:1 680,1 624,1 452,1 190 cm-1.Anal.calcd for C13H19N2O2SI:C 39.60, H4.86, N7.11;found C39.32, H4.61,N6.88.
1.3 次丁基的轉(zhuǎn)移反應(yīng)
模型化合物10 (1.18 g, 3 mmol) 加入到8 mL無(wú)水乙腈中,然后加入鄰苯二胺(或鄰氨基苯酚) 3 mmol, 加熱回流, TLC監(jiān)測(cè)反應(yīng),當(dāng)反應(yīng)完全后冷卻, 加入稀NaHCO3溶液攪拌1 h, 用CHCl3萃取,無(wú)水Na2SO4干燥萃取液,濃縮,靜置過(guò)夜,析出晶體,過(guò)濾得化合物13, 母液濃縮, 柱色譜分離再得到少量產(chǎn)物. 化合物14柱色譜分離得產(chǎn)物.
化合物13:白色固體,產(chǎn)率72 %, m.p.157.0 ℃~158.0 ℃ (lit. 157.0~157.5[21]).1H NMR (600 MHz,DMSO-d6)δ: 12.05 (s, 1H), 7.48~7.35 (m, 2H), 7.13~6.93 (m, 2H), 2.75 (t,J=7.8 Hz, 2H),1.77(m,J= 7.8, 7.2 Hz, 2H), 0.91 (t,J= 7.2 Hz, 3H).
化合物14:淡黃色液體, 產(chǎn)率70 %.1H NMR (600 MHz, CDCl3)δ: 7.69~7.29 (m, 4H), 2.93 (t,J= 7.8 Hz, 2H), 1.93 (m, 2H), 1.06 (t,J= 7.2 Hz, 3H).Anal Calcd for C10H11NO:C,74.51;H,6.88; N, 8.69. found C, 74.30; H, 6.72; N, 8.54.
1.4 模型化合物10與伯胺反應(yīng)合成不同基團(tuán)N, N, N’-三取代乙二胺鹽19~22
模型化合物10 (0. 39 g, 1 mmol) 加入到4 mL無(wú)水乙腈中,然后加入胺類(lèi)化合物1 mmol,加熱回流,TLC監(jiān)測(cè)反應(yīng),待反應(yīng)完成后停止反應(yīng),濃縮反應(yīng)液,放置析出晶體,過(guò)濾得產(chǎn)物19~22.
化合物19:模型化合物10(0.39 g, 1 mmol),苯胺(0.093 g, 1 mmol),3.6 mL無(wú)水乙腈,回流7 h,得白色晶體0.40 g,產(chǎn)率 80.6 %.1H NMR (600 MHz, CDCl3)δ:10.17,9.49 (ss, 1H),7.94~7.14 (m, 10H), 4.15, 3.79 (tt,J=5.4 Hz, 2H), 3.56~3.23 (m, 5H), 2.68~2.49 (m, 2H), 1.82 (br s, 1H), 1.69~1.49 (m, 2H), 0.83 (t,J=7.2 Hz, 3H).13C NMR (151 MHz, CDCl3)δ:168.2,135.0,132.9,129.8,129.7,129.3,129.2,128.2,127.9,127.1,126.8,52.6,40.2,39.4,31.4,19.4,14.1.Anal.Calcd for C19H26IN3O2S:C, 46.82;H,5.38;N, 8.62. found C,46.65; H,5.42;N,8.51.
化合物20: 模型化合物10 (0.39 g, 1 mmol), 對(duì)甲苯胺(0.105 g, 1 mmol), 3.6 mL無(wú)水乙腈, 回流6.5 h,得黃色固體0.43 g, 產(chǎn)率 85 %.1H NMR (600 MHz, CDCl3)δ:10.00(ss, 1H), 9.36(ss, 1H), 7.92~7.11 (m, 9H), 4.12, 3.78 (tt,J=5.4 Hz, 2H), 3.78~3.01 (m, 5H), 2.90~2.65 (m, 1H), 2.51~2.28 (m, 5H), 1.66~1.48 (m, 2H),0.83(t,J=7.2 Hz, 3H).13C NMR (151 MHz, CDCl3)δ: 168.2, 139.9, 139.2, 132.8, 132.4, 130.4, 130.3, 129.3, 129.4, 127.6, 127.1, 126.8, 52.5, 40.2, 39.4, 31.2, 21.2, 19.4, 14.1. Anal. Calcd for C20H28IN3O2S: C, 47.91; H, 5.63; N, 8.38. found C, 47.82; H, 5.51; N, 8.42.
化合物21: 模型化合物10 (0.39 g, 1 mmol), 對(duì)甲氧基苯胺(0.121 g, 1 mmol), 3.6 mL無(wú)水乙腈, 回流6.5 h,得黃色固體0.37 g,產(chǎn)率 72 %.1H NMR (600 MHz, CDCl3)δ:10.17, 9.30 (ss, 1H), 7.95~6.91 (m, 9H), 4.16, 3.79 (tt,J=5.4 Hz, 2H),3.85(ss, 3H), 3.84 (ss, 3H), 3.59 (m, 6H)~3.28(m, 6H), 2.72, 2.51 (tt,J=5.4 Hz, 2H), 1.70~1.50 (m, 2H), 0.89 (t,J=7.2 Hz, 3H).13C NMR (151 MHz, CDCl3)δ:168.5, 139.9,139.2,132.8,132.4, 130.4,130.3,129.3,129.4,127.6,127.1,126.8,52.5,40.2,39.4,31.2,27.2,19.4,14.1.Anal. Calcd for C20H28IN3O3S:C, 46.42; H, 5.45; N, 8.12. found C, 46.21; H, 5.34; N,8.03.
化合物22:模型化合物10(0.39 g,1 mmol),對(duì)氯苯胺(0.128 g,1 mmol), 3.6 mL無(wú)水乙腈, 回流7 h,得黃色油狀液體0.35 g,產(chǎn)率 77 %.1H NMR (600 MHz, CDCl3) δ: 10.24(ss, 1H), 9.58 (ss, 1H), 7.89(m, 9H)~7.06 (m, 9H), 4.17, 3.79 (tt,J=5.4 Hz, 2H), 3.60~3.27 (m, 6H),2.72~2.51 (m, 2H),1.70~1.52 (m, 2H),0.89,0.86(tt,J=7.2 Hz, 3H).13C NMR (151 MHz, CDCl3)δ:168.2,135.0,132.9,129.8,129.7,129.2,127.9,127.1,126.8,52.6,40.2,39.4,31.3,19.4,14.1.Anal.Calcd for C20H25ClIN3O2S:C, 43.73; H, 4.83; N, 8.05. found C, 43.54; H, 4.62; N, 8.12.
2 結(jié)果與討論
2.1 四氫葉酸輔酶模型的合成
甲酸氧化態(tài)四氫葉酸輔酶2的活性中心是N5,N10所組成的咪唑啉五元環(huán) (圖1),其轉(zhuǎn)移一碳單元的活性是由N5,N10所連基團(tuán)的性質(zhì)所決定.模擬四氫葉酸輔酶的功能,首先要模擬其結(jié)構(gòu),制備模型化合物.本文選擇五元環(huán)的咪唑啉結(jié)構(gòu)作為甲酸氧化態(tài)模型的反應(yīng)中心,考慮到咪唑啉環(huán)的穩(wěn)定性和轉(zhuǎn)移基團(tuán)的反應(yīng)活性,我們選擇了比四氫葉酸所連基團(tuán)小的甲基和苯磺酰基,作為反應(yīng)中心咪唑啉氮原子上連接的基團(tuán),使這兩個(gè)基團(tuán)具有較大的電子效應(yīng)差異,提高其反應(yīng)活性.在咪唑啉環(huán)的2位上放置丙基使擬轉(zhuǎn)移的基團(tuán)是次丁基,希望實(shí)現(xiàn)四個(gè)直鏈碳單元的轉(zhuǎn)移,而這兩個(gè)基團(tuán)也具有穩(wěn)定環(huán)的作用,合成了模型化合物10 (圖3).實(shí)驗(yàn)發(fā)現(xiàn)10既具有一定的穩(wěn)定性,又具有比較高的反應(yīng)活性,能夠?qū)崿F(xiàn)轉(zhuǎn)移反應(yīng).
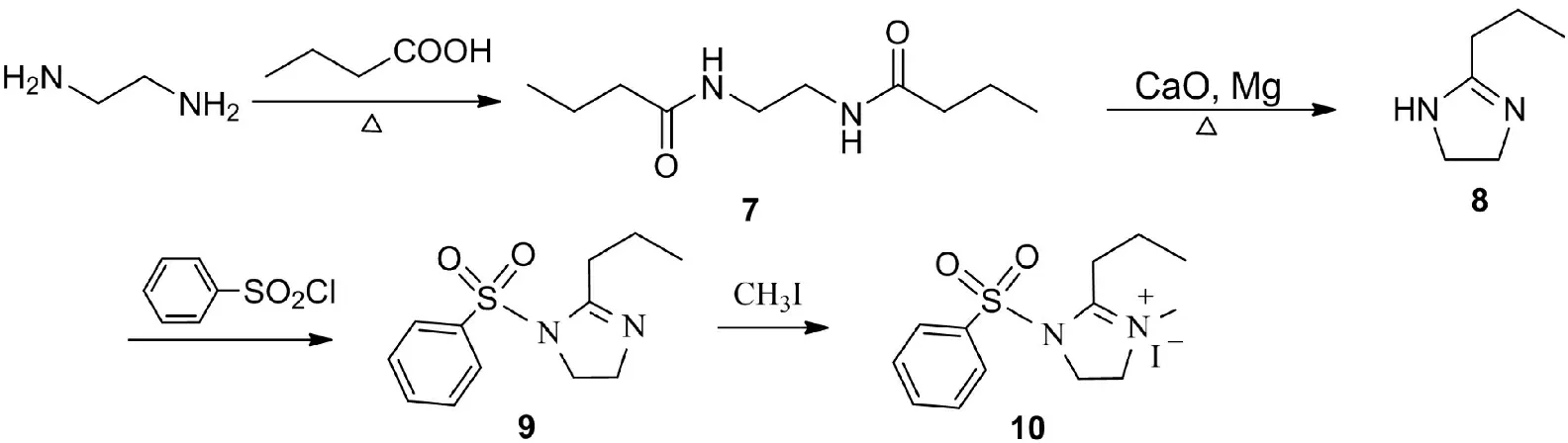
圖3 THF模型化合物10的合成路線
Fig.3 Synthesis route of THF model 10
2.2 四氫葉酸輔酶模型的全轉(zhuǎn)移反應(yīng)
模型化合物10與含有親核性雙官能團(tuán)的試劑如鄰苯二胺(11)、鄰氨基苯酚(12)反應(yīng) (圖 4),生成產(chǎn)物13和14,使次丁基順利地轉(zhuǎn)移給底物,反應(yīng)條件簡(jiǎn)單,轉(zhuǎn)移效率高.此過(guò)程不僅模擬了THF甲酸態(tài)1的一碳單元轉(zhuǎn)移反應(yīng),而且擴(kuò)展到甲酸態(tài)的四個(gè)碳的單元在體外簡(jiǎn)單條件下的轉(zhuǎn)移,基團(tuán)碎片既可轉(zhuǎn)移給兩個(gè)氮原子,也可轉(zhuǎn)移給氧、氮等不同的親核原子,從幾方面驗(yàn)證了四氫葉酸轉(zhuǎn)移基團(tuán)的功能.生成的產(chǎn)物是2-取代的苯并咪唑衍生物和2-取代苯并噁唑衍生物,它們都是生物化學(xué)和藥學(xué)上重要的化合物[18~20],因此這一反應(yīng)也為合成這些化合物提供了一種新的合成路線.一般方法合成這些物質(zhì),需用羧酸及其取代羧酸或者醛在酸性條件或氧化劑存在下完成,本方法是在中性條件下、無(wú)氧化劑存在的溫和環(huán)境中完成,具有明顯的反應(yīng)優(yōu)點(diǎn),特別適合含多個(gè)官能團(tuán)的化合物在不影響其他官能團(tuán)的情況下構(gòu)建這種雜環(huán)結(jié)構(gòu).
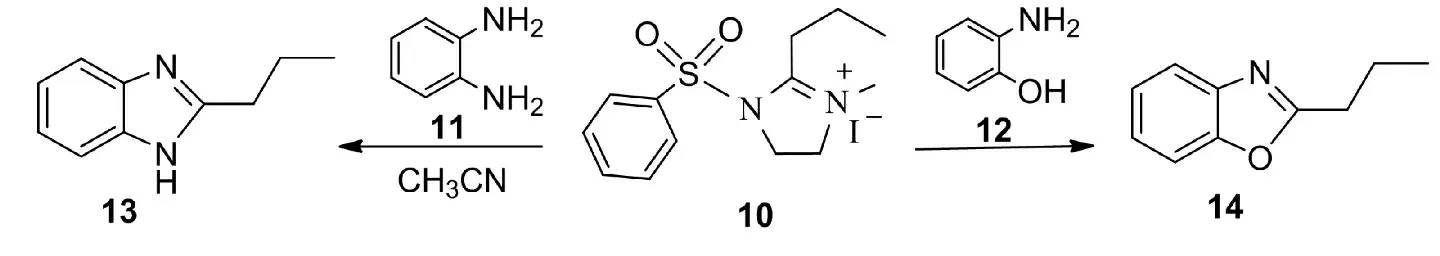
圖4 THF模型化合物10的基團(tuán)轉(zhuǎn)移反應(yīng)
Fig.4 Group transfer reaction of THF models 10
2.3 四氫葉酸輔酶模型的部分轉(zhuǎn)移反應(yīng)
模型化合物10的2位上具有較強(qiáng)的正電性,在13C NMR的檢測(cè)中, 化學(xué)位移處在羰基區(qū)(169.7 ppm), 易被親核基團(tuán)進(jìn)攻,可與含有單官能團(tuán)親核試劑的芳香伯胺(苯胺、對(duì)甲基苯胺、對(duì)甲氧基苯胺、對(duì)氯苯胺) 發(fā)生親核加成反應(yīng),生成化合物19~22(圖5),使次丁基發(fā)生了部分轉(zhuǎn)移,產(chǎn)物的結(jié)構(gòu)是不同基團(tuán)取代的N, N, N’-三取代乙二胺鹽,在藥物研究中具有重要用途,用其他方法合成需多步反應(yīng)才能完成,而利用以上反應(yīng), 卻佷方便,因而為這類(lèi)化合物的合成提供了一種簡(jiǎn)便方法.
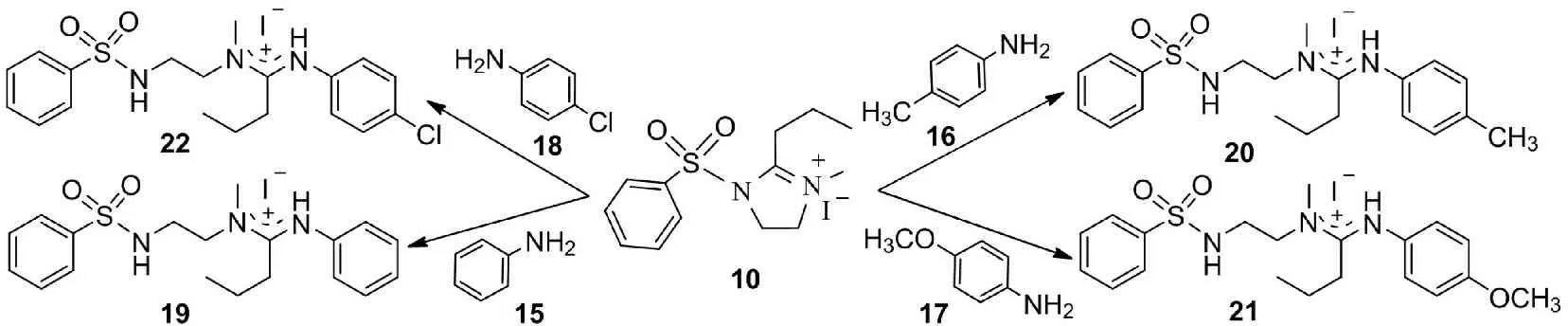
圖5 THF模型化合物10與芳香胺類(lèi)化合物的反應(yīng)
Fig.5 The reaction of THF model 10 with aryl amines
3 結(jié)論
模擬四氫葉酸的結(jié)構(gòu)和反應(yīng)特性,合成了可轉(zhuǎn)移四個(gè)直鏈碳原子,即次丁基單元的甲酸態(tài)模型化合物,模擬了四氫葉酸輔酶在生物體內(nèi)的一碳單元轉(zhuǎn)移功能,實(shí)現(xiàn)了擴(kuò)展轉(zhuǎn)移范圍和條件,達(dá)到生物體外四個(gè)碳單元的直接轉(zhuǎn)移.為有機(jī)合成提供了合成2-取代的苯并咪唑衍生物和2-取代苯并噁唑衍生物的簡(jiǎn)便方法.通過(guò)模型與芳香氨類(lèi)化合物的親核加成反應(yīng),生成了不同基團(tuán)取代的N, N, N’-三取代乙二胺衍生物,發(fā)現(xiàn)了這類(lèi)化合物的簡(jiǎn)易合成法.另外, 這些實(shí)驗(yàn)對(duì)四氫葉酸輔酶在生物體內(nèi)的一碳單元轉(zhuǎn)移功能的反應(yīng)機(jī)理也得到了進(jìn)一步驗(yàn)證與確定.

