磁化率定量成像評估靶向藥物對肺腺癌伴腦轉移治療反應的隨訪一例
李雪平,張鑫,李茗,張慶雷,張冰*
作者單位:
1. 南京醫科大學鼓樓臨床醫學院,南京 210000
2. 南京大學醫學院附屬鼓樓醫院醫學影像科,南京 210000
1Nanjing Drum Tower Hospital Clinical College of Nanjing Medical University, Nanjing 210000, China
2Department of Radiology, Nanjing Drum Tower Hospital, the Affiliated Hospital of Nangjing University Medical School, Nanjing 210000, China
患者男,65歲。無明顯誘因出現頭痛及胸痛1個月余,伴有乏力納差消瘦,2016年4月18日收治入院。首診影像表現:胸部CT示左肺上葉肺癌可能。肺穿刺活檢病理及基因檢測:左肺腺癌。肺組織示肺泡上皮異性增生,部分區域間異型纖體浸潤性生長(圖1A)。免疫組化示癌細胞表達KI67約67% (+)、HER2 (0)、EGFR (+)、ERCC1 (++)、BRCA1 (-)、PD-L1(-)、E-CAD (+)、VIM。免疫組化及基因檢測示EGFR陽性,EGFR基因第21外顯子攜帶L858R突變。頭顱MRI示雙側額葉及左側枕葉見多發結節狀異常信號影,呈環形強化(圖1B),其中左側枕葉病灶呈短T1信號(圖1C),余腦內未見明確短T1信號影(圖1D)。診斷印象:考慮為腦內多發轉移瘤,左側枕葉病灶伴瘤內出血可能。
入院診斷及治療經過:左肺腺癌IV期,患者于2016年4月口服一代分子靶向藥物EGFR-TKIs (吉非替尼),每2個月常規影像隨訪一次。2017年4月產生耐藥后,改換三代靶向藥物AZD9291,繼續隨訪至2018年4月,共隨訪11次,其中隨訪第18、21及24個月增加了高分辨頭顱磁化率定量成像(quantitative susceptibility mapping,QSM)。患者于2018年6月去世。
隨訪影像表現:(1)腦內多發環形強化病灶的轉歸:治療2個月后、4個月至24個月,腦內均未見異常強化病灶。隨訪第24個月QSM示上述病灶呈多發結節狀負信號(圖1E),信號數值范圍為-0.596~-0.295 ppm,考慮為多發鈣化。(2)左側枕葉短T1病灶的轉歸:治療2個月后,左側枕葉病灶短T1信號轉變為長T1信號,增強后無強化,4~24個月無變化,隨訪24個月QSM示左側枕葉見結節狀正信號影(圖1F),測量信號數值為0.845 ppm,考慮為含鐵血黃素沉積。(3)隨訪中新發病灶的轉歸:隨訪24個月QSM示上述病灶呈多發點狀負信號影(圖1G),信號數值范圍為-0.337~-0.279 ppm,考慮為多發鈣化。靶向藥物治療前(圖1D)、治療2個月及4個月后腦內未見明顯異常短T1信號影,隨訪6個月,腦內見新發多發點狀短T1信號(圖1H),增強后未見強化,之后至24個月,未見明顯變化。(4)肺癌的體積隨訪變化:肺癌體積計算采用V=最大截面積×層厚×層數×π/6來評估(經Shapiro-Wilk檢驗P>0.05,數據呈正態性分布),患者首診胸部CT肺癌體積為V0=11690.6 mm3,治療2個月后V1=3778.5 mm3,以V1為參考值,采用單樣本t檢驗分析患者靶向藥物治療4~24個月隨訪期間肺癌體積變化與V1之間的差異,結果顯示無統計學意義(P=0.198)。使用SPSS軟件(版本21;IBM,芝加哥,美國),P<0.05為差異有統計學意義。
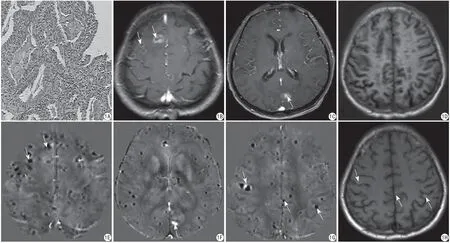
圖1 患者,男,64歲。A:HE染色( ×200),肺泡上皮異性增生,部分區域間異型纖體浸潤性生長。B~D:靶向藥物治療前。B:頭顱T1WI增強示雙側額葉見多發環形強化灶(白箭);C:頭顱T1WI增強示左側枕葉見結節狀短T1信號影,增強后可見強化(白箭);D:頭顱T1WI平掃示腦內未見明顯異常短T1信號影。E~G:治療24個月后,高分辨頭顱QSM檢查。E:首診雙側額葉多發環形強化病灶呈結節狀負信號影;F:首診左側枕葉短T1信號病灶呈正信號影;G:治療6個月后腦內新發多發點狀短T1信號病灶呈負信號影。H:靶向藥物治療6個月后,T1WI平掃示腦內見多發新發點狀短T1信號影Fig.1 A 64-year-old male patient. A: The results of HE staining ( ×200), heterosexual proliferation of alveolar epithelium and infiltrating growth of some interregional dysplasia. B—D: Before treating with molecule-targeted drugs. B: Axial pro-contrast T1WI shows multiple nodules with ring-enhancement in the bilateral frontal lobe (white arrow). C: Axial pro-contrast T1WI shows a nodule that demonstrates short T1 signal with enhancement in the left occipital lobe (white arrow). D: Axial pre-contrast T1WI doesn't demonstrate any short T1 signals in the cerebral hemisphere. E—G: After treating with molecule-targeted drugs for 24th months. The patient underwent brain QSM examination. E: Multiple nodules with ring-enhancement in the bilateral frontal lobe at first diagnosis show low susceptibility values. F: The lesion in the left occipital lobe shows a high susceptibility value. G: Multiple new lesions after treating with molecule-targeted drugs for six months show low susceptibility values. H: After treating with molecule-targeted drugs for six months. Axial pre-contrast T1WI demonstrates multiple nodules with short T1 signals in the cerebral hemisphere.
討論 肺腺癌是發病率和病死率較高的惡性腫瘤,50%以上的患者會出現腦轉移,大多數肺腺癌患者存在EGFR表達或過表達[1],分子靶向藥物較廣泛應用治療中晚期患者。本例患者肺癌體積變化的統計結果說明靶向藥物治療后肺部腫塊對藥物的早期反應明顯,治療后病灶體積明顯減小,但是治療2個月之后,直至中晚期,病灶不再縮小,體積呈穩定趨勢,提示早期療效顯著,中晚期療效穩定在一定水平。
腦內多發轉移瘤在增強MRI上呈環形強化,與血腦屏障破壞及腫瘤血管增生有關。由于靶向藥物為小分子藥物,可通過血腦屏障,以表皮生長因子受體酪氨酸激酶作為靶標,抑制受體酪氨酸激酶的活性,來抑制腫瘤血管生成和細胞增殖[2]。因此,在治療隨訪全過程中,病灶未見異常強化及增大,隨訪后期,經QSM證實病灶轉歸為鈣化,證明靶向藥物治療可抑制腦轉移瘤病灶的生長及促進病灶內鈣鹽沉積。
根據短T1信號的形成原理,左側枕葉短T1病灶,可能為出血,也可能為鈣化。而QSM與常規磁共振相比,是唯一能從信號數值上定量區別出血(0.4~2.5 ppm)及鈣化(-1.2~-0.6 ppm)的成像方法[3],該病灶經QSM證實為出血。瘤內出血可能由于腫瘤新生血管增多,血管壁發育不成熟導致血管脆性增加而發生破裂,也可能提示是靶向藥物治療控制不佳的病灶。
隨訪中新發的多發短T1病灶,可為鈣化或微出血,隨訪后期,經QSM證實為鈣化。由于常規MRI對微出血及鈣化顯示均不敏感,頭顱CT雖可檢測鈣化,但對微小鈣化及微出血顯示不佳,且存在電離輻射,而QSM是高分辨磁化率成像(分辨率為0.6 mm×0.6 mm),對≥0.6 mm的微出血及鈣化顯示敏感,而且不存在輻射損傷,有利于轉移瘤患者多次長期復查。因此,我們建議在肺癌伴腦轉移靶向藥物治療的患者隨訪中,可在常規頭顱MRI的基礎上加入QSM序列,可以更好地觀察評估轉移瘤對藥物的治療反應。
利益沖突:無。

