KAl(SO4)2·12H2O-MgSO4·7H2O復合相變體系儲能特性的探究
溫輝 林玉瓊 郭慈綿 黃家玲 林伊 顏源鳳 陳景樂 曾穎

摘? ? ? 要:KAl(SO?)?·12H?O和MgSO4·7H2O作為常見的水合無機鹽相變材料,具有相變潛熱較大、原料較廉價易得等優點。篩選并制備出KAl(SO?)?·12H?O和MgSO4·7H2O質量配比為6:4的復合相變材料,取純體系樣品4份加入質量比(wt%)分別與1%Na2B4O7·10H2O、1%石墨粉、2% MgCl2、2% AlCl3進行混合改性。結果表明:室溫條件下加入1%Na2B4O7·10H2O成核劑體系的儲熱特性優于加入1%石墨粉、2% MgCl2、2% AlCl3成核劑的體系,不存在過冷現象,降溫過程中相變放熱持續時間長;TG曲線和DSC曲線表明純體系、1%Na2B4O7·10H2O成核劑體系二者質量損失分別為37%和42%,循環后體系DSC曲線與未循環體系趨勢一致,但可看出KAl (SO?)?·12H?O- MgSO4·7H20-1% Na2B4O7·10H2O(Times>10)體系的主峰相比于KAl(SO?)?·12H?O- MgSO4·7H2O純體系更窄,峰值溫度更低,峰積分面積更小,表明循環后體系的整體相變焓降低。
關? 鍵? 字:復合相變材料; 過冷現象; 熱穩定性; 質量損失
中圖分類號:TQ 115? ? ? ?文獻標識碼: A? ? ? ?文章編號: 1671-0460(2019)10-2190-04
Abstract:KAl(SO4)2·12H2O and MgSO4·7H2O are common hydrated inorganic salt phase change materials, they have the advantages of large phase change latent heat and cheaper raw materials. In this paper, KAl(SO4)2·12H2O and MgSO4·7H2O composite phase change materials with mass ratio of 6:4 were prepared. Four pure system samples were respectively modified by 1% Na2B4O7·10H2O,1% graphite powder, 2% MgCl2 or 2% AlCl3. The results showed that the heat storage characteristics of the 1% Na2B4O7·10H2O nucleating agent system at room temperature were better than those of 1% graphite powder, 2% MgCl2 and 2% AlCl3 nucleating agent, there was not supercooling and its phase change exotherm time was the longest during the cooling process. The TG curve and the DSC curve showed that the mass loss of the pure system and 1% Na2B4O7·10H2O nucleator system were 37% and 42%, respectively. The DSC curve of the system after the cycle was consistent with the trend of the uncirculated system, but It was seen that the main peak of KAl(SO4)2·12H2O and MgSO4·7H2O -1% Na2B4O7·10H2O (Times>10) system was narrower than KAl(SO4)2·12H2O and MgSO4·7H2O pure system, and the peak temperature was lower, the peak integral area was smaller, indicating that the overall phase transition of the system after the cycle reduced.
Key words:Composite phase change material; Supercooling; Thermal stability; Mass loss
基于相變材料 (phase change material,PCM) 作為存儲介質的潛熱儲能是一種有效的儲能方式, 可充分利用物質在相態轉變過程中吸收或釋放大量熱能的性質,將其用于熱能的儲存、運輸和轉換[1]。同時,可以把不穩定、不連續的風電、光電以熱能的形式儲存起來,實現對外穩定、連續、高效供熱。因此,潛熱儲能技術在許多領域中有著廣泛的應用, 如太陽能用電、工業余熱回收、生活儲熱等[2-5]。
其中水合無機鹽是典型的相變儲能材料,與有機材料相比,具有儲熱密度大,導熱系數高,相變溫度適中,低價易得等優點[6];但在實際應用過程中多數水合無機鹽相變材料也存在有過冷度較大和相分離嚴重等問題,嚴重制約了無機水合鹽的使用前景。許多研究者也對這類問題做出了相關研究[7],因此在水合無機鹽相變儲能特性的探究中,找到適合的配比以及加入適量的成核劑和增稠劑來消除或降低上述問題是實驗探究的關鍵。
硫酸鹽系KAl(SO?)?·12H?O和MgSO4·7H2O作為常見的水合無機鹽相變材料,其熔點分別為92.5 ℃和70~80 ℃(失去4份結晶水),二者混合物屬中低溫(20~200 ℃)儲熱材料,相變潛熱較大,且原料較廉價易得等優點,近年來受到廣泛研究[8]。本文其中,鐘世民[9]在鉀明礬儲能體系添加1%質量比(1%)成核劑MgCl2·6H2O時,可達到相變溫度較高和過冷度最小的效果;文獻[10]中提到日本一專利利用MgSO2·7H2O和Na2SO4·10H2O為混合水合無機鹽作為相變儲能材料,可使儀器室室溫保持在25 ℃左右,能應用于實際中。
本文前期通過大量實驗,結合KAl(SO?)?·12H?O和MgSO4·7H20的諸多優點,篩選并制備出KAl(SO?)2·12H?O和MgSO4·7H2O質量配比為6∶4的復合相變材料,具體探究了KAl(SO?)?·12H?O- MgSO4·7H2O體系在加入不同成核劑對相變溫度以及其儲熱的影響,從而為北方的熱庫供暖裝置提供一種良好的儲能介質。
1? 實驗部分
1.1? 材料與分析儀器
材料:KAl(SO?)?·12H?O(AR,西隴化工股份有限公司,中國)、MgSO4·7H20(AR,山東西亞化學工業有限公司,中國)、MgCl2(AR, 西隴化工股份有限公司,中國)、石墨粉(AR,西隴化工股份有限公司,中國)、AlCl3(AR,西隴化工股份有限公司,中國)、Na2B4O7·10H2O(AR,西隴化工股份有限公司,中國)。
分析儀器:熱重分析儀(TG-60,日本島津), 熱分析儀(STA 449 F3,德國 耐馳),X射線衍射儀(MiniFlex 600,日本 Rigaku)。
1.2? 制備與分析
在室溫條件下,用研缽將KAl(SO?)?·12H?O和MgSO4·7H2O無機鹽晶體研磨成粉末,按質量比分別為6:4取樣(該體系稱為A體系)加入試管中,隨后置于恒溫水浴鍋(90 ℃)中加熱溶解,待溶解完成后將試管轉移至室溫環境中冷卻,觀察結晶過程,每隔30 s記錄1次數據,繪制步冷曲線,并取少量樣品待測TGA、DSC、XRD;取A體系樣品4份分別與(質量比)1% Na2B4O7·10H2O、1%石墨粉,2% MgCl2、2% AlCl3進行改性(分別稱為A-a、A-b、A-c、A-d體系),取樣分別加入4只試管中置于恒溫水浴鍋(90 ℃)中加熱溶解,待溶解完成后轉移至室溫環境中冷卻,觀察結晶過程,每隔30 s記錄1次數據,繪制步冷曲線,并取少量樣品待測TGA、DSC、XRD。
2? 實驗結果與分析
2.1? 成核劑對KAl(SO?)?·12H?O- MgSO4·7H2O體系過冷的影響
在水合無機鹽相變材料的研究領域中,往往存在成核性能較差,導致過冷度(大氣壓條件下材料到達凝固點后不結晶現象)較大的問題,使得相變材料在實際應用推廣中受到了阻礙。研究表明,非均相的成核方法主要有冷指法、添加成核劑法以及超聲波成核法等[6]。本研究選擇添加成核劑法來探究不同成核劑對KAl(SO?)?·12H?O-MgSO2·7H2O體系過冷的影響。
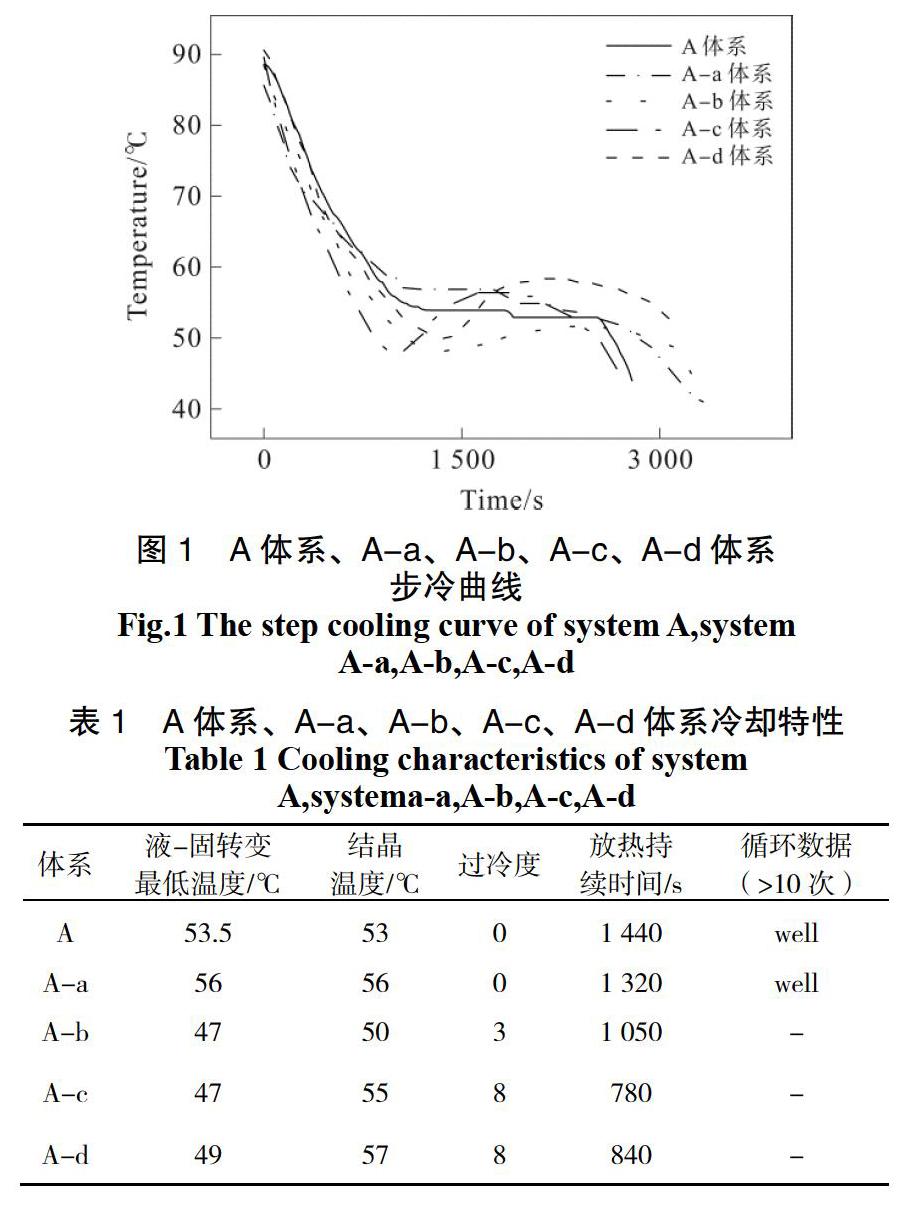
經實驗篩選出A體系和分別加入成核劑A-a、A-b、A-c、A-d體系,記錄數據并繪制步冷曲線如圖1所示。
液-固轉變最低溫度、結晶溫度、過冷度、放熱持續時間、循環數據(>10次)如表1所示。復合相變材料體系在熔融狀態下添加合適的成核劑能對體系的結晶起到促進作用,這是因為添加成核劑提供了結晶所需的晶核,加快了體系的成核結晶速率。結合圖1和表1可以看出A體系和A-a體系的液-固轉變最低溫度分別為53.5和56 ℃,即A-a體系溫度升高約2.5 ℃,不存在過冷現象,成核劑的加入消除相轉變現象,放熱持續時間分別為1 440 s和1 320 s;而A-b、A-c、A-d體系均存在不同程度的過冷現象,放熱時長較短,成核效果較弱等問題;對比A體系和A-a體系的結晶溫度,可以判斷后者液-固轉變最低溫度提高了2.5 ℃,起到提升結晶溫度的促進作用。因此,此實驗條件下A-a體系優于A-b、A-c、A-d體系體系。通過觀察實驗現象A-a體系均不存在相分層現象或相分層現象不明顯。
2.2? KAl (SO?)?·12H?O-MgSO4·7H2O體系的XRD圖譜分析
利用XRD對復合相變體系進行表征,來研究KAl(SO?)?·12H?O和MgSO4·7H2O之間的化學相容性[11,12]。從圖2中可以看出m、n的強衍射峰分別對應為KAl(SO?)?·12H?O和MgSO4·7H2O,且特征峰明顯;p為KAl(SO?)?·12H?O和MgSO4·7H2O相結合后的圖譜,結合后峰值強度高,特征峰明顯,此外,峰的位置沒有發生偏移,表明該復合相變體系的晶體相結構沒有發生改變,能夠較好地結合成二元共晶體。
2.3? KAl(SO?)?·12H?O-MgSO4·7H2O體系的熱穩定性與潛熱分析
經初步篩選可知A體系和加入A-a體系具有較好的冷卻特性,在此基礎上對其進行TGA熱穩定性分析和DSC潛熱分析。
TGA(Thermogravimetric Analysis)和DSC(Differential Scanning Calorimeter)均常用于分析相變材料的熱穩定性、潛熱值的儀器,是熱能存儲應用相變材料的最重要參數之一[1]。
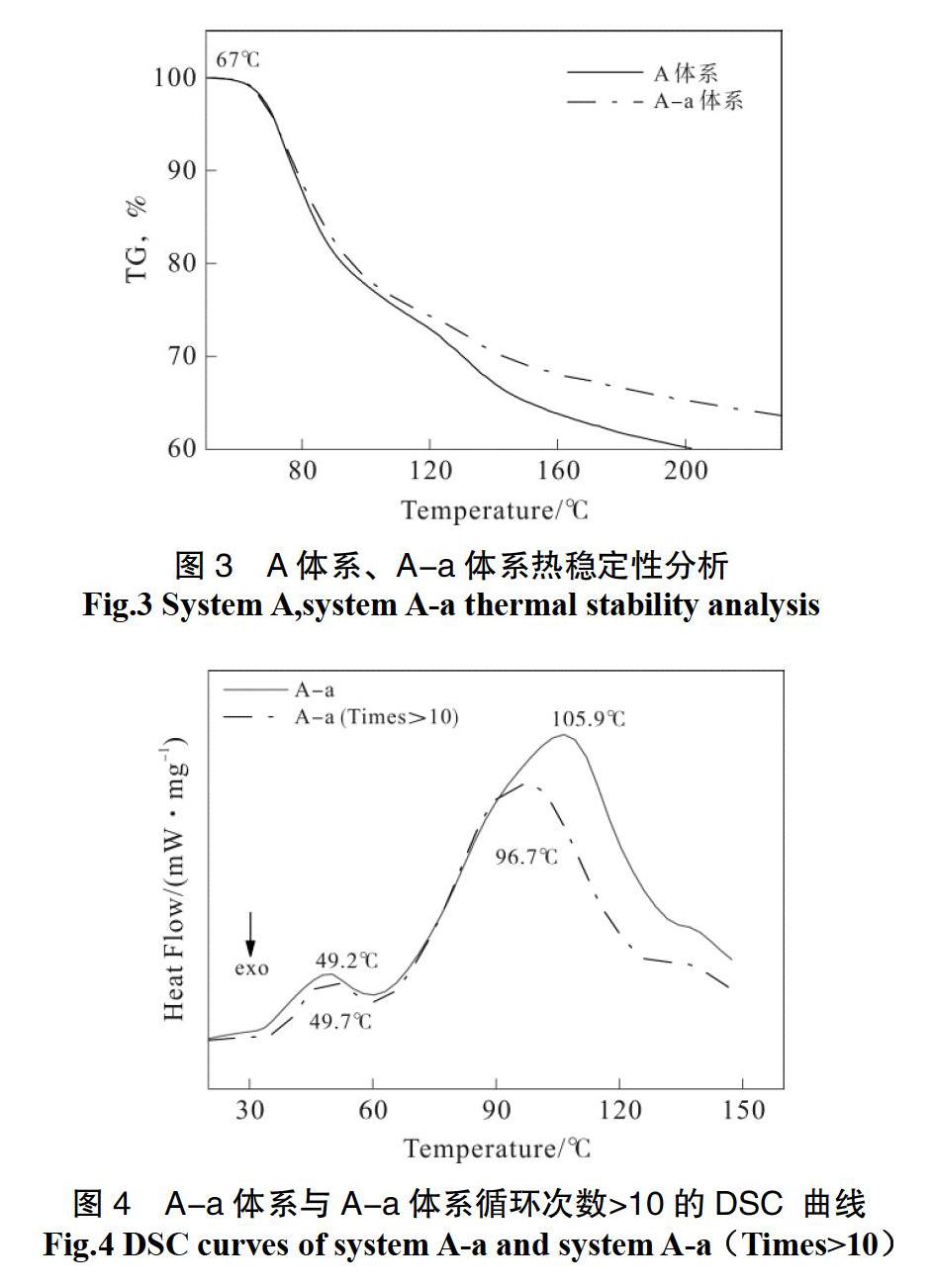
A體系和A-a體系的TG曲線如圖3所示。由TG曲線可以得出A體系與A-a體系均在67 ℃時開始出現質量損失,隨著溫度不斷升高均發生了不同程度的質量損失,其中A體系在67 ℃時失重達37%,67 ℃ A-a體系的失重達42%,可判斷為兩者體系失去不同程度的結晶水所導致,后者質量損失較大因為Na2B4O7·10H2O(a)在60 ℃開始時失去結晶水作用所導致[13]。失去的結晶水將在體系冷卻過程中重新回到無機鹽中。
圖4為A-a體系與A-a體系循環次數>10的DSC 曲線的對比圖,從圖中可明顯看出同一體系存在兩個相變峰。其中A-a體系主峰約在105.9 ℃表示為固-液相變峰,在約49.2 ℃的小峰為該體系的固-固相變峰;A-a (Times>10)體系主峰約在96.7 ℃表示為固-液相變峰,在約49.7 ℃的小峰為該體系的固-固相變峰。
顯然,循環后體系DSC曲線與未循環體系趨勢一致,但可看出A-a(Times>10)體系的主峰相比于A-a體系更窄,峰值溫度更低,峰積分面積更小,表明循環后體系的整體相變焓降低[14,15],但溫度約為49 ℃的小峰則不受循環的影響,表現為固-固相變一致。
3? 結 論
(1)通過分析KAl(SO?)?·12H?O- MgSO4·7H20體系的步冷曲線和冷卻特性可判斷在實驗條件下加入(質量比)1%Na2B4O7·10H2O成核劑體系的儲熱特性優于分別加入1%石墨粉、2% MgCl2、2% AlCl3等成核劑體系,1%Na2B4O7·10H2O成核劑體系不存在過冷現象,放熱持續時間長。
(2)通過對KAl(SO?)?·12H?O- MgSO4·7H2O體系的XRD表征,表明該復合相變體系的晶體相結構沒有發生改變,能夠較好地結合成二元共晶體。
(3)通過對KAl(SO?)?·12H?O- MgSO4·7H2O純體系和加入(質量比)1%Na2B4O7·10H2O體系熱穩定性和潛熱分析,TG曲線和DSC曲線表明二者體系質量損失分別為37%和42%,循環后體系DSC曲線與未循環體系趨勢一致,但可看出KAl(SO?)?·12H?O- MgSO4·7H20-1% Na2B4O7·10H2O(Times>10)體系的主峰相比于KAl(SO?)?·12H?O- MgSO4·7H2O純體系更窄,峰值溫度更低,峰積分面積更小,表明循環后體系的整體相變焓降低,但溫度約為49?℃的小峰則不受循環的影響,表現為固-固相變一致。
參考文獻:
[1]Jeong S G, Jeon J, Cha J, et al. Preparation and evaluation of thermal enhanced silica fume by incorporating organic PCM, for application to concrete[J].Energy & Buildings, 2013, 62(62):190-195.
[2]Younsi Z,Zalewski L,Lassue S,et a1.A novel technique for experimental thermo physical characterization of phase—change materials[J].In£JThermophys,2011,32(3):674-692.
[3]Aksoy, ?. G?khan, Canbazo?lu, Suat, Akarsu F , et al. Enhancement of solar thermal energy storage performance using sodium thiosulfate pentahydrate of a conventional solar water-heating system[J]. Energy & Buildings, 2005, 37(3):235-242.
[4]ZHOU G, ZHANG Y, ZHANG Q, et al.Performance of a hybrid heating system with thermal storage using shape-stabilized phase-change material plates[J].Applied Energy,2007, 84(10):1068–1077.
[5]Domanski R , El-Sebaii A A , Jaworski M . Cooking during off-sunshine hours using PCMs as storage media[J]. Energy, 1995, 20(7):607-616.
[6]張仁元. 相變材料與相變儲能技術[J]. 科學通報, 2009(4):468-468.
[7]LANE G. A. Phase change materials for energy storage nucleation to prevent supercooling[J]. Solar Energy Materials & Solar Cells, 1992, 27(2):135–160.
[8]王智平, 田禾青, 王克振,等. 鉀明礬基低共熔相變儲熱材料的制備與研究[J]. 人工晶體學報, 2013, 42(3):491-496.
[9]鐘世民. 應用于暖通空調系統的低溫相變儲能材料的研制[D].哈爾濱工業大學,2010.
[10]令閏強. 太陽能跨季節儲熱單元及相變材料KAl(SO4)2·12H2O的研究[D]. 蘭州理工大學, 2012.
[11]Ren Y , Xu C , Yuan M , et al. Ca(NO 3 ) 2 -NaNO 3 /expanded graphite composite as a novel shape-stable phase change material for mid- to high-temperature thermal energy storage[J]. Energy Conversion and Management, 2018, 163:50-58
[12]Zhang Z, Ni Z, Jing P, et al. Preparation and thermal energy storage properties of paraffin/expanded graphite composite phase change material[J]. Applied Energy, 2012, 91(1):426-431.
[13]杜雪敏, 王士強, 景妍, 等. Na2B4O7-Mg2B6O11-H2O體系298.15K時固液相平衡研究[J]. 天津科技大學學報, 2017, 32(4):36-40.
[14]Xiao J , Huang J , Zhu P , et al. Preparation, characterization and thermal properties of binary nitrate salts/expanded graphite as composite phase change material[J]. Thermochimica Acta, 2014, 587:52-58.
[15]Huang Z , Gao X , Xu T , et al. Thermal property measurement and heat storage analysis of LiNO3/KCl expanded graphite composite phase change material[J]. Applied Energy, 2014, 115(4):265-271.

