淺表層水稻土N2O消耗能力及其與N2O還原微生物的耦合關系
王 玲,李 昆,宋雅琦,公 勤,李兆華,*
1 湖北大學資源環境學院,武漢 430062 2 湖北省農村安全飲用水工程技術研究中心,武漢 430062
土壤是大氣氧化亞氮(N2O)排放的重要來源之一,由土壤微生物介導的硝化、反硝化作用是產生N2O的主要過程[1,2]。然而常規靜態箱法監測到的N2O排放量僅是土壤中N2O產生與消耗過程綜合作用后的動態結果[3]。由于土壤水、土壤孔隙等非生物因素的截留作用以及土壤微生物的還原作用,土壤剖面中產生的N2O量并不能完全遷移出土壤表面而貢獻排放[4,5]。近年來水稻土研究結果顯示,無論是淹水狀態還是落干過程,N2O排放可能主要來源于距離土表更近的0—5 cm深度的水稻土層[6- 8]。但同時Wang等研究發現0—5 cm深度土層產生的N2O氣體并不能完全排放,高達90%的N2O產生量以不同途徑消耗損失了[9],因此0—5 cm深度土壤N2O消耗能力值得關注。此外,越來越多的研究監測到土壤N2O負排放量,在溫帶和熱帶區域的自然和耕作生態系統中,N2O凈消納率在<-1.0 μg N m-2h-1至-207 μg N m-2h-1范圍波動[10,11]。全球每年通過土壤作用消耗的N2O總量不可忽視,土壤消耗N2O已經成為很重要的一種降低大氣N2O濃度的途徑,值得深入探究。
水稻土是一種長期處于淹水缺氧狀態中的人工水成土,土壤環境極有利于其反硝化脫氮和N2O充分還原[12,13]。但目前關于水稻土壤消耗N2O過程及其微生物調控機制的系統研究較為缺乏。為揭示0—5 cm深度水稻土層N2O消納量與N2O還原微生物之間的耦合關系,本研究擬通過微宇宙培養方法對淺表層(0—5 cm)原狀水稻土外源添加N2O氣體,測定N2O遷移通過土柱的動態過程以及無機養分和氧化亞氮還原酶基因(nosZⅠ和nosZⅡ)豐度變化。研究結果將為水稻田溫室氣體減排提供重要的科學參考。
1 材料與方法
1.1 土樣采集與預處理
土樣采集自湖南益陽水稻豐產節水節肥試驗田(29°08′N, 112°27′E),為多年種植雙季稻土壤,土壤類型為河流沖積物母質發育的潮土(土壤質密,可有效防止氣體從土壤裂縫泄漏)。采集時間為2016年4月(翻耕前2周),此時田間土壤處于休耕漬水狀態。采用隨機多點采樣法,盡量避免殘留主根區域,用自制PVC管(d=17 cm,h=8 cm)采集多個深度為0—5 cm的原狀水稻土柱。標注方向后用保鮮膜包裹緊實,帶回實驗室做后續處理。同時在田間分別多點隨機采集0—5 cm土樣,混勻后帶回實驗室測定基礎理化性質,結果見表1。

表1 供試土樣基礎理化性質
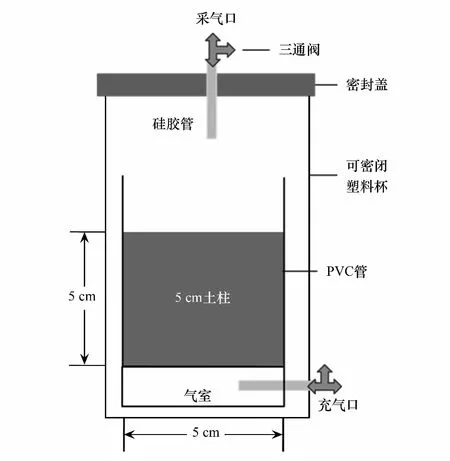
圖1 培養裝置模型圖Fig.1 Schematic diagram of incubation device
用小PVC管(d=5 cm,h=7 cm)在取回的原狀土柱上以環刀法采集小土柱(d=5 cm,h=5 cm),每大土柱可取2個小土柱。然后在底部安裝相同尺寸PVC管(d=5 cm,h=3 cm)制的通氣底座并密封邊緣。通氣底座上端用均勻打孔的PVC板覆蓋后,在PVC板下再覆蓋一層透氣不透水的硅膠片并密封邊緣,通氣底座下端直接用PVC板覆蓋并密封邊緣。確保每個邊緣密封完好后將整套裝置置于培養用塑料杯(d=9 cm,h=13 cm)中,用三通閥連接通氣底座與塑料杯外壁,用于外源氣體的添加。培養裝置如圖1所示。
從原狀土柱表面緩慢加入雙水使土表水層約1 cm左右,放置在25±1 ℃溫室預培養10 d后待用,預培養期間注意補充水分使水層厚度保持不變。預培養結束后將安裝了三通閥的塑料杯蓋蓋起并完全密封,用浸水法確定整體密封效果。之后用注射器連接塑料杯三通閥置換裝置內氣體為高純He氣,反復置換5次后保證內外氣壓平衡。
2.2 試驗處理
每土層均設置3個N2O含量添加處理,分別為1 mL(N1)、5 mL(N5)、10 mL(N10) 99.99%純度N2O/盆(相當于880、4404、8808 μg N2O-N/盆),每處理3個重復。為降低土壤異質性對后續分析的影響,每處理0h和172h土樣樣品分別為同一大土柱取出的2個小土柱。塑料杯內氣體置換完成后,用注射器連接通氣底座三通閥,分別抽出1、5、10 mL氣體后通入設定量的N2O氣體,隨后將整套裝置置于無氧培養裝置中(真空壓縮袋制,抽真空后通入高純He氣),開始培養計時,培養時間共計172 h。
2.3 樣品采集
氣體樣品采集:用注射器分別在密閉培養的0、33、82、125、172 h采集通氣底座內氣體,并在0、5、 10、 21、 28、 33、44、57、69、82、94、107、125、144、172 h采集塑料杯內氣體樣品1 mL于12 mL真空血清瓶中,充入29 mL高純He使氣瓶內氣體維持高壓,用于N2O含量的測定。每次采集氣體樣品前用注射器反復抽打空間內氣體15—20次使空間氣體混勻,氣體樣品采集后立即補入等量高純He保證裝置內各空間氣壓平衡。
2.4 氧化亞氮濃度,無機氮和DOC測定
N2O濃度采用溫室氣體氣相色譜儀(GC 7890A)測定。以高純N2作為色譜柱載氣,氣流速度28 psi,檢測器溫度為300 ℃,柱箱溫度為50 ℃,檢測器為微池電子捕獲器63Ni-ECD。
無機氮及DOC含量測定采用硫酸鉀共提法浸提。稱取約10 g土樣,置于 100 mL 塑料振蕩瓶中,加入 50 mL 0.5 mol L-1K2SO4溶液浸提,在振蕩機上振蕩 1 h后用濾紙過濾懸濁液,澄清濾液分別采用連續流動分析儀 (Flastar 5000 Analyzer) 和C/N分析儀測定硝態氮、銨態氮含量和DOC含量。
2.5 氧化亞氮還原酶基因豐度測定
土壤樣品的DNA提取方法主要參考Chen等[14]的方法。提取的DNA由Nanodrop ND- 1000UV-Vis分光光度計測定DNA濃度和質量系數,并通過1% 凝膠電泳檢測DNA完整度,滿足條件后用于qPCR分析。
氧化亞氮還原酶基因PCR分析用引物分別為nosZI- 1126F(5′-GGG CTB GGG CCR TTG CA- 3′)和nosZI- 1381R(5′- GAA GCG RTC CTT SGA RAA CTT G - 3′),以及nosZII-F(5′-CTI GGI CCI YTK CAY AC- 3′)和nosZII-R(5′- GCI GAR CAR AAI TCB GTR C - 3′)。實時 PCR 擴增所用的儀器為 ABI PRISM 7900 (Applied Biosystems),實現熒光檢測和樣品濃度測定。標準曲線用含nosZI和nosZII基因的質粒為模板,以10倍梯度稀釋法配制nosZ基因PCR擴增反應體系為(10 μL):上下游引物各0.2 μL,SYBRGreen(TaKaRa)5 μL,Rox 0.2 μL,DNA模板5 ng(1 μL),補水至10 μL。nosZI基因qPCR程序為:95 ℃ 30 s預變性;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 10 s,40個循環;95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s校正溶解曲線。nosZII基因qPCR程序為:95 ℃ 30 s預變性;95 ℃ 15s,54 ℃ 30s,72 ℃ 30 s,45個循環;95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s校正溶解曲線。所有樣品重復3次并設置陰性對照,溶解曲線分析和瓊脂糖凝膠電泳鑒定產物的特異性。
2.6 數據分析處理
數據的統計分析均采用SPSS 13.0 軟件進行分析。N2O濃度、無機養分濃度以及功能基因豐度處理間的差異性分析采用單向方差分析(One Way ANOVE,LSD 檢驗)。N2O濃度與消耗速率的關系采用線性回歸分析擬合。圖形制作采用Orgin Pro 9.0和Excel 2010軟件完成。
3 結果與分析
3.1 淹水水稻土柱N2O消納動態
由于N1、N5、N10處理實際N2O充入量分別為705.48、10645.77、20200.19 μg N2O-N,與預設處理濃度稍有誤差,后續以實測量為基礎進行計算和分析。
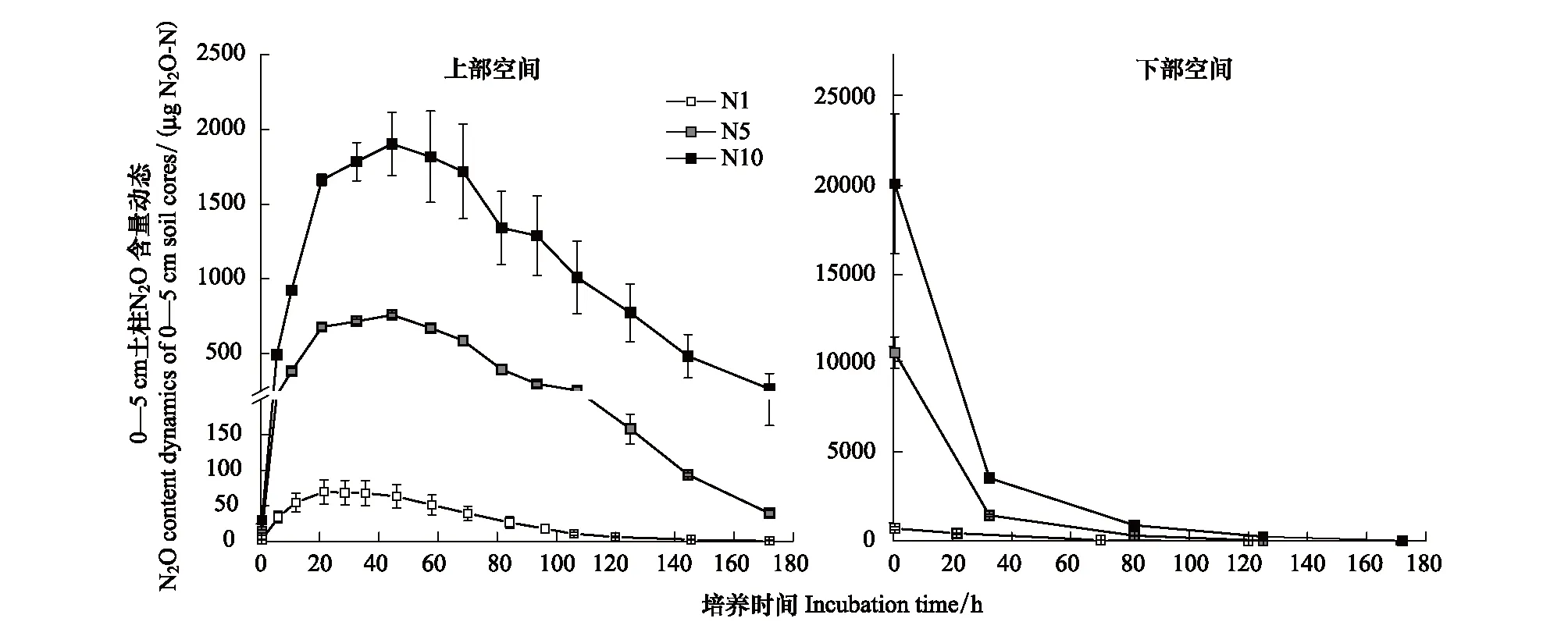
圖2 淺表層水稻土柱上部N2O釋放動態與土柱底部N2O消減動態Fig.2 Dynamics of inputting N2O content in the headspace and bottom space of 0—5 cm soil layer during flooding incubation
圖2顯示,土柱底部添加的外源N2O氣體量均隨培養時間延長而呈指數形式迅速降低。在培養172 h后,所有處理中的底部N2O含量值均接近于0,表明外源添加的N2O氣體已全部擴散、遷移進了原狀土柱。三個N2O濃度處理上部空間N2O量隨時間的變化趨勢基本一致,均呈現先增后降的動態變化,但高峰時間略有差別。N5、N10處理的土柱上部空間N2O氣體量在培養第45 h左右達到最高峰,分別占氣體添加總量的7.17%、9.76%,N1處理在培養第22小時即達到峰值,N2O量占氣體添加總量的9.80%,說明5 cm淺表層水稻土在淹水狀態下對N2O氣體的截留率極高。隨后上部空間逸出的N2O量持續降低,進一步說明土體對上層空間N2O有吸收作用,隨著時間延長外源N2O幾乎可被全部吸收。
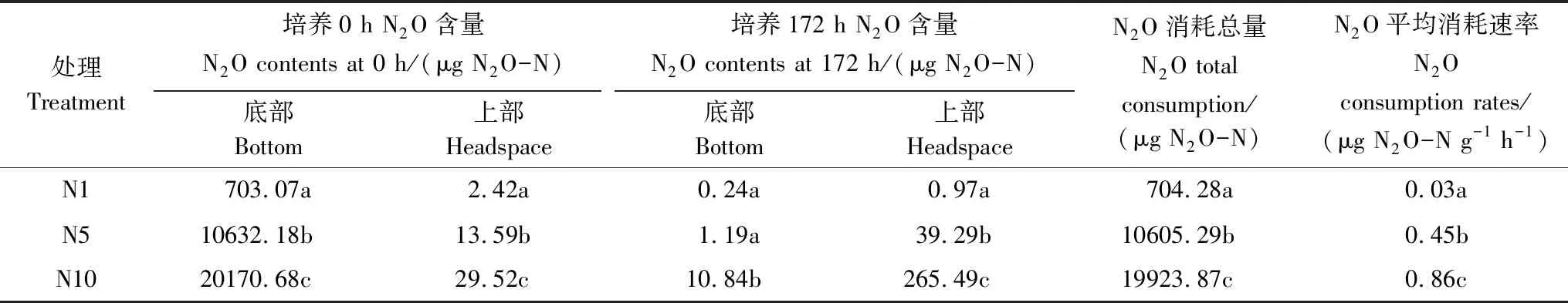
表2 不同處理水稻土柱淹水培養期N2O消耗量差異
不同小寫字母代表N2O添加處理間差異顯著(P<0.05)
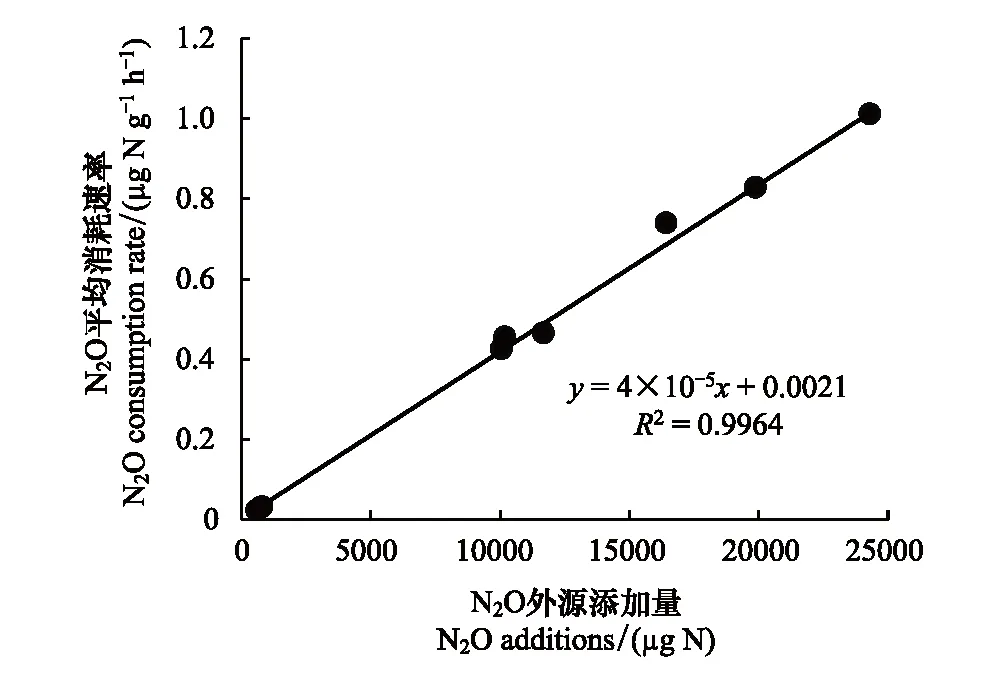
圖3 淺表層水稻土柱N2O平均消耗速率與底部添加N2O量的線性關系Fig.3 Linear relationship of N2O average consumption rate and N2O addition of surface paddy soil layer
培養期內N2O消耗總量通過培養起始點(0 h)與結束點(172 h)裝置內N2O量(上、下空間之和)的差值表示(表2)。結果顯示盡管N1、N5、N10處理N2O氣體添加量在培養起始點存在顯著差異(P<0.05),但經過172 h密閉淹水培養,三處理N2O消耗總量占初始N2O添加總量的97.11%—99.55%,說明淺表層土壤對N2O的消耗能力很強,且無論外源加入N2O量多少,均能夠被土壤基本消耗完全。而N1、N5、N10處理N2O平均消耗速率存在顯著差異(P<0.05)。N2O平均消耗速率隨N2O外源添加量的增加而增加,通過線性擬合分析發現(圖3),N2O平均消耗速率(Y)與外源N2O添加量(X)成顯著線性關系(P<0.01),表明淺表層水稻土柱N2O消耗能力會受到外源N2O添加量的刺激而顯著增強。
3.2 土壤含量變化
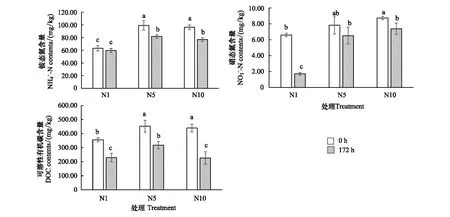
圖4 淺表層水稻土含量,含量和DOC含量在培養期內的變化動態Fig.4 Dynamics of concentration, and DOC concentration at 0h and 172 h of surface paddy soil layer不同小寫字母代表處理間差異顯著(P<0.05)
可溶性有機碳結果(圖4)顯示表層水稻土柱中DOC含量在培養起始點均高于350 mg/kg,表明可利用的碳含量較為豐富。經過淹水厭氧培養172 h后,各處理土壤DOC含量均被顯著消耗,N1、N5、N10處理DOC消耗量分別為126.38、134.50、212.33 mg/kg,消耗比例分別為35.60%、29.68%、48.61%。高濃度的N2O添加處理(N10)消耗了最多的DOC,由于DOC是供給微生物活動的直接C源,側面反映高濃度N2O添加刺激了較多的微生物響應。
3.3 氧化亞氮還原酶基因豐度變化
土壤細菌氧化亞氮還原酶基因豐度結果(圖5)顯示,培養起始點三處理土壤nosZI基因拷貝數量平均為1.20×109copies/g干土,而nosZII基因豐度則為nosZI基因豐度的2倍以上。此外,nosZI和nosZII基因拷貝數在淹水厭氧培養172 h后變化趨勢明顯不同。不同濃度外源N2O添加均引起了nosZI基因豐度的顯著增加,N1、N5、N10處理nosZI基因拷貝數分別增加了4.46×108、5.91×108、9.91×108。nosZI基因拷貝數增幅基本上隨N2O添加量增加而增加,表明外源N2O的添加刺激了含nosZI基因微生物數量的增長。而nosZII基因數量對不同N2O添加濃度的響應存在差異,N1處理低濃度N2O添加促進了nosZII基因拷貝數的增長(增長幅度約為32.35%),N5、N10處理nosZII基因豐度無顯著變化,表明添加的高濃度N2O對含nosZII基因的微生物生長無明顯激發作用。
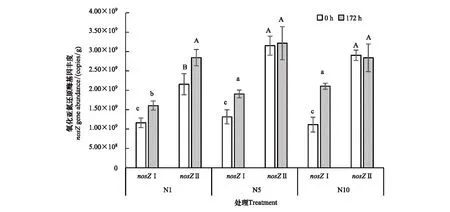
圖5 淺表層水稻土細菌nosZ基因豐度在培養期內的變化動態Fig.5 Dynamics of nosZ gene abundance at at 0 h and 172 h of surface paddy soil layer不同小寫字母代表nosZI處理間差異顯著(P<0.05), 不同大寫字母代表nosZII處理間差異顯著(P<0.05)
3.4 淺表層水稻土N2O氧化亞氮消耗速率與相關土壤因子關系
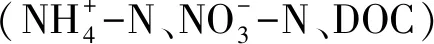
表3 淺表層水稻土N2O消耗速率與N2O添加量及相關土壤因子相關系數
Table 3 Pearson′s correlation coefficients for relationships between N2O consumption rates and N2O addition, relative soil variables of surface paddy soil layer
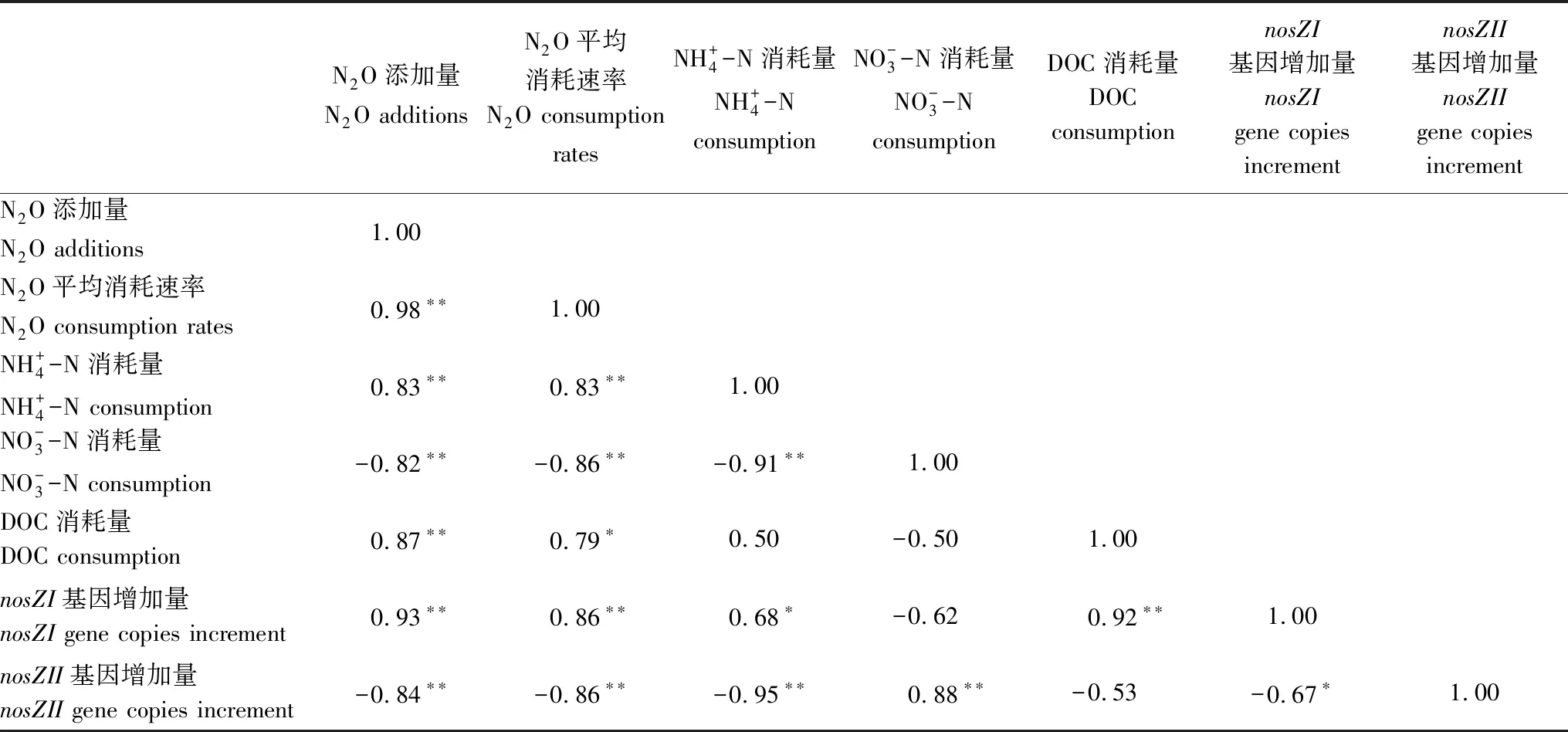
N2O添加量N2O additionsN2O平均消耗速率N2O consumption ratesNH+4-N消耗量NH+4-N consumptionNO-3-N消耗量NO-3-N consumptionDOC消耗量DOC consumptionnosZI基因增加量nosZI gene copies incrementnosZII基因增加量nosZII gene copies incrementN2O添加量N2O additions1.00N2O平均消耗速率N2O consumption rates0.98??1.00NH+4-N消耗量NH+4-N consumption0.83??0.83??1.00NO-3-N消耗量NO-3-N consumption-0.82??-0.86??-0.91??1.00DOC消耗量DOC consumption0.87??0.79?0.50-0.501.00nosZI基因增加量nosZI gene copies increment0.93??0.86??0.68?-0.620.92??1.00nosZII基因增加量nosZII gene copies increment-0.84??-0.86??-0.95??0.88??-0.53-0.67?1.00
** 相關性在0.01水平上顯著; * 相關性在0.05水平上顯著
4 討論
農業土壤是大氣N2O排放的重要來源之一,土壤中的N2O主要是通過一系列土壤微生物作用驅動產生的。而后N2O氣體在土壤剖面內遷移擴散,部分被土壤反硝化微生物利用進一步轉化為分子氮(N2),部分被截留在土壤水、土壤孔隙中,剩余部分才能以N2O形式排出土壤表面[3]。土壤體截留、消耗一部分N2O后,土表N2O排放量并不總是與土壤剖面中累積的N2O產生量直接相關。Gao等通過野外監測發現頻繁淹水的河岸帶土壤剖面中N2O含量升高的同時,土表N2O排放量并未顯著變化,推測可能是在持續厭氧的淹水環境下土壤中累積的N2O在遷移至土表前已被大量消耗[5]。本研究采用從0—5 cm土柱底部外源添加N2O氣體的方法,模擬了累積在5 cm土壤深度的N2O氣體遷移通過土柱后的排放動態。結果顯示底部外源添加的三個濃度的N2O氣體量均迅速降低,遷移擴散進了水稻土柱,但通過土柱后排放出的N2O量最高值也僅占添加總量的7.17%—9.80%,暗示0—5 cm表層水稻土在淹水厭氧狀態下可截留、消耗5 cm深度N2O積累量的90%以上。Wang等通過對0—20 cm原狀水稻土柱剖面N2O含量和土表N2O排放量動態耦合關系研究發現,0—5 cm土層產生的N2O大量損失,每天的N2O排放量僅占總損失量的10%左右,約90%的N2O以其他途徑消耗損失[9]。這部分N2O損失途徑可能是被還原轉化為N2、溶解于土壤水中或是停留在土壤孔隙中[15],因此持續淹水條件下稻田土壤N2O排放量很低,甚至會出現N2O負排放的現象[16,17]。


5 結論