地衣芽孢桿菌L-天冬酰胺酶I型 的克隆表達及其在降低薯條中丙烯酰胺的應用
陳菊花,焦琳舒,謝亞娟,陸兆新,張 充,呂鳳霞*
(南京農業大學食品科技學院,江蘇 南京 210095)
L-天冬酰胺酶(EC.3.5.1.1)可將L-天冬酰胺側鏈的酰胺基水解成天冬氨酸和氨,是一種氨基水解酶類。L-天冬酰胺酶可用于臨床治療急性淋巴細胞白血病,霍奇金淋巴瘤和淋巴系統惡性腫瘤等多種疾病[1-2],受到了國內外的高度關注。此外,L-天冬酰胺酶可有效降低熱加工食品中潛在致癌物丙烯酰胺質量濃度,在食品加工領域中也顯示出巨大的應用價值。丙烯酰胺具有潛在的神經毒性、遺傳毒性以及致癌性,高淀粉類食品經高溫油炸、烘焙或燒烤后都會產生丙烯酰胺[3-4]。L-天冬酰胺是丙烯酰胺形成的重要的前體物質,L-天冬酰胺和還原糖在高于120 ℃的溫度下發生美拉德反應生成丙烯酰胺[5-6]。而經L-天冬酰胺酶處理后,食品原材料中的游離L-天冬酰胺被水解,可從源頭上抑制食品中丙烯酰胺的產生。目前,僅有丹麥諾維信公司生產的來源于米曲霉的Acrylaway?和荷蘭帝斯曼公司生產的黑曲霉來源的Prevent ASeTM商品酶,實現了在食品加工中的應用[7]。而國內在該領域的研究還相對薄弱,尚未有自主創新的商品化L-天冬酰胺酶制劑。因此,根據工業酶的需求出發,開發產量高、穩定性好、催化效率高的新型L-天冬酰胺酶制劑,從源頭上控制熱加工食品中丙烯酰胺形成具有十分重要的意義。
L-天冬酰胺酶來源廣泛,從微生物(細菌、霉菌、酵母、放線菌和藻類),到高等生物(植物、脊椎動物和動物組織)均發現有L-天冬酰胺酶的存在[8],如豚鼠[9]、睡茄[10]、微藻[11]、歐文氏菌[12]、釀酒酵母[13]等。根據其序列及結構同源性的差異,L-天冬酰胺酶可被分為兩種不同的類型:I型和II型。I型酶存在于細胞質中,通常具有較低的底物親和力,無抗腫瘤活性,僅應用于食品加工領域;II型酶存在于細胞周質中[14],底物親和力普遍較高,可應用于食品加工與醫藥領域[15-16]。近年來,L-天冬酰胺酶的應用研究多集中于II型酶,枯草芽孢桿菌[17]、巨大芽孢桿菌[18]、巴倫氏類芽孢桿菌[19]等多種不同來源的L-天冬酰胺酶II型皆被證實了具有抑制高熱加工食品中丙烯酰胺生成的能力,而有關I型酶的應用研究相對較少,有關于地衣芽孢桿菌L-天冬酰胺酶I型的應用研究鮮見報道。
本實驗室在前期研究中篩選到一株具有L-天冬酰胺酶活力的地衣芽孢桿菌(Bacillus licheniformis Z-1,菌種保藏號:CGMCC NO:17310)。為了提高地衣芽孢桿菌L-天冬酰胺酶的表達量,降低其純化難度,將地衣芽孢桿菌L-天冬酰胺酶I型酶基因克隆,并實現了其在大腸桿菌BL21(DE3)中的表達,進行了重組酶的酶學性質研究。同時,探究了其在油炸土豆中的丙烯酰胺降解能力,為I型酶在食品中的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
L-天冬酰胺酶產生菌株B. licheniformis Z-1、克隆宿主Escherichia coli DH5α和表達L21(DE3)均由南京農業大學酶工程實驗室保藏。
LB培養基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L。
限制性內切酶Nde I與Xho I、Taq DNA聚合酶、T4 DNA連接酶、pMD19-T連接試劑盒 大連寶生物(TaKaRa)公司;pET-30a(+)表達載體 德國Novagen公司;柱式質粒提取試劑盒、DNA凝膠回收試劑盒、DNA Marker 南京諾唯贊生物科技有限公司;氨芐青霉素、卡那霉素、異丙基-β-D-硫代半乳糖苷(isopropylβ-D-thiogalactopyranoside,IPTG)、瓊脂糖、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)(分子級)、Tris生工生物工程(上海)股份有限公司;基因組Bacterial DNA kit試劑盒 美國Omega Bio-Tek公司;其他試劑均為國產分析純。
1.2 儀器與設備
PTC-100TM聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國MJ Research公司;JS-380C全自動數碼凝膠成像儀 上海培清科技有限公司;58410R冷凍高速離心機 德國Eppendorf公司;JY92-2D超聲波破碎儀、SB5200DT超聲波清洗機 寧波新芝科學儀器研究所;UV-2450紫外分光光度計 日本島津公司;Pow PacTM高電流電泳儀 美國Bio-Rad有限公司;Heidolph旋轉蒸發儀、6410Triple Quad LC/MS質譜儀美國Agilent公司。
1.3 方法
1.3.1 基因克隆和序列分析
參照GenBank中公布的B. licheniformis的全基因組序列(CP005965.1),利用primer premier 5.0軟件設計編碼天冬酰胺酶ansA基因的引物序列,即含有Nde I酶切位點(下劃線)上游引物BlAase I-F:5’-CCGCATATGATGA AAAAGAAAGTAGCTCTTATTACAACA-3’,含有Xho I酶切位點(下劃線)下游引物BlAase I-R:5’-CCGCTCG AGGTAGCAGAATTTGTCTTTTATGCCTT-3’。用Omega Bio-Tek公司基因組DNA提取試劑盒抽提B. licheniformis Z-1的基因組DNA,以其為模板擴增ansA片段。將PCR產物膠回收后與pMD19-T載體連接,連接產物轉入克隆宿主E. coli DH5α。對菌液PCR驗證正確的轉化子進行搖瓶增菌和抽提質粒,隨后送往生工生物工程(上海)股份有限公司測序。
1.3.2 重組菌株E. coli BL21(DE3)/pET-30a(+)-BlAase I的構建和表達
用Nde I和Xho I限制性內切酶對上述重組質粒PMD19-T-BlAase I和表達載體pET-30a(+)分別進行雙酶切。酶切產物經1%瓊脂糖凝膠電泳驗證后,使用膠回收試劑盒進行回收。通過T4 DNA連接酶將目的基因ansA片段與pET-30a(+)載體片段進行連接,轉化克隆宿主E. coli DH5α。將PCR驗證結果正確的陽性轉化子進行質粒提取,得到重組表達質粒pET-30a(+)-BlAase I。重組質粒pET-30a(+)-BlAase I和空載質粒pET-30a(+)分別轉入表達宿主E. coli BL21(DE3)。挑取單克隆接種至30 mL LB(50 μg/mL卡那霉素)液體培養基中,并在37 ℃、180 r/min培養12 h,以此為種子液。以1%的接種量轉接到新鮮的100 mL LB(50 μg/mL卡那霉素)液體培養基中,于37 ℃、180 r/min培養約至OD600nm為0.6~0.8時,立即加入IPTG至終質量濃度100 μg/mL,180 r/min、16 ℃條件下誘導16 h。以重組菌E. coli BL21(DE3)/pET-30a(+)作為對照。
1.3.3 重組酶的分離純化
4 ℃、8 000×g離心5 min收集菌體,將菌體充分重懸于50 mmol/L磷酸鹽緩沖液(pH 8.0)中,之后采用超聲波破碎儀處理重懸液(破碎參數40 W,工作1 s、停2 s,共超聲15 min)。破碎液于4 ℃、12 000×g離心30 min,所得上清液即為L-天冬酰胺酶粗酶液。因目標蛋白N端融合了His組氨酸標簽,故可通過鎳柱親和層析對重組L-天冬酰胺酶進行純化。對粗酶和純化后的重組L-天冬酰胺酶進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,采用Bradford法[20]測定蛋白濃度。
1.3.4 酶活性測定
通過參考N e s s l e r試劑法[21]測定酶活性。將189 mmol/L L-天冬酰胺底物溶液100 μL和粗酶液100 μL加入700 μL Tris-HCl緩沖液(pH 8.0)中,混勻后于37 ℃水浴反應20 min,加100 μL 25%三氯乙酸(trichloroacetic acid,TCA)溶液終止反應。混合物12 000 r/min離心1 min。取40 μL上清液和100 μL Nessler加入860 μL超純水中,顯色10 min,測定436 nm波長處吸光度。空白對照組則先加入TCA終止反應,然后進行水浴處理。酶活性單位定義:在pH 8.0和37 ℃的反應條件下,每分鐘水解L-天冬酰胺生成1 μmol氨所需要的酶量被定義為1 個酶活力單位。
1.3.5 重組酶酶學性質研究
1.3.5.1 重組酶的最適反應pH值和pH值穩定性
將酶溶液分別置于pH 6.0~11.0緩沖液中,于37 ℃測定酶活性以確定最佳反應pH值。將酶溶液在4 ℃的pH 6.0~11.0的緩沖液中儲存12 h,以處理0 h酶活性為100%,測定相對酶活力,研究重組酶的pH值穩定性。
1.3.5.2 重組酶的最適反應溫度和溫度穩定性
將酶液置于25~60 ℃范圍內進行酶促反應,測定酶活性確定最適反應溫度。將酶液分別置于4、40、45、50、60 ℃孵育12 h,間隔1 h取樣,以處理0 min酶活性作為100%,于最適pH值和最適溫度條件下測定相對酶活力,研究重組酶的溫度穩定性。
1.3.5.3 金屬離子對重組酶活性的影響
在酶活性測定體系中添加終濃度為1 mmol/L的不同金屬離子(K+、Na+、Zn2+、Ca2+、Mg2+、Mn2+、Fe2+、Cu2+、Fe3+),以無添加金屬離子所測酶活性為100%,測定相對酶活力。
1.3.5.4 重組酶的酶促動力學性質
以200 mmol/L的L-天冬酰胺、D-天冬酰胺、L-谷氨酰胺、L-天冬氨酸、D-天冬氨酸、L-谷氨酸分別作為底物進行酶促反應,研究純化的重組L-天冬酰胺酶的底物專一性。以6~18 mmol/L L-天冬酰胺為底物,在最適反應條件下測量酶活性。酶活性測定方法與L-天冬酰胺酶活性測定方法一致。采用Lineweaver-Burk法作圖,得到米氏常數Km和最大反應速率Vmax。
1.3.6 重組酶在薯條中的應用
1.3.6.1 薯條制作工藝流程
參考Franco等[22]方法。將土豆洗凈并去皮,切成長條形(5 mm×5 mm×70 mm),在自來水下漂洗1 min去除表面的淀粉。將樣品分離成4 份,預處理如下:1)浸泡在超純水中,40 ℃放置30 min;2)浸泡于5 IU/mL重組L-天冬酰胺酶溶液中,40 ℃放置30 min;3)浸泡于20 IU/mL重組L-天冬酰胺酶溶液中,40 ℃放置30 min;4)浸泡于30 IU/mL重組L-天冬酰胺酶溶液中,40 ℃放置30 min。將浸泡后的土豆條瀝干后置于鼓風干燥箱內,60 ℃干燥10 min。將每個處理組的土豆條分別于175 ℃預炸1 min后置于-20 ℃冷凍48 h,175 ℃油炸5 min后瀝油冷卻干燥。
1.3.6.2 土豆中游離L-天冬酰胺和L-天冬氨酸的提取及檢測
參考趙巖等[23]方法,略作修改。將油炸前干燥后的土豆條粉碎,稱取5 g,加入質量分數50%的乙醇溶液50 mL,超聲30 min,抽濾,將濾液于50 ℃旋轉蒸干有機溶劑,用0.1 mol/L HCl溶液定容至5 mL,過0.45 μm濾膜,上樣檢測。
對土豆中游離的L-天冬酰胺和L-天冬氨酸進行高效液相色譜-質譜聯用法檢測,色譜柱C18(100 mm×2.1 mm,1.8 μm)。檢測參數:流動相甲醇-0.05 mol/L乙酸銨(2∶98,V/V),等度洗脫;流速0.3 mL/min;柱溫35 ℃;波長210 nm;進樣量10 μL;電噴霧電離源正離子模式;L-天冬酰胺檢測離子m/z 74.2、87.1;L-天冬氨酸檢測離子m/z 88.1、116.1。
1.3.6.3 薯條中丙烯酰胺的提取及檢測
參考程江華等[24]提供的方法,略作修改。10 g均質后的薯條(粉碎、烘干),加入40 mL正己烷脫脂,重復3 次。加入50 mL去離子水、50 mL乙腈、20 g MgSO4和5 g NaCl,振蕩2 min,超聲水浴30 min,10 000×g離心10 min,取乙腈層(上層)于旋轉蒸發儀中將乙腈旋干,加1 mL超純水復溶,過0.45 μm濾膜,高效液相色譜(high performance liquid chromatography,HPLC)法檢測。
H P L C參數:A g i l e n t H C-C18色譜柱(4.6 mm×250 mm,5 μm);流動相甲醇-水(10∶90,V/V),等度洗脫;流速0.5 mL/min;柱溫31 ℃;波長210 nm;進樣量20 μL。
2 結果與分析
2.1 酶基因擴增和序列分析
以B. licheniformisZ-1基因組DNA為模板,擴增ansA基因如圖1所示,目的條帶長度在1 000 bp左右,測序結果顯示該基因序列為972 bp,編碼324 個氨基酸,證明B. licheniformisZ-1L-天冬酰胺酶ansA基因已克隆成功,命名為BlAase I型。為了分析不同微生物來源的L-天冬酰胺酶的親緣關系,將BlAase I型和目前已發表的5 種L-天冬酰胺酶I型繪制系統進化樹(圖2)。進化樹顯示BlAase I型與古菌Pyrococcus furiosus和Pyrococcus horikoshii來源的L-天冬酰胺酶I型在進化關系上更為相近。
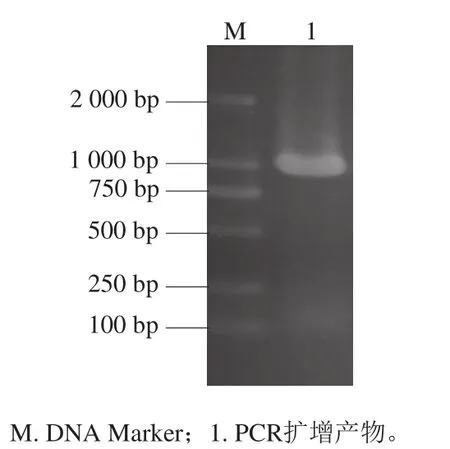
圖1 B. licheniformis Z-1中ansA基因PCR擴增產物的瓊脂糖凝膠電泳圖Fig. 1 Agarose gel electrophoresis of PCR-ampli fied ansA gene from B. licheniformisZ-1
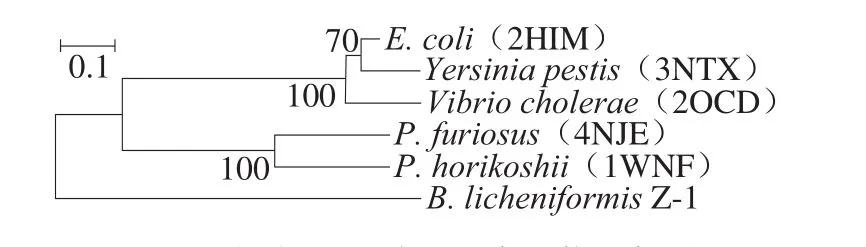
圖2 不同來源L-天冬酰胺酶I型的系統進化樹Fig. 2 Neighbor-Joining phylogenic tree of L-asparaginases type I from various bacterial sources
2.2 重組L-天冬酰胺酶的表達與純化
重組酶粗酶活為(63.64±3.18) IU/mL,通過Ni柱純化后,重組酶比活力為945.79 IU/mg,純化倍數為21.70 倍,回收率為71.4%(表1)。對重組酶進行SDSPAGE電泳驗證,結果表明,目的蛋白在35 kDa左右有單一條帶(圖3),與理論值36.6 kDa相符合。

表1 酶的分離純化步驟Table 1 Summary of enzyme purification steps
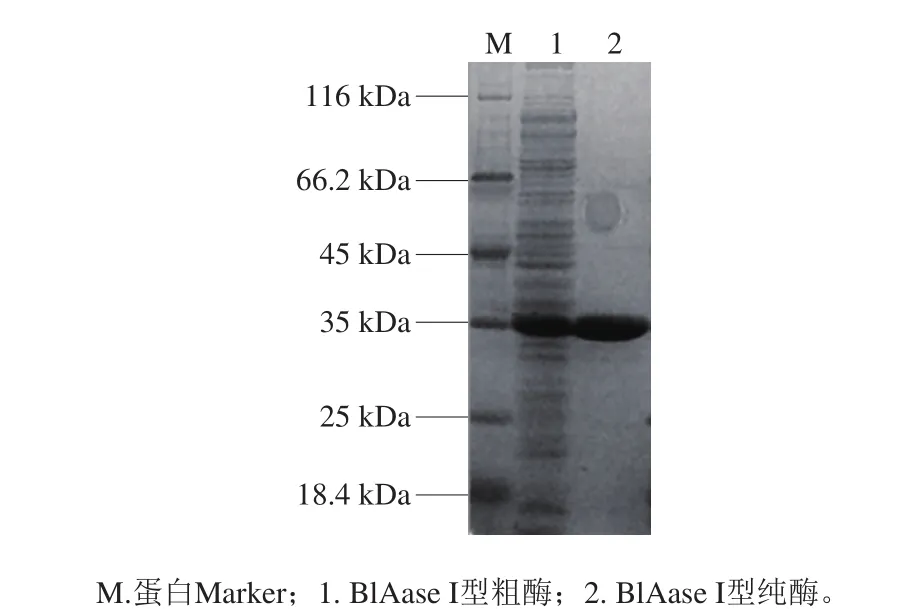
圖3 SDS-PAGE檢測Fig. 3 SDS-PAGE of crude and purified enzyme
2.3 酶學性質研究
2.3.1 重組酶的最適反應pH值和pH值穩定性
將重組酶置于37 ℃、pH 6.0~11.0的條件下進行酶活力測定。結果如圖4A所示,重組酶的最適反應pH 10.0。將重組酶在pH 6.0~11.0的緩沖液中4 ℃條件下儲存12 h后,測定重組酶相對酶活力。其pH值穩定性結果如圖4B所示,重組酶pH值穩定性較好,在pH 6.0~11.0范圍內儲存12 h仍保留60%以上的活性。此重組酶具有一個相對較寬的pH值活性范圍,在堿性的環境中都表現出良好的催化活性。
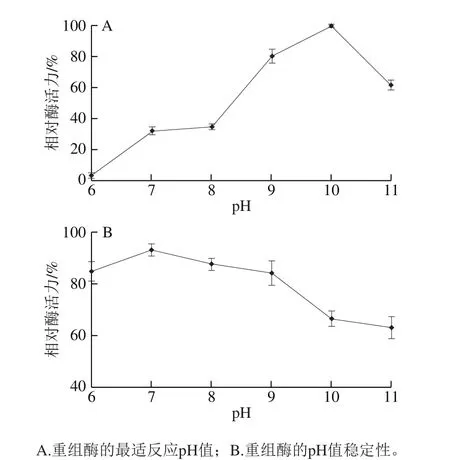
圖4 pH值對重組酶活力的影響Fig. 4 Effect of pH on the recombinant enzyme activity
2.3.2 重組酶的最適反應溫度和溫度穩定性
將重組酶置于pH 8.0,溫度范圍為25~60 ℃條件下進行酶活力測定。結果如圖5A所示,重組酶最適反應溫度為45 ℃。將重組酶置于不同溫度下,每隔一段時間取樣,在最適反應pH值及最適反應溫度下測定酶活力。結果如圖5B所示,該重組酶在低溫(4 ℃)條件下保存穩定,12 h后相對酶活力僅下降3.79%。當在較高溫度(40 ℃和45 ℃)處理12 h后,相對酶活力仍高于90%。當溫度高于45 ℃時,酶的熱穩定性顯著降低,在50 ℃存放10 h后相對酶活下降至30.62%,在60 ℃存放8 h后相對酶活力僅為3.87%。
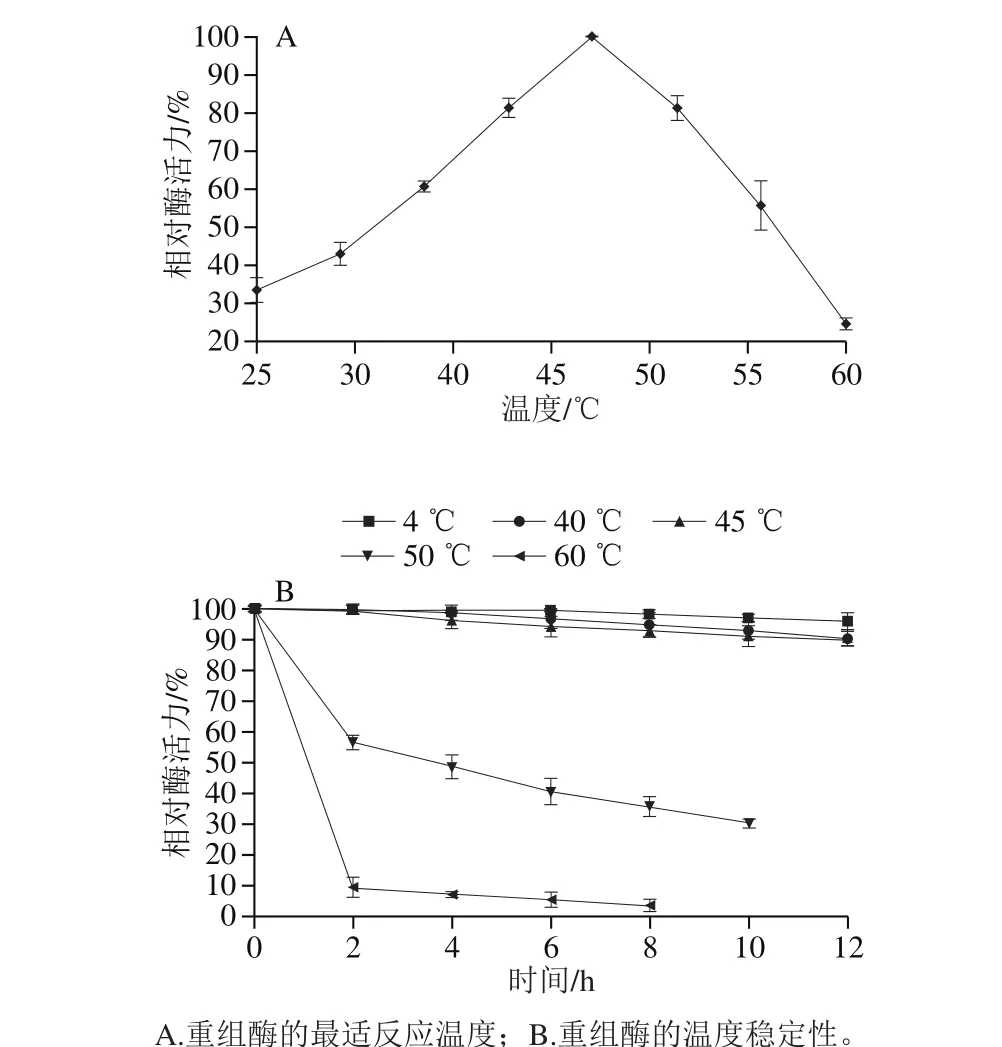
圖5 溫度對重組酶活力的影響Fig. 5 Effect of temperature on the recombinant enzyme activity
2.3.3 金屬離子對重組酶活力的影響
研究終濃度為1 mmol/L的不同金屬離子對重組酶活力的影響,結果見表2。其中,Mn2+、Mg2+和K+對重組酶具有顯著激活作用,Mn2+的作用效果最強;而Zn2+對重組L-天冬酰胺酶有抑制作用,使其相對酶活力降低至(82.95±1.23)%;其余各金屬離子對酶活力無顯著影響。
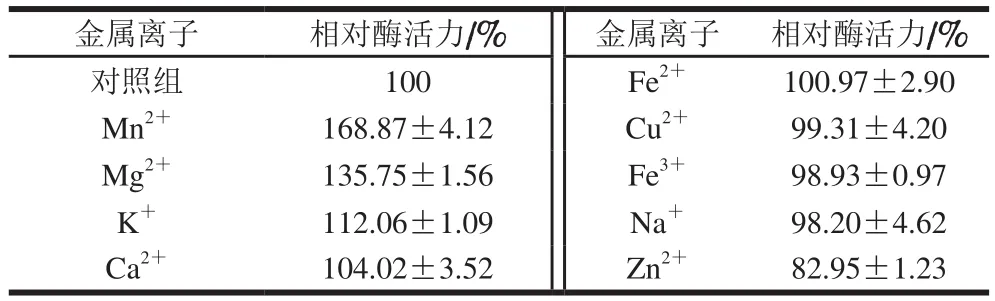
表2 金屬離子對重組酶活力的影響Table 2 Effect of metal ions on the recombinant enzyme activity
2.3.4 重組酶底物特異性與動力學研究
測定重組酶對不同底物的作用效果,結果如圖6所示。該重組酶能水解L-天冬酰胺和D-天冬酰胺,但對D-天冬酰胺的活性僅為L-天冬酰胺的23.38%,對L-谷氨酰胺等其他4 種底物均無活性。
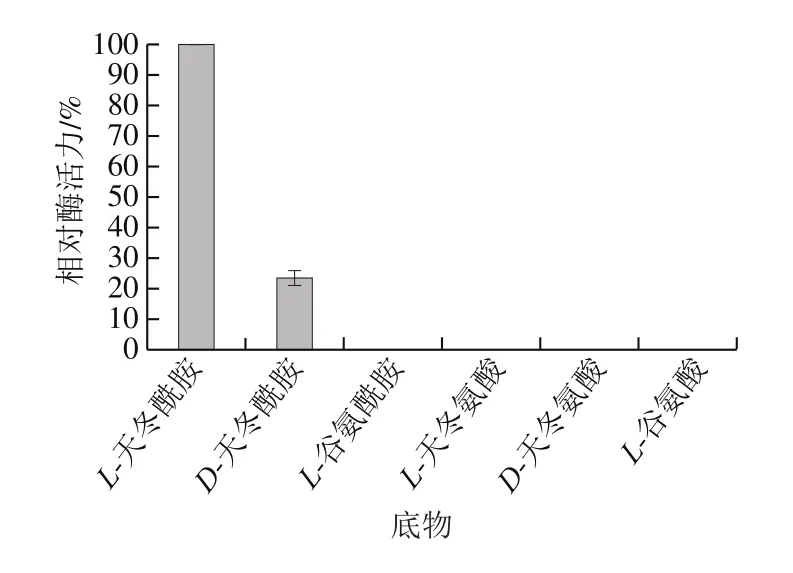
圖6 重組酶的底物特異性Fig. 6 Substrate specificity of the recombinant enzyme
使用Lineweaver-Burk雙倒數作圖,計算重組酶對底物L-天冬酰胺的Km和Vmax,結果見圖7,米氏常數Km為12.19 mmol/L,最大反應速率Vmax為2.69 IU/mL。

圖7 重組酶動力學常數Lineweaver-Burk圖Fig. 7 Lineweaver-Burk plot for determining the kinetic parameters of the recombinant enzyme
2.4 重組酶處理對薯條中丙烯酰胺含量的影響
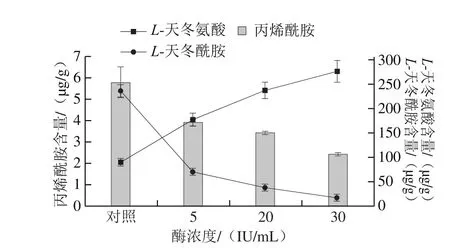
圖8 酶濃度對L-天冬酰胺、L-天冬氨酸及丙烯酰胺含量的影響Fig. 8 Effect of L-asparaginase concentration on the contents of L-asparagine, L-aspartic acid and acrylamide of French fries
比較不同酶的濃度對油炸前土豆條中的L-天冬酰胺、L-天冬氨酸含量以及油炸后薯條中丙烯酰胺質量濃度的影響,結果如圖8所示。L-天冬酰胺作為丙烯酰胺的重要前體物質,隨著酶濃度的增加,土豆條中的L-天冬酰胺轉化為L-天冬氨酸的轉化率逐漸增加,從而導致最終薯條中丙烯酰胺含量逐步降低。未經酶處理的土豆條中(對照組)丙烯酰胺含量為5.780 μg/g,將土豆條置于5 IU/mL和20 IU/mL的酶液中浸泡30 min后,丙烯酰胺含量分別降低31.96%和40.87%,置于30 IU/mL的酶液中浸泡30 min后,丙烯酰胺含量進一步降低,降幅達58.39%。隨著重組酶添加濃度的升高,薯條中丙烯酰胺含量逐漸降低。
3 討 論
本研究中將地衣芽孢桿菌L-天冬酰胺酶I型酶基因在大腸桿菌中表達,測定了重組酶酶學性質以及對油炸土豆中丙烯酰胺的抑制效果。將BlAase I型氨基酸序列與不同來源L-天冬酰胺酶I型進行同源性比對發現,BlAase I型與已知結構的其他I型酶差異較大,與之同源性最高的是激烈火球菌I型酶[25](P. furiosus,PDB ID:4NJE),同源性僅為30%;其次是大腸桿菌I型酶[26](PDB ID:2HIM),同源性為27%。
作為一種新型的L-天冬酰胺酶I型,BlAase I型具有出色的催化能力,重組酶活力可達(63.64±3.18)IU/mL,高于多種其他來源的L-天冬酰胺酶,如阿爾巴諾卡氏菌(Nocardiopsis alba,18.47 IU/mL)[27]和棲稻假單胞菌(Pseudomonas oryzihabitans,4.3 U/mL)[28]等。酶學性質研究結果表明,BlAase I型的最適反應pH值為10.0,相較于大多數L-天冬酰胺酶偏堿性[28]。在pH 6.0~9.0范圍內儲存12 h后,BlAase I型仍保留80%以上的活性。此外,大部分的L-天冬酰胺酶來源于嗜溫微生物,其最適反應溫度在30~45 ℃之間[21,29],BlAase I型的最適反應溫度為45 ℃,同樣符合這一特點。BlAase I型熱穩定性較好,在45 ℃處理12 h后相對酶活力仍大于90%。這些特性使其可耐受食品加工過程中各種苛刻的pH值及穩定環境,在食品加工領域中具有廣闊應用前景。另外,Mn2+對重組酶具有較強的激活作用,這與來源于米黑根毛霉的L-天冬酰胺酶情況相似[30]。在底物特異性方面,多數L-天冬酰胺酶通常無法催化D-天冬酰胺,對谷氨酰胺有部分活性,如熒光假單胞菌[31]和釀酒酵母[13]等來源的L-天冬酰胺酶。而BlAase I型對L-天冬酰胺的特異性強,無谷氨酰胺酶活性,具有較弱的D-天冬酰胺催化活性。
BlAase I型可有效抑制薯條中丙烯酰胺的產生,在30 IU/mL的酶液中處理0.5 h后,丙烯酰胺降解率最高可達58.39%。然而,經枯草芽孢桿菌L-天冬酰胺酶處理后,土豆中的丙烯酰胺質量濃度降解了90%~95%[32],經巨大芽孢桿菌L-天冬酰胺酶處理后,土豆中的丙烯酰胺降解率為92.4%[18],即與其他文獻報道中的L-天冬酰胺酶II型相比,BlAase I型對油炸土豆中丙烯酰胺的降解效果仍有差距。究其原因,BlAase I型的Km值較高,底物的親和力較差,在30 min內結合及水解土豆中L-天冬酰胺的效率較低。針對BlAase I型底物親和力不強的問題,基于該酶現有的生物學特性,分析可能影響底物結合的關鍵氨基酸位點,利用定點突變和迭代飽和突變技術對其進行分子改造,獲得底物親和力顯著提高的突變酶,從而提高該酶的工業應用潛力。

