傳統(tǒng)奶酪中產(chǎn)轉(zhuǎn)糖基活性β-半乳糖苷酶乳酸菌的篩選鑒定及其合成低聚半乳糖條件
王麗軍,牟元珍,關(guān) 波*,萬麗云,張 艷,胡有貞,倪永清
(石河子大學(xué)食品學(xué)院,新疆 石河子 832003)
低聚半乳糖(galacto-oligosaccharides,GOS)是一類與人乳寡糖(human milk oligosaccharides,HMOS)結(jié)構(gòu)近似,由數(shù)量不等的半乳糖單元,以葡萄糖或半乳糖單元為還原性末端,通過β-(1,4)、β-(1,6)、β-(1,3)等β-糖苷鍵構(gòu)成的異質(zhì)性低聚糖[1]。作為一類益生特性顯著的低聚糖,GOS無法被人類腸道消化吸收,能夠選擇性促進(jìn)乳桿菌(Lactobacillussp.)和雙歧桿菌(Bifidobacteriumsp.)等益生菌的生長[2],從而改善腸道對(duì)礦物質(zhì)的吸收、抑制病原菌并發(fā)揮調(diào)節(jié)機(jī)體免疫系統(tǒng)的作用[1,3-4]。GOS還具有良好的熱穩(wěn)定性和耐酸性,加工性能良好,非常適合作為多種配方食品及飲料的膳食添加劑。20世紀(jì)90年代以來,GOS作為膳食補(bǔ)充劑先后在日本和歐洲上市。到2007年,全球GOS的產(chǎn)量已達(dá)25 000 t,市值超過1.3億 美元[5]。此外,生產(chǎn)GOS的原料乳清來源豐富且成本低,同時(shí)緩解了乳清帶來的環(huán)境污染問題。因此,在目前HMOS來源有限且合成困難的背景下[6-7],以GOS為代表的低聚糖在新生兒和嬰兒配方乳品中具有良好的應(yīng)用前景,國內(nèi)外市場潛力巨大[8]。
由于GOS具有富含羥基結(jié)構(gòu)的半乳糖單元及葡萄糖單元,且單糖單元間可以由不同糖苷鍵連接,化學(xué)結(jié)構(gòu)的復(fù)雜性使得作為膳食補(bǔ)充劑的GOS難以通過化學(xué)方法合成,因此,GOS的商業(yè)化生產(chǎn)主要以乳清中的乳糖為原料,通過微生物酶法催化合成。β-半乳糖苷酶(EC 3.2.1.23),又稱乳糖酶,常用于乳糖水解,可生成半乳糖和葡萄糖,某些微生物來源的β-半乳糖苷酶在水解乳糖分子的同時(shí),還具有轉(zhuǎn)半乳糖基的活性,能夠以乳糖或葡萄糖分子作為半乳糖基受體合成GOS[1,3,9-11]。目前合成GOS的商業(yè)化β-半乳糖苷酶制劑主要來源于米曲霉(Aspergillus oryzae)、乳酸克魯維酵母(Kluyveromyces lactis)和環(huán)狀芽孢桿菌(Bacillus circulans)。目前3 種主要商業(yè)化菌株來源的β-半乳糖苷酶合成GOS的最適pH值和反應(yīng)溫度存在明顯差異,GOS得率僅在30%左右,有些β-半乳糖苷酶對(duì)乳糖的水解活性顯著強(qiáng)于轉(zhuǎn)糖基活性,且合成GOS的鍵型主要以β-(1,4)糖苷鍵為主,產(chǎn)品的益生指數(shù)偏低[5],因此,迫切需要篩選更適合GOS合成的β-半乳糖苷酶新酶源。
雙歧桿菌、乳桿菌等乳酸菌具有一般公認(rèn)安全(generally regarded as safe,GRAS)的優(yōu)勢,使得其所生產(chǎn)的β-半乳糖苷酶可不經(jīng)精細(xì)純化即可應(yīng)用于GOS合成。有研究發(fā)現(xiàn)來源于雙歧桿菌、乳桿菌菌株的β-半乳糖苷酶偏好合成β-(1,6)和β-(1,3)糖苷鍵型的GOS[12],對(duì)腸道細(xì)菌的生長及代謝活性有更好的選擇性[13-15],因此雙歧桿菌、乳桿菌等乳酸菌來源的β-半乳糖苷酶更適合高益生指數(shù)GOS的合成。
基于以上研究背景,本研究從新疆伊犁地區(qū)少數(shù)民族傳統(tǒng)奶酪樣品中分離篩選產(chǎn)轉(zhuǎn)糖基活性β-半乳糖苷酶的乳酸菌菌株,進(jìn)一步對(duì)篩選菌株產(chǎn)β-半乳糖苷酶培養(yǎng)條件、以乳糖為底物合成GOS的反應(yīng)條件及產(chǎn)物成分進(jìn)行研究,以期為高益生指數(shù)GOS的合成提供新的食品級(jí)產(chǎn)酶菌株。
1 材料與方法
1.1 材料與試劑
奶酪樣品取自新疆伊犁地區(qū)牧民家中,為半干型奶酪。樣品置于無菌樣品袋中低溫運(yùn)回實(shí)驗(yàn)室,4 ℃條件下保存?zhèn)溆谩?/p>
MRS種子培養(yǎng)基:瓊脂粉20 g/L、蛋白胨10 g/L、牛肉浸粉10 g/L、酵母浸粉5 g/L、葡萄糖20 g/L、K2HPO45 g/L、檸檬酸銨2 g/L、乙酸鈉5 g/L、MgSO4·7H2O 0.58 g/L,吐溫-80 1 mL/L,MnSO40.25 g/L,pH 6.3,121 ℃滅菌20 min。
發(fā)酵培養(yǎng)基:K2HPO42 g/L、醋酸鈉5 g/L、檸檬酸二銨2 g/L、MgSO4·7H2O 2 g/L、MnSO4·4H2O 0.05g/L,吐溫-80 1 mL/L,pH 6.3(其他成分在優(yōu)化培養(yǎng)時(shí)注明),121 ℃滅菌20 min。
5-溴-4-氯-3-吲哚基-β-D-半乳糖(X-Gal)、異丙基硫代半乳糖苷(isopropyl-D-thiogalactopyranosid,IPTG)、鄰硝基苯-β-D-半乳糖苷(o-nitrophenyl-β-D-galactopyranoside,ONPG) 生工生物工程(上海)股份有限公司;所用生化溶劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
Silica gel 60 No.553薄層色譜(thin layer chromatography,TLC)板 德國Merck公司;104G-102型梯度熱循環(huán)聚合酶鏈?zhǔn)椒磻?yīng)(polymerase chain reaction,PCR)擴(kuò)增儀德國SensoQuest公司;X7酶標(biāo)儀 美國BioTek有限公司;LC-10A高效液相色譜(high performance liquid chromatography,HPLC)(RID-10A視差檢測器) 島津(上海)實(shí)驗(yàn)器材有限公司;Hi-Plex Na Column糖分析柱(300 mm×7.7 mm) 安捷倫科技(中國)有限公司。
1.3 方法
1.3.1 樣品處理及菌株的分離及初篩
取保存的奶酪樣品適量,在超凈工作臺(tái)內(nèi)取出,置于已滅菌的50 mL離心管中,以滅菌生理鹽水充分振蕩分散后,無菌生理鹽水梯度稀釋(10-3、10-4、10-5),每個(gè)稀釋度吸取100 μL懸液均勻涂布到添加有X-Gal和IPTG的MRS培養(yǎng)基平板上,37 ℃恒溫培養(yǎng)12~16 h,以菌落的藍(lán)白色作為初篩依據(jù),挑選藍(lán)色菌落分離純化3 次。
1.3.2 粗酶液提取及β-半乳糖苷酶活力測定
細(xì)胞的破碎及粗酶液提取參考Zhang Hongzhi等[16]的方法,稍有修改。藍(lán)色單菌落于MRS液體培養(yǎng)基中培養(yǎng)12 h,8 000×g冷凍離心10 min收集細(xì)胞,用等體積50 mmol/L磷酸緩沖液(pH 6.5)洗滌3 次,用上述緩沖液配制的1 mg/mL溶菌酶緩沖液37 ℃孵育處理2 h,冰浴條件下超聲破碎(工作3 s停8 s、功率125 W、時(shí)間15 min),8 000×g冷凍離心10 min,取上清液即為粗酶液。取50 μL粗酶液與50 μL 50 mmol/L磷酸緩沖液(pH 6.5)配制的ONPG溶液,于一定溫度下反應(yīng)10 min,反應(yīng)結(jié)束后加入200 μL 0.5 mol/L的碳酸鈉溶液終止反應(yīng),靜置5 min后,肉眼可見顯黃色,于420 nm波長處測定吸光度,計(jì)算酶活大小。酶活單位定義為:在一定的條件下,1 min水解ONPG生成1 μmol鄰硝基苯酚的酶量為1 個(gè)酶活單位(U)。
1.3.3 菌株的形態(tài)學(xué)觀察和生理生化實(shí)驗(yàn)
目的菌株接種于營養(yǎng)瓊脂培養(yǎng)基37 ℃培養(yǎng)24 h,觀察菌落形狀、色澤、透明度、致密度等培養(yǎng)特征。挑取一環(huán)菌體涂于載玻片進(jìn)行革蘭氏染色,鏡檢。通過過氧化氫酶實(shí)驗(yàn)、糖發(fā)酵實(shí)驗(yàn)、淀粉水解實(shí)驗(yàn)、明膠液化實(shí)驗(yàn)和硫化氫實(shí)驗(yàn)測定其生理生化特性,參照文獻(xiàn)[17]中相關(guān)描述進(jìn)行鑒定。
1.3.4 16S rRNA基因的克隆及其序列分析
提取基因組DNA進(jìn)行16S rRNA基因擴(kuò)增,擴(kuò)增產(chǎn)物使用試劑盒進(jìn)行純化回收,純化的目的產(chǎn)物與pMD19-T Cloning Vector進(jìn)行連接,從轉(zhuǎn)化成功的平板培養(yǎng)基上任意挑取白斑單菌落于LB液體培養(yǎng)基中,37 ℃培養(yǎng)箱中過夜培養(yǎng),吸取1 μL菌液擴(kuò)增菌液PCR,菌液PCR產(chǎn)物用瓊脂糖凝膠電泳進(jìn)行鑒定,進(jìn)而得到陽性克隆。提取得到的質(zhì)粒使用M13 Forward Primer、M13 Reverse Primer引物進(jìn)行序列分析。將測序結(jié)果提交于GenBank數(shù)據(jù)庫,BLAST進(jìn)行在線序列同源性分析,從數(shù)據(jù)庫獲得相關(guān)種屬的16S rRNA序列,建立系統(tǒng)發(fā)育樹,進(jìn)化距離的計(jì)算采用Neighbor-Joining法,在MEGA 6.0軟件中用p-distances和Kimura-2 parameter雙參數(shù)法進(jìn)行系統(tǒng)發(fā)育樹的構(gòu)建,選用Bootstrap法評(píng)價(jià)進(jìn)化樹分支聚類的穩(wěn)定性,重復(fù)1 000 次,初步確定產(chǎn)酶菌株的種屬分類地位。
1.3.5 菌株產(chǎn)酶條件優(yōu)化
1.3.5.1 碳源
在發(fā)酵培養(yǎng)基中分別加入不同的碳源組合:20 mg/mL葡萄糖、20 mg/mL乳糖、20 mg/mL蔗糖、20 mg/mL半乳糖、10 mg/mL葡萄糖+10 mg/mL半乳糖及10 mg/mL葡萄糖+10 mg/mL乳糖,37 ℃搖床培養(yǎng)12 h,分別測定發(fā)酵液中的酶活。
1.3.5.2 乳糖質(zhì)量濃度
在發(fā)酵培養(yǎng)基中分別加入不同質(zhì)量濃度的乳糖(5、10、20、30 mg/mL),37 ℃搖床培養(yǎng)12 h,分別測定發(fā)酵液中的酶活。
1.3.6 生長曲線和產(chǎn)酶曲線的測定
將菌種接種到5 mL優(yōu)化過的發(fā)酵培養(yǎng)基中,30 ℃過夜培養(yǎng)后,以2 %接種量轉(zhuǎn)接到新鮮的10 mL MRS培養(yǎng)基中,30 ℃培養(yǎng),每間隔4 h取樣,測定菌體濃度(OD600nm)和發(fā)酵液中的β-半乳糖苷酶酶活。
1.3.7 β-半乳糖苷酶轉(zhuǎn)糖基活性的測定及反應(yīng)條件的優(yōu)化
取超聲破碎獲得的粗酶液50 μL(50 mg濕菌體),與300 μL 300 mg/mL的乳糖溶液反應(yīng),50 ℃反應(yīng)12 h,于100 ℃處理10 min終止反應(yīng),反應(yīng)液以無水乙醇稀釋至糖質(zhì)量濃度10 mg/mL,然后TLC分析反應(yīng)產(chǎn)物測定β-半乳糖苷酶的轉(zhuǎn)糖基活性。
轉(zhuǎn)糖基反應(yīng)條件的優(yōu)化,取超聲破碎獲得的粗酶液50 μL(50 mg濕菌體),與300 μL乳糖溶液反應(yīng),分別在不同pH值(以pH 4.0、5.0、6.0、7.0、8.0的磷酸氫二鈉-檸檬酸鈉緩沖液配制乳糖溶液)、初始乳糖質(zhì)量濃度(以pH 6.0的磷酸氫二鈉-檸檬酸鈉緩沖液配制100、200、300、400 mg/mL的乳糖溶液)、反應(yīng)溫度(45、50、55、60 ℃)及反應(yīng)時(shí)間(2、4、6、12、24 h)的條件下進(jìn)行酶催化轉(zhuǎn)糖基反應(yīng),TLC分析轉(zhuǎn)糖基產(chǎn)物,確定酶催化反應(yīng)的最佳條件。
1.3.8 TLC分析
參考盧麗麗等的方法[18]。取活化過的硅膠鋁板一塊,毛細(xì)管點(diǎn)樣后以正丁醇-乙醇-水(5∶3∶2,V/V)為展層劑上行展層,層析至距離頂端1 cm處,取出用吹風(fēng)機(jī)吹干,然后以顯色劑(苯胺-二苯胺-磷酸)噴霧,于120 ℃烘箱中烘10 min,各種糖即顯出不同顏色的斑點(diǎn),將薄板掃描后,通過軟件ImageJ 1.40對(duì)樣品中轉(zhuǎn)糖基反應(yīng)產(chǎn)物的斑點(diǎn)進(jìn)行定量分析。1.3.9 HPLC分析
參考盧麗麗等的方法[18]。轉(zhuǎn)糖基產(chǎn)物以三蒸水稀釋為50 mg/mL的糖溶液,0.22 μm濾膜過濾后HPLC進(jìn)樣分析。色譜柱為Hi-Plex Na低聚糖分析柱,流動(dòng)相為三蒸水,流速0.3 mL/min,柱溫80 ℃,進(jìn)樣量20 μL。
1.4 數(shù)據(jù)處理
酶活測定數(shù)據(jù)為3 次平行測定結(jié)果;TLC分析采用軟件ImageJ 1.40對(duì)糖斑點(diǎn)進(jìn)行掃描定量,確定糖組分的含量;HPLC分析采用島津LabSolutions色譜數(shù)據(jù)處理系統(tǒng)進(jìn)行峰面積積分,確定糖組分的含量,所有數(shù)據(jù)統(tǒng)計(jì)采用Excel軟件,圖表采用Origin Pro 8軟件繪制。
2 結(jié)果與分析
2.1 產(chǎn)轉(zhuǎn)糖基活性β-半乳糖苷酶菌株的篩選鑒定
2.1.1 轉(zhuǎn)糖基活性β-半乳糖苷酶產(chǎn)生菌的篩選
分離純化得到的可培養(yǎng)物在含有X-gal的MRS平板上劃線分離,得到32 株菌落為藍(lán)色的菌株,表明這32 株菌具有β-半乳糖苷酶活性。收集初篩菌株的菌體細(xì)胞,破碎得到粗酶液,以乳糖為底物進(jìn)行轉(zhuǎn)糖基反應(yīng)進(jìn)行復(fù)篩,產(chǎn)物采用TLC分析,結(jié)果如圖1所示,獲得具有轉(zhuǎn)糖基活性的菌株6 株,其中菌株YLBGNL-S7的轉(zhuǎn)糖基活性最強(qiáng),因此對(duì)該菌株開展進(jìn)一步的研究。
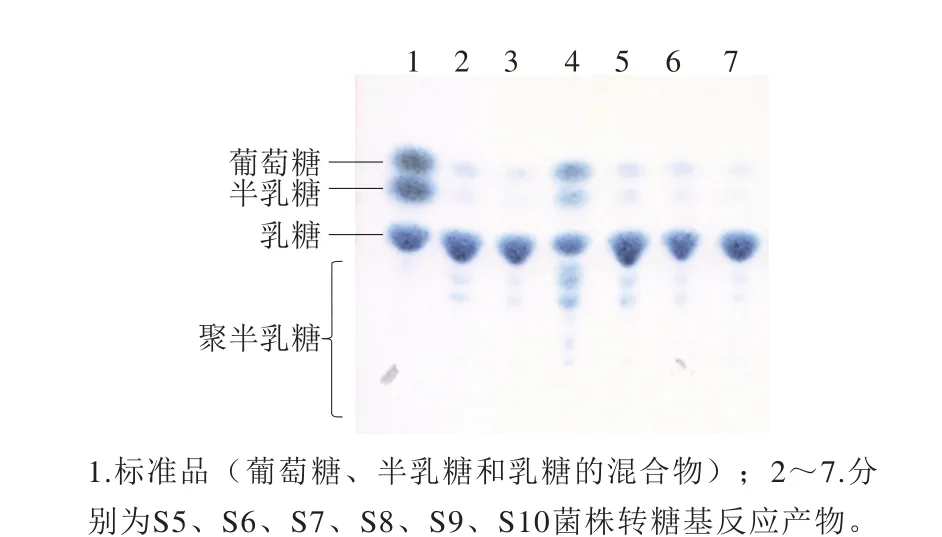
圖1 TLC分析復(fù)篩菌株的轉(zhuǎn)糖基反應(yīng)產(chǎn)物Fig. 1 TLC analysis of the transglycosylation reaction products produced by selected strains
2.1.2 形態(tài)學(xué)及生理生化特征
形態(tài)學(xué)觀察顯示,菌株YLBGNL-S7在MRS培養(yǎng)基上形成圓形菌落,邊緣整齊,表面光滑,呈乳白色;菌體桿狀,革蘭氏染色陽性。
菌株YLBGNL-S7的生理生化特征見表1,該菌株能發(fā)酵葡萄糖、乳糖,不能發(fā)酵阿拉伯糖、鼠李糖、木糖,且淀粉水解實(shí)驗(yàn)、明膠水解實(shí)驗(yàn)、硫化氫產(chǎn)生實(shí)驗(yàn)結(jié)果均為陰性。這些特征與乳酸桿菌的特征極為相似,初步斷定該株菌為乳桿菌。
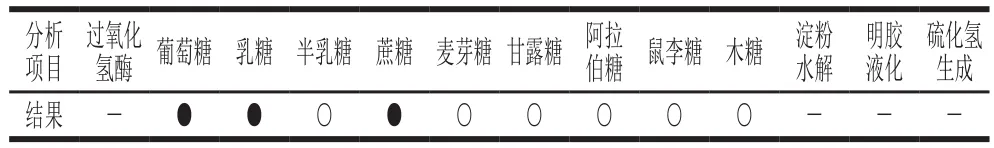
表1 菌株YLBGNL-S7的生理生化特性Table 1 Physiological and biochemical characteristics of strain YLBGNL-S7
2.1.3 16S rRNA基因的克隆及其序列分析
對(duì)菌株YLBGNL-S7的16S rRNA基因序列進(jìn)行擴(kuò)增,獲得大小約為1 500 bp的擴(kuò)增片段(GenBank登錄號(hào)為MH917109)。將擴(kuò)增所得基因序列與GenBank數(shù)據(jù)庫中的序列進(jìn)行同源性比對(duì),比對(duì)結(jié)果顯示,菌株YLBGNL-S7的16S rRNA基因序列與多株L. plantarum的16S rRNA基因序列相似性均達(dá)到99%。系統(tǒng)進(jìn)化分析(圖2)顯示YLBGNL-S7與L. plantarumJCM 13899(LC311069.1)、L. plantarumDJ-04(KF929420.1)、L. plantarumA16(MG754631.1)及L. plantarumNi344(AB601168.1)等菌株以100%的支持率聚成一簇。結(jié)合生理生化實(shí)驗(yàn),將菌株YLBGNL-S7鑒定為L. plantarumYLBGNL-S7。

圖2 菌株YLBGNL-S7的系統(tǒng)進(jìn)化分析Fig. 2 Phylogenetic tree of strain YLBGNL-S7
2.2 產(chǎn)β-半乳糖苷酶條件的優(yōu)化
2.2.1 碳源對(duì)產(chǎn)酶的影響
為確定L. plantarumYLBGNL-S7產(chǎn)酶的最佳碳源,分別以不同的碳源組合的發(fā)酵培養(yǎng)基,37 ℃搖床培養(yǎng)12 h,測定菌株的生物量OD600nm及產(chǎn)β-半乳糖苷酶酶活,結(jié)果如圖3所示,不同碳源條件下菌株的生物量無明顯差異,但以乳糖為單一碳源時(shí)YLBGNL-S7菌株產(chǎn)β-半乳糖苷酶的酶活最高,可達(dá)(84.5±2.9)U/mL,顯著高于其他碳源(組合),表明該菌株所產(chǎn)β-半乳糖苷酶為誘導(dǎo)酶。
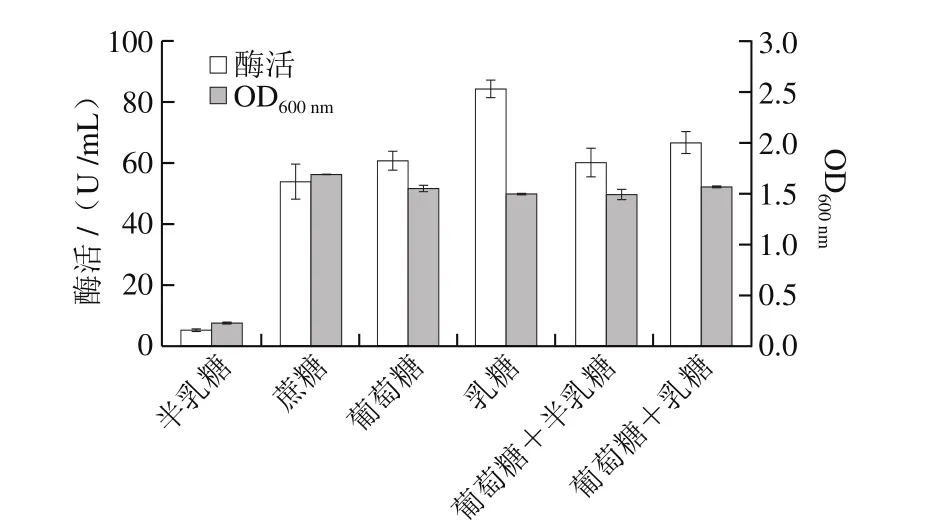
圖3 碳源對(duì)產(chǎn)β-半乳糖苷酶的影響Fig. 3 Effect of carbon source on the production of β-galactosidases
2.2.2 乳糖質(zhì)量濃度對(duì)產(chǎn)酶的影響
進(jìn)一步對(duì)不同乳糖質(zhì)量濃度條件下YLBGNL-S7菌株產(chǎn)β-半乳糖苷酶的水平進(jìn)行測定,結(jié)果表明(圖4),乳糖質(zhì)量濃度為10 mg/mL時(shí),最適合該菌株發(fā)酵產(chǎn)β-半乳糖苷酶。
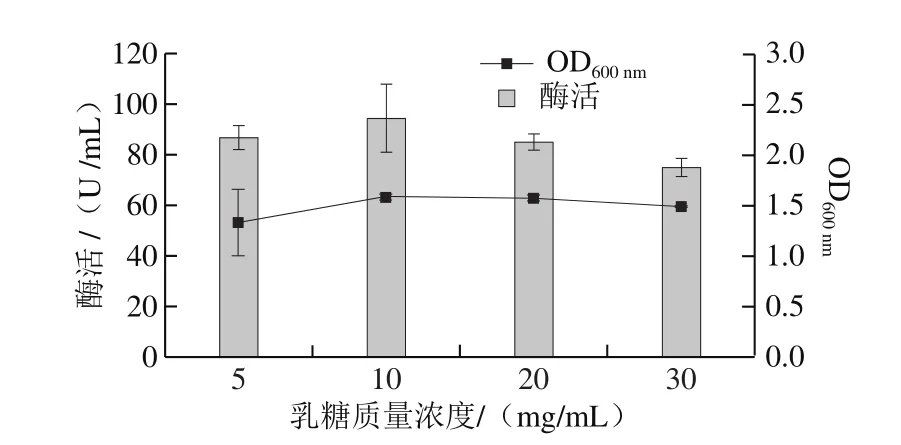
圖4 乳糖質(zhì)量濃度對(duì)產(chǎn)β-半乳糖苷酶的影響Fig. 4 Effect of lactose concentration on the production of β-galactosidases
2.2.3 菌株的產(chǎn)酶曲線與生長曲線
在以上單因素試驗(yàn)優(yōu)化的基礎(chǔ)上,將L. plantarum YLBGNL-S7菌株接種于改良的MRS培養(yǎng)基中,37 ℃搖床培養(yǎng)至24 h,產(chǎn)酶曲線顯示該菌株在培養(yǎng)18 h左右時(shí)產(chǎn)酶水平最高,可達(dá)(157.1±7.9) U/mL(圖5)。
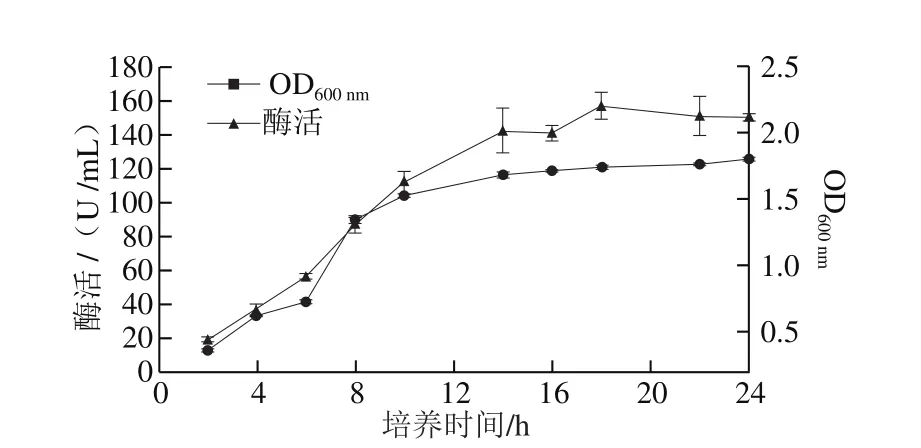
圖5 YLBGNL-S7菌株產(chǎn)β-半乳糖苷酶曲線及生長曲線Fig. 5 β-Galactosidase production curve and growth curve of strain YLBGNL-S7
2.3 β-半乳糖苷酶轉(zhuǎn)糖基反應(yīng)條件的研究
2.3.1 pH值對(duì)GOS合成的影響
分別以pH 4.0、5.0、6.0、7.0、8.0的磷酸氫二鈉-檸檬酸鈉緩沖液配制乳糖溶液,55 ℃進(jìn)行轉(zhuǎn)糖基反應(yīng),TLC分析不同反應(yīng)pH值條件的產(chǎn)物(圖6)。結(jié)果表明,pH 6.0為轉(zhuǎn)糖基反應(yīng)的最適pH值。
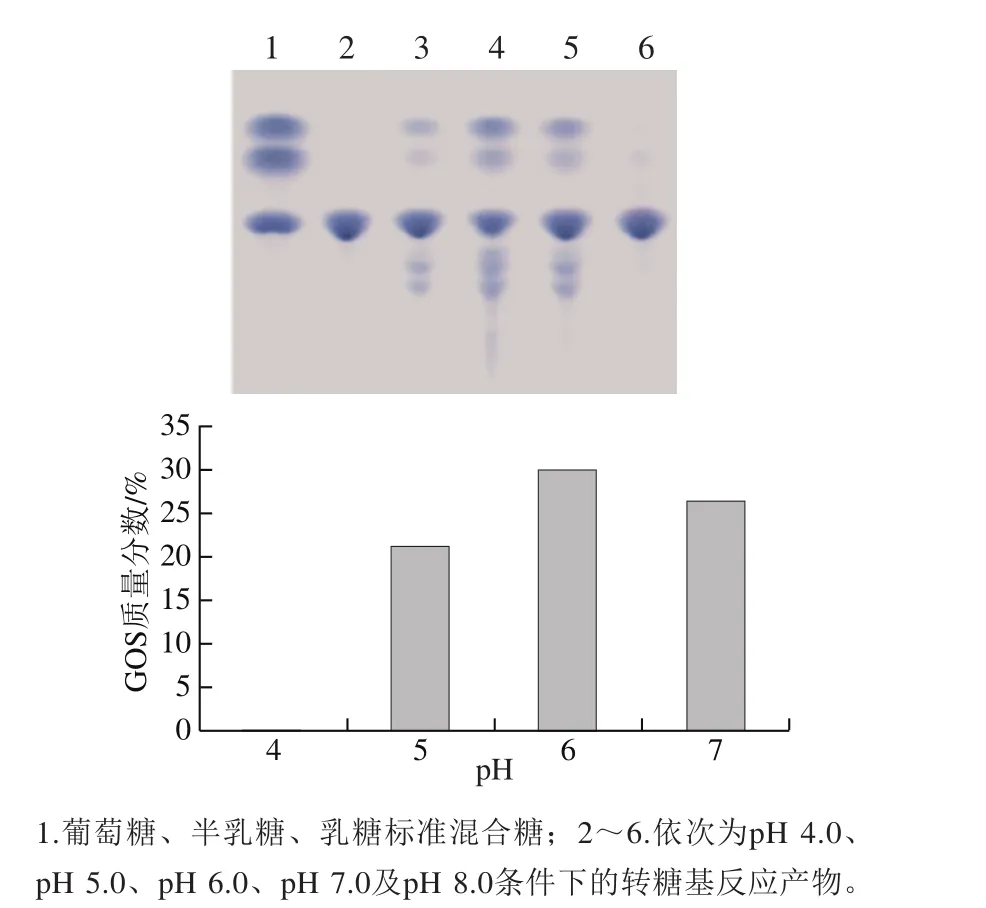
圖6 TLC分析pH值對(duì)GOS合成的影響Fig. 6 Effect of pH on GOS synthesis
2.3.2 初始乳糖質(zhì)量濃度對(duì)GOS合成的影響
隨著初始乳糖質(zhì)量濃度的增加,轉(zhuǎn)糖基反應(yīng)產(chǎn)物中GOS的量逐漸增加(圖7),當(dāng)初始乳糖質(zhì)量濃度為300 mg/mL時(shí),轉(zhuǎn)糖基反應(yīng)生成GOS的得率最高。
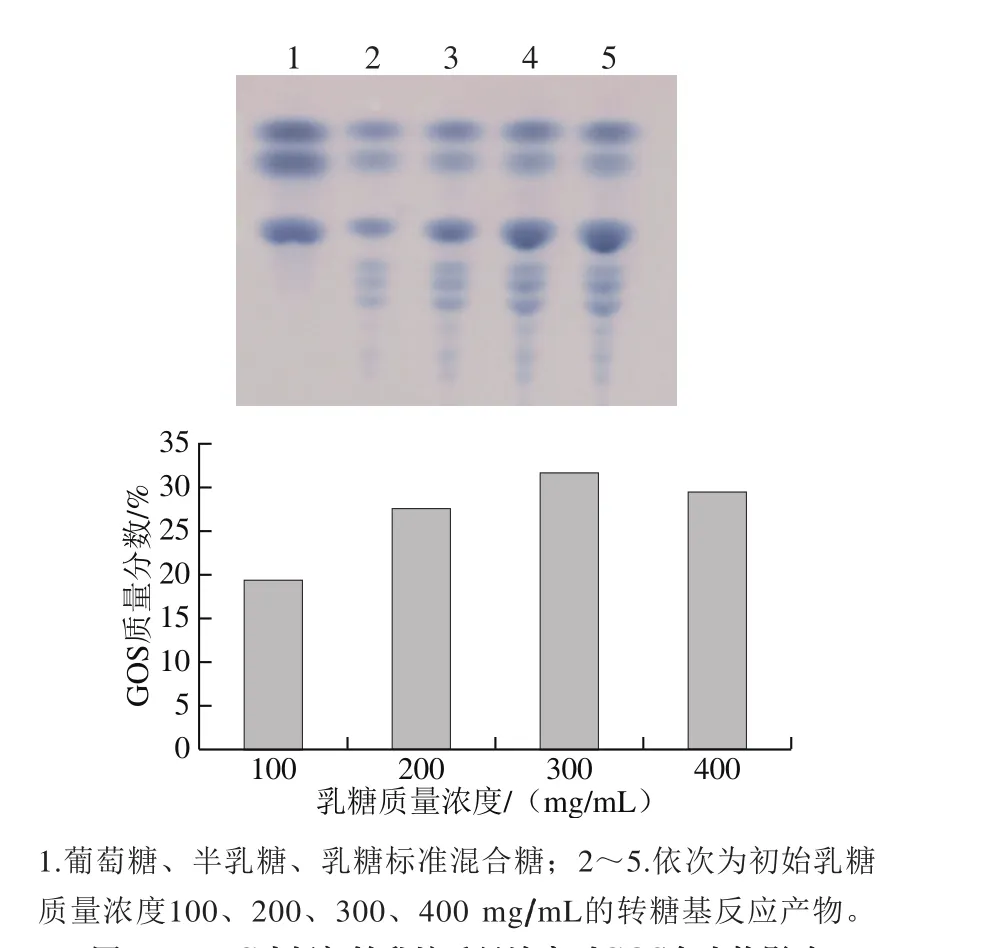
圖7 TLC分析初始乳糖質(zhì)量濃度對(duì)GOS合成的影響Fig. 7 Effect of initial lactose concentration on GOS synthesis
2.3.3 反應(yīng)溫度對(duì)GOS合成的影響
用pH 6.0的磷酸氫二鈉-檸檬酸鈉緩沖液配制300 mg/mL的乳糖溶液,分別在45、50、55、60 ℃進(jìn)行轉(zhuǎn)糖基反應(yīng),TLC分析其產(chǎn)物。結(jié)果顯示(圖8)轉(zhuǎn)糖基反應(yīng)的最適溫度為50 ℃。
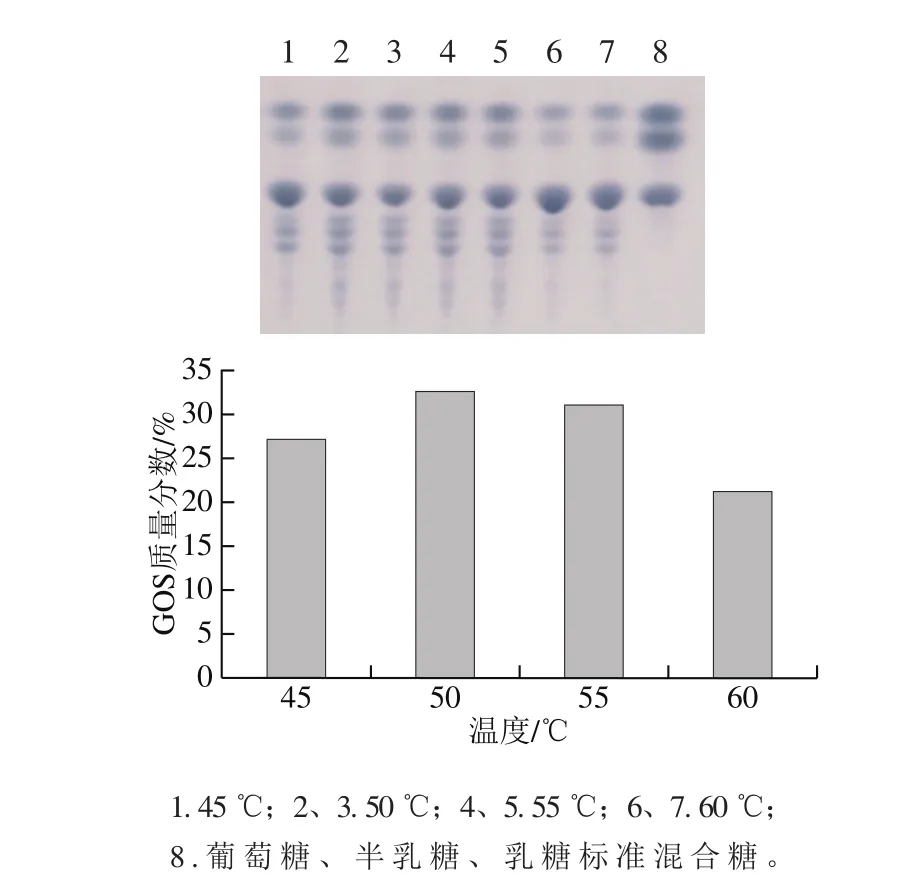
圖8 TLC分析反應(yīng)溫度對(duì)GOS合成的影響Fig. 8 Effect of reaction temperature on GOS synthesis
2.3.4 反應(yīng)時(shí)間對(duì)GOS合成的影響
隨著反應(yīng)的進(jìn)行,反應(yīng)液中乳糖含量不斷降低,反應(yīng)4 h轉(zhuǎn)糖基反應(yīng)生成的GOS含量最高,繼續(xù)反應(yīng),轉(zhuǎn)糖基反應(yīng)產(chǎn)物中的GOS含量逐漸降低(圖9),因此確定該β-半乳糖苷酶以乳糖為底物合成GOS的最佳反應(yīng)時(shí)間為4 h。
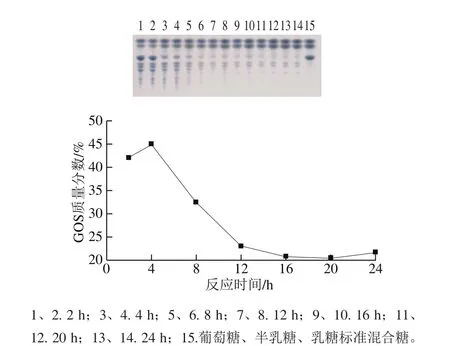
圖9 TLC分析反應(yīng)時(shí)間對(duì)GOS合成的影響Fig. 9 Effect of reaction time on GOS synthesis
2.4 以乳糖為底物合成GOS產(chǎn)物組分的定量分析
基于TLC分析的實(shí)驗(yàn)結(jié)果,取pH 6.0,初始乳糖質(zhì)量濃度為300 mg/mL,50 ℃條件下轉(zhuǎn)糖基反應(yīng)4 h的GOS產(chǎn)物進(jìn)行HPLC分析,結(jié)果見圖10。其中保留時(shí)間為34.375 min的峰為半乳糖,保留時(shí)間為32.022 min為葡萄糖,26.740 min為二糖(乳糖和轉(zhuǎn)移二糖未分離),22.522 min為低聚半乳三糖,6.758~19.485 min之間的峰為三糖以上的低聚半乳糖成分。
根據(jù)峰面積計(jì)算,最適反應(yīng)條件下轉(zhuǎn)糖基產(chǎn)物中葡萄糖質(zhì)量分?jǐn)?shù)為29.84%,半乳糖質(zhì)量分?jǐn)?shù)為15.28%,二糖(包括乳糖和轉(zhuǎn)移二糖)質(zhì)量分?jǐn)?shù)為29.77%,轉(zhuǎn)移三糖質(zhì)量分?jǐn)?shù)為12.95%,轉(zhuǎn)移三糖以上的GOS質(zhì)量分?jǐn)?shù)為12.17%。結(jié)合TLC分析中乳糖與轉(zhuǎn)移二糖斑點(diǎn)的掃描結(jié)果,確定乳糖質(zhì)量分?jǐn)?shù)為11.48%,轉(zhuǎn)移二糖質(zhì)量分?jǐn)?shù)為18.29%。因此,可確定以L. plantarum YLBGNL-S7所產(chǎn)β-半乳糖苷酶催化乳糖合成GOS的得率為43.40%,GOS成分以轉(zhuǎn)移二糖和轉(zhuǎn)移三糖為主,分別為18.29%和12.95%,殘余乳糖質(zhì)量分?jǐn)?shù)僅為11.48%。
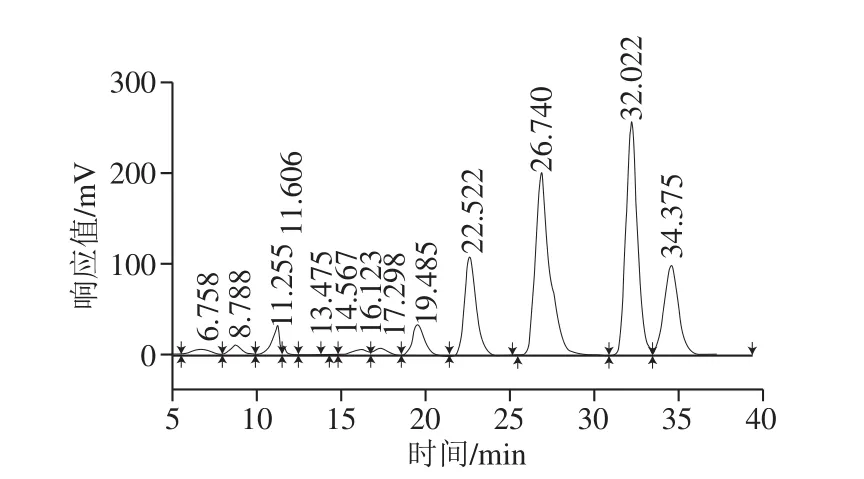
圖10 轉(zhuǎn)糖基反應(yīng)產(chǎn)物的HPLC分析Fig. 10 HPLC analysis of transglycosylation reaction productions
3 討 論
β-半乳糖苷酶以乳糖為底物既能分解生成半乳糖和葡萄糖,也能在一定條件下通過轉(zhuǎn)半乳糖基反應(yīng)合成GOS。以乳糖為底物反應(yīng)合成GOS的得率主要取決于β-半乳糖苷酶本身的特性及乳糖質(zhì)量濃度、水活度、溫度、pH值等反應(yīng)條件[5,19]。不同來源的β-半乳糖苷酶其乳糖水解活性與轉(zhuǎn)糖基活性相對(duì)比例差異較大[20]。近期分離的產(chǎn)轉(zhuǎn)糖基活性較高的β-半乳糖苷酶菌株主要有成團(tuán)腸桿菌[18]、枯草芽孢桿菌[21]、嗜熱脂肪地芽孢桿菌[22]、巴倫葛茲類芽孢桿菌[23]、馬克思克魯維酵母[24-25]、曲霉[26]、青霉[27]以及部分古生菌[28-29]。
與A. oryzae等菌株可分泌表達(dá)β-半乳糖苷酶不同,乳酸菌來源的β-半乳糖苷酶通常為胞內(nèi)酶。但乳酸菌作為GRAS的微生物類群,賦予其生產(chǎn)的酶在食品加工中不經(jīng)特別純化即可應(yīng)用的優(yōu)勢。因此,本研究選擇新疆伊犁地區(qū)少數(shù)民族傳統(tǒng)奶酪樣品進(jìn)行分離篩選,并成功獲得產(chǎn)轉(zhuǎn)糖基活性較高的β-半乳糖苷酶乳酸菌6 株。對(duì)其中轉(zhuǎn)糖基活性最高的YLBGNL-S7菌株進(jìn)行生理生化和16S rRNA基因序列比對(duì)分析,確定該菌株為植物乳桿菌(L. plantarum)。近年來,除兩歧雙歧桿菌[13]和植物乳桿菌[30-31]外,國內(nèi)外研究者還相繼從羅伊氏乳桿菌[14]、戊糖乳桿菌[32]、米酒乳桿菌[33]、馬乳酒樣乳桿菌[34]、嗜熱鏈球菌[35]等乳酸菌菌株中分離獲得具有轉(zhuǎn)糖基活性的β-半乳糖苷酶。
此外,已有來源于人唾液L. plantarum WCFS1及來源于傳統(tǒng)泡菜L. plantarum 70810的β-半乳糖苷酶合成GOS的報(bào)道[16,30],但來源于奶酪的乳源L. plantarum β-半乳糖苷酶合成GOS的研究鮮見報(bào)道。對(duì)比不同來源L. plantarum產(chǎn)β-半乳糖苷酶水平可以發(fā)現(xiàn),本研究分離篩選的乳源L. plantarum YLBGNL-S7和泡菜來源L. plantarum 70810在乳糖為碳源的MRS培養(yǎng)基中產(chǎn)β-半乳糖苷酶水平相差約30 倍((157.1±7.9)U/mL和5~6 U/mL),表明乳源L. plantarum產(chǎn)β-半乳糖苷酶及分解利用乳糖能力顯著強(qiáng)于泡菜來源L. plantarum。基于乳桿菌屬菌株基因組學(xué)的研究也證明,不同環(huán)境來源的相同種屬乳桿菌的代謝特點(diǎn)與其生活環(huán)境密切相關(guān),特別是一些碳水化合物代謝相關(guān)酶的基因在乳桿菌屬不同種菌株之間會(huì)存在較大的差異[36]。
研究表明,A. oryzae來源β-半乳糖苷酶的最適轉(zhuǎn)糖基反應(yīng)pH 4.5,B. circulans的最適pH 6.0,而K. lactis的最適pH 7.0[1]。本研究中L. plantarum YLBGNL-S7所產(chǎn)β-半乳糖苷酶以乳糖為底物合成GOS的最適pH 6.0,表明其較為適合于牛乳和乳清中乳糖的水解。YLBGNL-S7所產(chǎn)β-半乳糖苷酶在初始乳糖質(zhì)量濃度為100~400 mg/mL及45~60 ℃的溫度范圍內(nèi)均可有效合成GOS,表明該β-半乳糖苷酶能夠在較寬的乳糖質(zhì)量濃度及溫度范圍內(nèi)催化合成GOS。
本研究中從奶酪樣品中篩選的L. plantarum YLBGNL-S7所產(chǎn)β-半乳糖苷酶在初始乳糖質(zhì)量濃度為300 mg/mL、pH 6.0、50 ℃的條件下反應(yīng)4 h,GOS的得率最高達(dá)到43.40%,高于人唾液來源L. plantarum WCFS1的41%[30],略低于泡菜來源L. plantarum 70810的44.3%[16],但高于商業(yè)化菌株B. circulans來源的β-半乳糖苷酶合成GOS的得率40%[5]。與K. lactis來源β-半乳糖苷酶以乳糖為底物的轉(zhuǎn)糖基反應(yīng)產(chǎn)物主要為轉(zhuǎn)移二糖不同[19],YLBGNL-S7合成GOS產(chǎn)物中轉(zhuǎn)移二糖和轉(zhuǎn)移三糖質(zhì)量分?jǐn)?shù)分別為18.29%和12.95%,殘余乳糖質(zhì)量分?jǐn)?shù)僅為11.48%,與L. plantarum WCFS1來源β-半乳糖苷酶合成GOS中轉(zhuǎn)移二糖質(zhì)量分?jǐn)?shù)為19%、轉(zhuǎn)移三糖質(zhì)量分?jǐn)?shù)為21%、轉(zhuǎn)移四糖質(zhì)量分?jǐn)?shù)1.3%,殘余乳糖質(zhì)量分?jǐn)?shù)為15%較為接近[30]。然而,不同來源L. plantarum所產(chǎn)β-半乳糖苷酶合成GOS的糖苷鍵類型是否存偏好性的差異,還有待進(jìn)一步研究。
4 結(jié) 論
本研究從新疆伊犁地區(qū)少數(shù)民族傳統(tǒng)奶酪中篩選獲得的一株產(chǎn)轉(zhuǎn)糖基活性β-半乳糖苷酶的新菌株,形態(tài)學(xué)、生理生化及分子生物學(xué)鑒定為L. plantarum YLBGNL-S7。該菌株在以乳糖為碳源的MRS培養(yǎng)基中發(fā)酵產(chǎn)β-半乳糖苷酶水平可達(dá)(157.1±7.9)U/mL,其所產(chǎn)β-半乳糖苷酶在50 ℃、pH 6.0、乳糖質(zhì)量濃度300 mg/mL反應(yīng)4 h,反應(yīng)產(chǎn)物GOS得率可達(dá)43.40%,該菌株為酶法合成GOS提供了新的食品級(jí)酶源。

