miR-146a-5p對人牙髓干細胞成牙本質分化的影響
邱在玲 林詩晗 曾建釵 柯志紅 肖婷婷 呂紅兵
人牙髓干細胞(dental pulp stem cells,DPSCs)和根尖牙乳頭干細胞(stem cells from the apical papilla,SCAPs)是牙髓組織工程理想的細胞來源。研究發現,DPSCs和SCAPs具有相似的骨/牙本質發生和生長因子受體基因[1],但SCAPs呈現出更活躍的增殖和更強的成牙本質生成能力[2],與DPSCs相比,SCAPs可能是一種更早期的牙源性干細胞,并且成為組織再生更加優越的細胞來源[3]。然而SCAPs臨床上來源更少,獲取難度相對較大。因此,是否能夠通過改變DPSCs的干性狀態從而取代SCAPs,在牙髓再生中發揮重要的作用。
越來越多的證據表明,miRNA在干細胞生物學中起著至關重要的調控作用[4-7]。前期研究采用二代測序技術,檢測DPSCs和SCAPs中miRNAs的表達,篩選差異表達的miRNAs,發現與DPSCs相比,SCAPs中表達下調超過1.5倍的miRNAs有7個(miR-224-5p、miR-1247-5p、miR-3065-3p、miR-452-5p、miR-767-5p、miR-4284、miR-146a-5p),無表達上調miRNAs[8]。本研究將通過qRT-PCR驗證差異miRNA的表達,進一步對特異miRNA在DPSCs和SCAPs干性維持中的調控作用做初步探索。
1 材料與方法
1.1 主要儀器和試劑
酶標儀(Heraeu,德國);PCR儀(Eppendorf,德國);LightCycler480實時熒光定量PCR擴增儀(Applied Biosystems,美國);倒置相差熒光顯微鏡(Olym-pus,日本);α-MEM、胎牛血清、胰蛋白酶(Gibco,美國);Ⅰ型膠原酶、dispase II酶、β-甘油磷酸鈉、地塞米松、抗壞血酸(Sigma,美國);鼠抗人STRO-1單克隆抗體(R&D systems,美國);免疫磁珠(Miltenyi Biotec,德國);Trizol總RNA提取試劑(Invitrogen,美國);逆轉錄試劑盒、PCR試劑盒(Takara,日本);慢病毒(上海吉凱基因化學技術有限公司);堿性磷酸酶(ALP)檢測試劑盒(南京建成生物科技有限公司);茜素紅(南京森貝伽生物科技有限公司)。
1.2 人牙髓細胞和根尖牙乳頭細胞的分離和培養
選取福建醫科大學附屬口腔醫院口腔頜面外科17~20歲健康的第三磨牙,拔除后立即放入預冷的培養基中保存,4 h內原代取材。無菌條件下取出牙髓或分離根尖牙乳頭組織,每個組織塊體積在1 mm3左右,CD酶(I型膠原酶3 mg/ml,dispase II酶4 mg/ml)37℃消化30 min,離心后加入含10%胎牛血清的α-MEM培養液,細胞篩過濾,獲得單細胞懸液,37℃、5%CO2孵育箱中培養,24 h后換液。細胞生長達70%~80%匯合時傳代,取第3代細胞進行后續實驗。
1.3 免疫磁珠分選DPSCs和SCAPs
分別取1×107對數生長期的DPSCs和SCAPs,加入鼠抗人STRO-1單克隆抗體,4℃孵育15 min,用4 ml running buffer清洗細胞,去除殘留的抗體。加入免疫磁珠4℃孵育15 min,再次加入不少于4 ml running buffer洗滌。然后用MACS磁柱分選STRO-1陽性DPSCs和SCAPs。
1.4 實時熒光定量PCR
按說明書用Trizol reagent提取總RNA。對于miRNA,采用Mir-X miRNA First-Strand Synthesis Kit試劑盒,Poly(A)加尾反應和反轉錄反應一步完成。熒光定量PCR使用SYBR Premix Ex Taq II(Tli RNaseH Plus)進行,以U6為內參,用試劑盒中提供的mRQ 3’Primer及自行設計的miRNA Specific Forward Primer對miRNA進行定量解析。對于mRNA,按PrimeScriptTMRT reagent Kit with gDNA Erase試劑盒和SYBR Premix Ex Taq(Tli RNaseH Plus)試劑盒說明要求進行逆轉錄和擴增。引物由上海生工合成,PCR引物序列見表1。每個樣本設3個復孔,采用2-ΔΔCt法計算每個樣本miRNA或mRNA的相對表達量。
1.5 慢病毒轉染
慢病毒載體由上海吉凱基因化學技術有限公司構建并包裝。慢病毒載體攜帶增強綠色熒光蛋白(EGFP)和嘌呤霉素抗性基因。將細胞用胰蛋白酶消化后,以每孔5×105細胞數接種于6孔板內,放置于37℃、5%CO2培養箱內常規培養24 h后,加入5μg/ml polybrene,感染復數MOI為50,將miR-146a-5p過表達慢病毒(miR-146a-5p overexpression)和空載對照病毒(empty vector,EV)轉染到DPSCs。EGFP可以通過顯微鏡進行觀察。2μg/ml嘌呤霉素用于篩選成功轉染慢病毒的DPSCs。隨后收集各組細胞通過qRTPCR驗證轉染效率,以及進行后續實驗。

表1 實時熒光定量PCR引物序列Tab 1 Primer sequences used in real time PCR assay
1.6 ALP活性檢測和茜素紅染色
成牙本質分化培養基誘導7 d后,RIPA buffer用于裂解細胞,并且應用BCA試劑盒測定各組細胞蛋白濃度,然后通過ALP試劑盒(碧云天)以及吸光光度法檢測ALP活性,實驗步驟參照其說明書。誘導21 d后,棄培養基,PBS洗3次,4%多聚甲醛固定30 min,PBS洗3次,用1%pH 4.1茜素紅染色液染色10 min,蒸餾水輕輕沖洗3次后顯微鏡下觀察礦化結節并拍照。成牙本質分化誘導液:α-MEM+10%FBS+10 mmol/Lβ-甘油磷酸鈉+50μg/ml VitC+10 nmol/L dex(地塞米松)。
1.7 統計學分析
2 結 果
2.1 DPSCs和SCAPs中差異表達的miRNAs的qRTPCR驗證
實時熒光定量PCR結果表明,miR-224-5p、miR-1247-5p、miR-452-5p、miR-767-5p、miR-4284和miR-146a-5p在DPSCs中的表達均高于SCAPs,其中miR-146a-5p表達差異最大,在DPSCs中miR-146a-5p的表達量約為SCAPs的10倍(10.549±1.247,P<0.05)。而miR-3065-3p的表達在DPSCs和SCAPs中無明顯差異(圖1)。

圖1 DPSCs和SCAPs中miR-224-5p、miR-1247-5p、miR-3065-3p、miR-452-5p、miR-767-5p、miR-4284和miR-146a-5p的表達Fig 1 Relative expression of miR-224-5p,miR-1247-5p,miR-3065-3p,miR-452-5p,miR-767-5p,miR-4284 and miR-146a-5p in DPSCs and SCAPs
2.2 轉染效率檢測
DPSCs轉染miR-146a-5p過表達慢病毒后,qRTPCR顯示,miR-146a-5p表達相比于陰性對照病毒組上升約50倍(50.727±7.658,P<0.05),轉染效果明顯(圖2)。
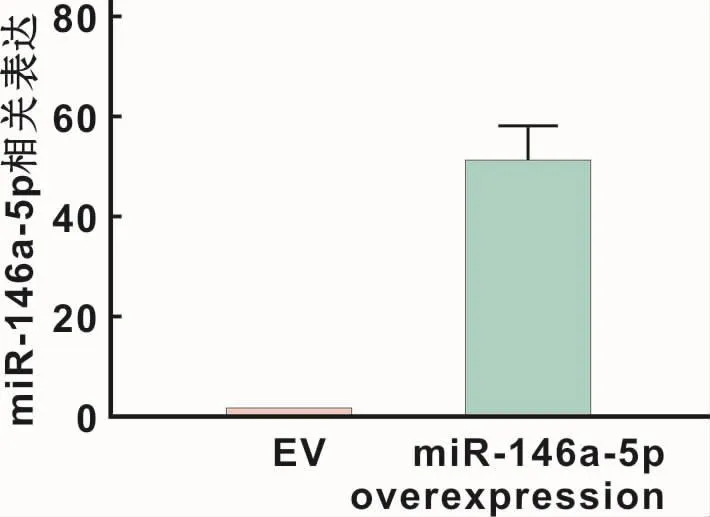
圖2 過表達慢病毒轉染DPSCs后miR-146a-5p的表達Fig 2 Relative expression of miR-146a-5p in DPSCs after transfection with miR-146a-5p overexpression lentivirus
2.3 ALP活性檢測和茜素紅染色結果
誘導7 d后,ALP活性檢測表明誘導DPSCs成牙本質定向分化時,miR-146a-5p過表達組ALP活性明顯高于對照組,P<0.05。21 d后茜素紅染色發現,轉染miR-146a-5p過表達慢病毒后,實驗組較對照組染色加深(圖3)。

圖3 轉染miR-146a-5p過表達慢病毒對DPSCs的成牙本質分化能力的影響Fig 3 The role of miR-146a-5p in the odontogenic differentiation of DPSCs
2.4 誘導后成牙本質相關基因的檢測
成牙本質分化培養基誘導14 d后,qRT-PCR結果顯示,miR-146a-5p過表達組相比于對照組ALP表達上升約4倍(4.215±0.224,P<0.05),DSPP表達上升約2倍(2.094±0.419,P<0.05)(圖4)。
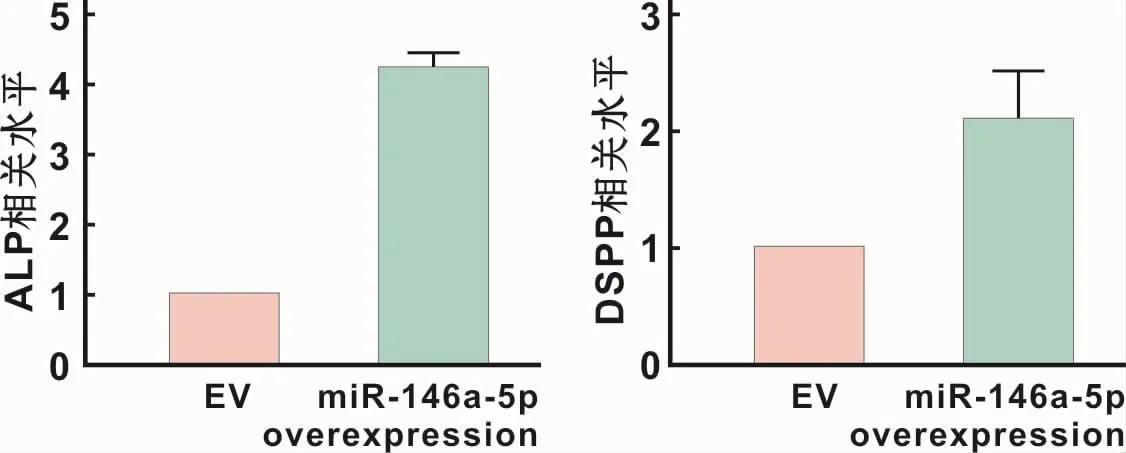
圖4 轉染并成牙本質誘導后成牙本質相關基因的表達Fig 4 The odontogenic marker gene expression after transfection with miR-146a-5p overexpression lentivirus and odontogenic induction
3 討 論
DPSCs與SCAPs是干性狀態不同的2種牙源性干細胞,SCAPs可能是組織工程更理想的細胞來源,但DPSCs由于獲取條件相對寬松,在組織工程中得到了更加廣泛的運用,然而DPSCs分化程度相對較高,分化為成牙本質的能力較弱,因此許多學者都在嘗試各種增強DPSCs干性、促進組織再生的方法。miRNAs參與調控生物體生長發育等許多復雜的生命過程,在維持干細胞的自我更新和調控多向分化等方面具有重要影響。
前期研究采用二代測序技術,篩選DPSCs與SCAPs中差異表達的miRNAs,超過1.5倍且P<0.05的差異miRNA有7個:miR-224-5p、miR-1247-5p、miR-3065-3p、miR-452-5p、miR-767-5p、miR-4284、miR-146a-5p[8]。本研究qRT-PCR結果顯示,miR-224-5p、miR-1247-5p、miR-452-5p、miR-767-5p、miR-4284和miR-146a-5p在SCAPs中表達均下調,與測序結果相一致,而miR-3065-3p表達無明顯差異,這可能是由于高通量測序技術進行測序,雖然能夠產生大量的測序數據,但是同樣存在一定的假陽性或假陰性,因此本研究進一步通過qRT-PCR驗證測序結果。發現miR-146a-5p在DPSCs與SCAPs中表達差異最大,因此猜想miR-146a-5p的表達可能與DPSCs與SCAPs的干性狀態不同有關。
miR-146a是miR-146 miRNA家族(由兩個進化保守的miRNA基因組成:miR-146a和miR-146b)的成員,已被證實參與多種干細胞增殖、分化和凋亡等反應的調控。研究發現miR-146a-5p的表達與人骨髓間充質干細胞的衰老狀態有關[9]。并且,miR-146a能夠促進血管內皮生長因子的表達以及人骨髓間充質干細胞的血管生成[10]。過表達miR-146抑制小鼠神經嵴干細胞的增殖,而促進分化[11]。而miR-146a-5p是否參與調控DPSCs的干性狀態目前尚不清楚,需進一步研究。本實驗通過慢病毒感染手段過表達DPSCs中miR-146a-5p,檢測其對DPSCs成牙本質分化能力的調控作用。此慢病毒轉染系統屬于穩定轉染,其轉染效果滿足本實驗較長時間點的要求。本實驗所用慢病毒載體為GV369,攜帶嘌呤霉素抗性基因,當慢病毒轉染細胞后,可用嘌呤霉素殺滅未被轉染的細胞,從而達到篩選穩定轉染的DPSCs的目的。在經過特異性過表達之后,miR-146a-5p表達顯著增高,說明轉染效果較高。
本研究結果顯示,經過21天的礦化誘導,過表達miR-146a-5p茜素紅染色更深,并且形成更多、更明顯的礦化結節,表明miR-146a-5p在DPSCs向成牙本質細胞分化過程中,促使DPSCs分泌了更多的礦化基質。DSPP(牙本質涎磷蛋白)是牙本質中最豐富的非膠原蛋白,在牙本質形成和生物礦化過程中起著重要的作用[12]。本實驗發現,過表達組DSPP的表達明顯高于對照組。ALP也是DPSCs成牙本質細胞向分化的重要礦化標志,ALP活性和qRT-PCR檢測,均顯示過表達組ALP表達顯著增加。
以上結果表明miR-146a-5p可以促進DPSCs向成牙本質細胞分化,推測低水平的miR-146a-5p可能有利于DPSCs體外擴增時維持低分化狀態,成為牙齒組織工程和牙髓組織再生中更好的細胞來源。但miR-146a-5p在DPSCs向成牙本質細胞分化及干性調控中的具體機制還沒有完全闡明,需進行進一步的研究。

