產雞α 干擾素的畢赤酵母菌高密度發酵工藝研究
曹 丁, 李學優, 肖宏艷, 昝繼清
(廣州市微生物研究所,廣東廣州510663)
近年來家禽腫瘤和病毒感染引起的雞馬立克病、新城疫、傳染性法氏囊病、傳染性支氣管炎等烈性傳染性疾病呈地方性流行趨勢,每年造成數十億元的經濟損失,是當前養禽業發展的大敵,如何有效治療家禽腫瘤和病毒感染性疾病一直是困擾禽病防治的重大難題之一(蔡梅紅等,2007)。 對于獸用抗病毒生物制品來說,與傳統的化學藥物和疫苗相比,干擾素(IFN)作為免疫應答的自然介導物和調節物之一,具有廣譜的抗病毒活性,在臨床上具有良好的應用前景(Galligan 等,2006)。尤其是雞a干擾素是一種抗病毒性較強的生物制品,具有作用廣泛、殘留小、幾乎無毒性等特點,為這些疾病的防治提供了新的手段(Platanias 等,2005)。
目前國內對于雞a 干擾素的研究多數處于實驗室階段及小試水平, 對于其下游大規模高密度發酵技術研究缺乏, 其生產還存在著生產成本過高、表達效價低、工藝控制復雜、生產穩定性差、養殖業對其用量大等問題,難以實現規模化生產(岳道友等,2010)。
本課題組前期構建了含有雞α 干擾素優化基因的真核表達載體pPIC9k,并將其5'端非翻譯區(5'UTR)序列進行改造,去除多余的8 個堿基序列,使其與畢赤酵母AOX1(醇氧化酶)的mRNA 序列完全一致, 并初步研究了改造載體在畢赤酵母SMD1168 中的表達和抗病毒活性,在搖瓶水平其抗病毒活性達到1.5×106U/mL。 本研究在此基礎上,在500 L 中試水平,通過研究pH、裝液量、溶氧、誘導條件等因素對畢赤酵母工程菌發酵產雞α 干擾素的影響,優化一套成熟的產雞α 干擾素的畢赤酵母高密度發酵工藝,為雞α 干擾素的放大生產奠定基礎。
1 材料與方法
1.1 供試菌 雞α 干擾素重組畢赤酵母菌SMD1168-pPIC9k-cIFN-α,由廣東省微生物種質資源庫保存并提供。
1.2 主要試劑及培養基 種子培養基: 葡萄糖20 g/L,酵母抽提物10 g/L,胰蛋白胨20 g/L,pH=7.0,固體培養基加2%的瓊脂粉。 發酵培養基:甘油46 g/L,磷酸二氫銨14 g/L,硫酸鉀18 g/L,硫酸鎂15 g/L,硫酸鈣1.5 g/L,磷酸二氫鉀5 g/L,氫氧 化 鉀1.5 g/L,PTM 鹽4.4 mL/L, 初 始pH 為6.96。
酵母抽提物;胰蛋白胨(英國Oxoid 公司);瓊脂粉(廣州環凱生物科技有限公司);其他試劑均為國產分析純。
1.3 主要儀器設備 生化培養箱: 上海一恒科學儀器有限公司;DHZ-DA 大容量全溫振蕩器:太倉市實驗設備廠;5427R 高速冷凍離心機:eppendorf;50、500 L 不銹鋼發酵罐:上海洋格生物設備有限公司。
1.4 菌株培養方法 將斜面保存的畢赤酵母菌株接種于種子培養基中,于30 ℃、150 r/min 培養24 h, 然后以5%的接種量接種于50 L 發酵罐中進行擴大培養,培養溫度為30 ℃,通風量1000 ~2500 L/h,罐壓0.06 MPa,攪拌轉速200 ~350 r/min,培養至30 h,OD600達到35 以上后,以10%的接種量過種至500 L 發酵罐中, 培養溫度為30 ℃,通氣攪拌培養,溶氧控制在30%以上(通過調節風量和轉速控制),罐壓0.06 MPa,當初始碳源耗盡時,開始流加甘油,當菌體量積累到一定程度時,開始脈沖流加誘導劑進行誘導表達, 發酵過程分別取樣在線監測各種生理指標。
1.5 指標測定
1.5.1 菌體生物量測定 根據發酵液活菌數的對數值和菌體濕重成一定的線性關系原理, 通過測其濕重指標來間接反映菌體的生長情況。 測定方法如下:取適量發酵液,離心洗滌兩次,測定單位體積發酵液的菌體重量即為菌體濕重(g/L)。
1.5.2 pH 測定 用PHS-25 數顯酸度計測定。
1.5.3 甘油濃度測定 采用HPLC,島津LC-20A液相色譜儀,氨基柱;流動相:5 mmol/L 硫酸,流速:0.6 mL/min ;柱溫:30 ℃;進樣量:20 μL;檢測器:示差折光檢測器;采用外標法定量。
1.5.4 甲醇濃度測定 采用HPLC,島津LC-20A液相色譜儀,氨基柱;流動相:5 mmol/L 硫酸,流速:0.6 mL/min ;柱溫:65 ℃;進樣量:20 μL ;檢測器:示差折光檢測器;采用外標法定量。
1.5.5 雞α 干擾素抗病毒活性的測定 參考蔡梅紅等(2010)的方法,采用細胞病變抑制法進行測定。
2 結果與分析
2.1 pH 對畢赤酵母高密度培養表達雞α 干擾素的影響 在50 L 罐發酵水平,用氨水和磷酸維持發酵過程不同的pH,在優化培養基中,菌體增殖溫度為30 ℃,誘導溫度為28 ℃,裝液量為60%,通風量1000 ~2500 L/h, 罐壓0.06 MPa, 攪拌200 ~350 r/min,接種量為10%。 培養過程中隨著菌株的生長,培養基中的碳源逐漸消耗,當碳源消耗完后菌體不再生長,溶氧開始上升,根據溶氧恒速流加甲醇進行誘導60 h 后放罐,結果如圖1。
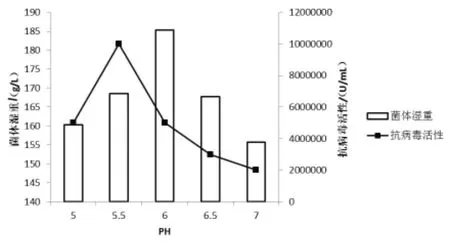
圖1 pH 對畢赤酵母高密度培養表達雞α 干擾素的影響
圖1 顯示,維持pH 5.5 條件下,發酵48 h,細胞濕重達到168.6 g/L,產物雞α 干擾素(IFN-α)抗病毒活性達到1×107U/mL。雖在pH 6.0 條件下獲得的細胞濕重與pH 5.5 相比更高,但產物抗病毒活性相對較低,所以選擇維持pH 5.5 進行后續試驗。
2.2 裝液量對畢赤酵母高密度培養表達雞α 干擾素的影響 鑒于裝液量對于工程菌發酵的重要性(影響營養物及氧氣的傳遞性能),考察了50 L發酵罐中不同裝液量 (80%、70%、60%、50% 和40%)對菌體合成及雞α 干擾素表達的影響,其他條件不變。 結果表明(圖2),隨著裝液量的增加菌體合成量大致呈下降趨勢。而在裝液量為50% 條件下,獲得較大菌體量,并且產物獲得了最高的抗病毒活性(1.5×107U/mL)。 在40% 裝液量條件下的發酵液經鏡檢發現大量細胞碎片的存在, 推測原因可能是在相同攪拌功率條件下, 隨著裝液量的減少,單位體積功率系數(P/V)將增大,從而對菌體細胞產生較大的剪切力,造成細胞破碎(姜正軍等,2014)。因此選擇裝液量為50%進行后續試驗。
2.3 溶氧量(DO)對畢赤酵母高密度培養表達雞α 干擾素的影響 用50 L 發酵罐進行多批次的溶氧試驗, 通過調整轉速和通風量的大小并通入合適濃度的純氧來控制溶氧DO 值的高低, 使溶氧分別控制在10% ~20%、20% ~30%、30% ~40%、40% ~50%,其他條件不變,根據溶氧恒速流加甲醇進行誘導60 h 后放罐,測定干擾素活力確定最佳溶氧量,結果見圖3。

圖2 裝液量對畢赤酵母高密度培養表達雞α 干擾素的影響
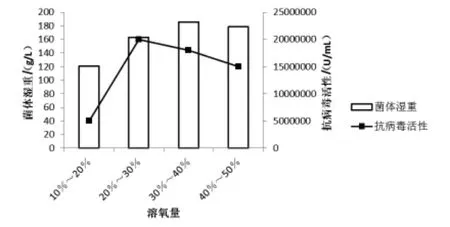
圖3 溶氧量對畢赤酵母高密度培養表達雞α 干擾素的影響
從圖3 可看出,隨著溶氧量的上升,菌體的生物量和表達蛋白的抗病毒活性都有不同程度的提高,但過高的溶氧量反而會抑制菌體生長和蛋白質表達。當發酵罐DO 值控制在30% ~40%時,菌體生物量最高,為185.4 g/L;當發酵罐DO值控制在20% ~30%時,干擾素的抗病毒活性最高,為2×107U/mL,因此選擇誘導表達的DO 值為20% ~30%, 在菌體增殖階段可適當提高溶氧量為30% ~40%。
2.4 誘導前菌體濃度對畢赤酵母高密度培養表達雞α 干擾素的影響 初始培養基中碳源耗盡后,菌體不再生長,溶氧量開始上升,此時開始流加碳源甘油。 通過控制流加甘油速度和時間不斷提高菌體濃度, 使誘導前菌體濃度分別達到250、300、350、400、450 g/L, 其他條件不變, 根據溶氧恒速流加甲醇進行誘導60 h 后放罐,通過測定表達上清抗病毒活性確定最佳誘導前菌體濃度,結果見圖4。
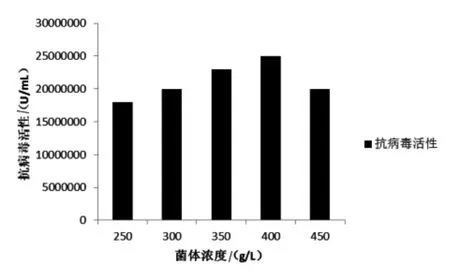
圖4 誘導前菌體濃度對畢赤酵母高密度培養表達雞α 干擾素的影響
在一定范圍內, 畢赤酵母菌體濃度的提高有利于提高蛋白的表達量和活性,圖4 顯示,當誘導前菌體濃度為400 g/L 時, 誘導發酵60 h 后,干擾素的抗病毒活性最高,達到2.5×107U/mL,過高的誘導前菌體濃度一定程度上抑制了干擾素蛋白的表達, 可能跟溶氧或是營養物質的傳遞不足有關。 因此,選擇誘導前菌體濃度為400 g/L 為宜。
2.5 誘導劑添加模式對畢赤酵母高密度培養表達雞α 干擾素的影響
2.5.1 誘導劑配方的選擇 在初始碳源耗盡后,通過連續流加甘油使其菌體濃度達到400 g/L,其余發酵條件不變, 根據溶氧恒速流加如下不同配方的誘導劑:(1)50%質量濃度的甘油:甲醇=1:4;(2)50%質量濃度的山梨醇:甲醇=1:4;(3)分析純甲醇。 誘導發酵60 h 后,測定發酵上清的抗病毒活性。
從表1 可看出,用甲醇和甘油混合誘導,菌體濃度較高, 分泌干擾素抗病毒效價高于只用甲醇誘導;用甲醇和山梨醇混合誘導,菌體濃度略低于甲醇和甘油混合誘導組, 分泌干擾素抗病毒活性高于甲醇和甘油混合誘導組, 說明山梨醇可以明顯提高畢赤酵母分泌蛋白的活性。 因此選擇甲醇和山梨醇混合作為誘導劑。

表1 不同誘導劑對干擾素活性的影響
2.5.2 誘導劑添加模式的選擇 畢赤酵母工業化大規模發酵時, 誘導劑補料方式基本分為分批式補料、連續式補料等,據此確定以下3 種誘導劑添加方案進行誘導表達(張曉龍等,2015):(1)分批式補料,每次補入0.4%誘導劑,待甲醇消耗完后繼續補料;(2)分批-連續式補料,誘導初期加入0.4%誘導劑,甲醇消耗完后, 繼續補加0.4%誘導劑,5 h 后控制流速為5 ~6 mL/(L·h);(3)連續式補料, 誘導初期補料速度為1 mL/(L·h), 每小時提升一個單位,5 h 后控制流加速度為5 ~6 mL/(L·h)。 誘導過程中每6 h 取樣測定發酵上清的抗病毒活性,結果見圖5。
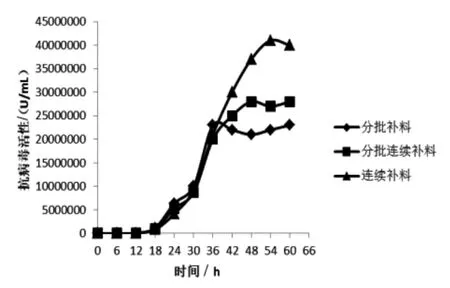
圖5 不同誘導劑添加方式對干擾素活性的影響
從圖5 可看出,采用連續補料的方式可以使畢赤酵母更好地適應甲醇,延長最佳表達周期,干擾素最高抗病毒活性可達到4.0×107U/mL;而采用分批補料的方式, 受甲醇初始濃度過高影響, 畢赤酵母前期未能適應碳源變化, 導致36 h 后外源蛋白停止表達,誘導期明顯縮短;采用分批連續補料的方式,有助于蛋白表達,但前期變換碳源過渡不佳, 導致發酵后期干擾素效價不高, 因此采用連續補料的方式進行雞α 干擾素誘導表達。
2.6 50 L 發酵工藝的確定 通過研究接種量、溫度、初始pH、裝液量、過程pH 控制、溶氧等因素對工程菌發酵產雞α 干擾素的影響,初步得出最佳發酵工藝為接種量10%,裝液量50%,菌體增殖階段:控制pH 為6.0,發酵溫度為30 ℃,溶氧為30% ~40%, 當初始培養基中碳源耗盡后,菌體不再生長,溶氧量開始上升,此時開始流加碳源甘油,使誘導前菌體濃度為400 g/L;誘導表達階段: 控制pH 為5.5, 發酵溫度為28 ℃, 溶氧為20% ~30%,用50%質量濃度的山梨醇:甲醇=1:4的誘導劑,采取連續補料方式,誘導初期補料速度為1 mL/(L·h), 每小時提升一個單位,5 h 后控制流加速度為5 ~6 mL/(L·h), 此過程根據溶氧控制流速,發酵60 h 結束。
在最優發酵工藝下,進行50 L 發酵罐水平畢赤酵母發酵表達雞α 干擾素驗證試驗,重復5 批次,結果顯示(表2),畢赤酵母在50 L 發酵水平進行高密度發酵表達雞α 干擾素,發酵過程各項參數重現性較好,表達的蛋白活性穩定,具有工業化生產價值。2.7 500 L 發酵工藝的確定 在50 L 發酵工藝的基礎之上, 對畢赤酵母工程菌株進行了500 L罐發酵擴大生產, 主要考察發酵工藝的穩定性和驗證擴大培養后干擾素的抗病毒活性, 試驗重復5 批。結果顯示(表3),在最優發酵工藝下,畢赤酵母在500 L 發酵罐水平,當發酵24 h,初始碳源耗盡時,菌體濕重為178.9 g/L,此時開始補加甘油,甘油初始流速為3 mL/(L·h), 每小時提升1.5 單位,5 h 后控制流加速度為10 ~12 mL /(L·h),發酵時間42 h 時,菌體濕重為412.3 g/L,此時開始補加誘導劑,干擾素效價開始增加,到發酵96 h時達到最高,為4.5×107U/mL,之后略有下降,菌體濕重有少量增加,之后保持相對穩定的狀態,因此發酵時間應控制在誘導表達60 h 后放罐。 與50 L 罐上的各項發酵過程參數相比,500 L 罐發酵過程各項目標參數變化趨勢與50 L 較一致,結果重現性較好,生產過程各項參數較為穩定,且目的蛋白表達量略高于50 L 罐,分泌的雞α 干擾素的抗病毒活性最高為4.8×107U/mL, 可進行穩定的工業化生產。
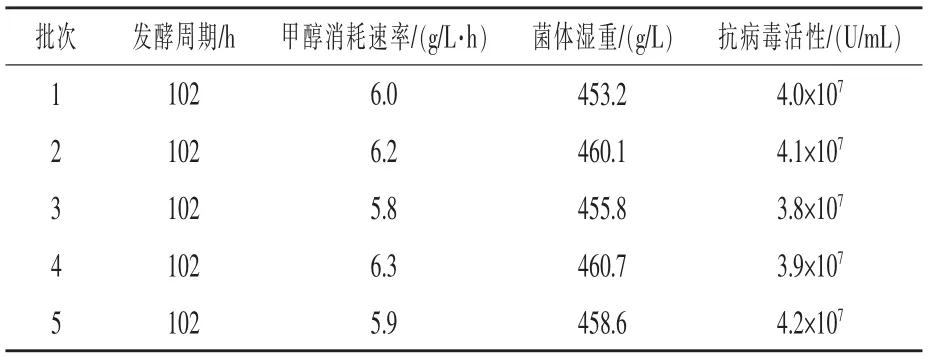
表2 50 L 發酵畢赤酵母高密度培養表達雞α 干擾素過程穩定性
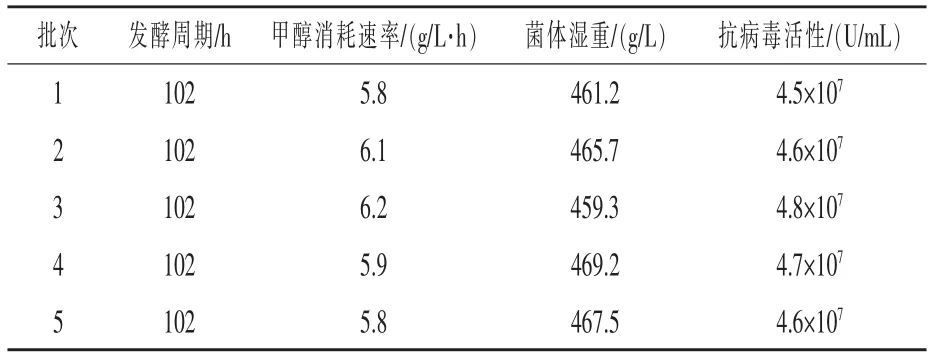
表3 500 L 發酵畢赤酵母高密度培養表達雞α 干擾素過程穩定性
3 結論與討論
影響畢赤酵母高密度發酵表達外源蛋白的因素很多,本研究在前期試驗的基礎上,選取了中試放大過程中幾個關鍵因素進行優化。 畢赤酵母高密度發酵需要大量的溶氧, 充足的氧氣對誘導階段外源蛋白的表達極為重要(閔兆升等,2014)。有報道認為,如果采用大型發酵罐進行培養,外源蛋白的表達水平要比普通搖瓶高出10 ~100 倍(Withers 等,1999)。若溶氧不足,不僅會限制菌體生長, 發酵過程中還會產生甲醛和過氧化氫等有毒代謝產物,產生生物安全問題;若氧氣過量同樣會抑制菌體產生目標蛋白。 本研究采用按一定比例通入純氧和空氣的方式來保證足夠的溶氧,控制DO 值在合適的水平。
另外, 誘導前菌體濃度對異源蛋白的表達也有影響。畢赤酵母中蛋白質表達分為兩個階段,首先是在含有甘油的培養基中生長菌體, 達到一定的菌體濃度,理論上是菌體越多,培養基中氧和營養供給越受限制。 事實上高密度不一定有利于外源蛋白的產生,這跟表達的外源蛋白的性質,如溶解性、穩定性、毒性等以及發酵罐能提供的最大供氧量相關(Besse 等,1997)。本試驗發現,在菌體濕重低于400 g/L 時,外源蛋白較難降解,能有較高水平的表達量。
以甲醇作為誘導劑不但可以誘導AOX 啟動子驅動外源蛋白的表達, 也可以作為碳源維持表達過程的能量消耗。研究表明,甲醇還可以與山梨醇和甘油混合補料誘導表達, 一方面可增加碳源和能量供給,利于菌株生長和蛋白質表達;另一方面可降低產熱和耗氧速率, 從而提高蛋白質表達(林俊涵,2009)。但甘油對AOX1 啟動子有阻遏作用,采用山梨醇和甲醇作為誘導劑,可減弱這種抑制作用, 還能夠減緩目的蛋白的胞外降解及降低毒副產物的積累, 同時產熱值更低 (Calik 等,2009)。 研究表明,山梨醇和甲醇混合流加的策略不但可以增加細胞密度、縮短誘導時間,還能夠提高外源蛋白的表達量(武婕等,2016),這也與本研究的結果一致。
本研究通過觀察pH、裝液量、溶氧、誘導條件等因素對工程菌發酵產雞α 干擾素的影響,得出一套畢赤酵母高密度中試擴大發酵工藝,用此工藝條件可實現500 L 規模發酵生產雞α干擾素,并且工藝穩定,雞α 干擾素的抗病毒活性可達到4.5×107U/mL 以上, 優化發酵工藝跟初始發酵工藝相比,生產成本降低55%,發酵效價提高了3.5 倍, 并且培養基組分成本較低,適合規模化生產。 本研究將改變雞α 干擾素難以規模化生產的現狀,大幅度降低生產成本,在同類產品中的市場競爭力將大大提高, 同時可以解決禽畜疫病防治過程中的抗生素濫用和疫苗滴度低的問題, 提高我國禽類養殖業的健康水平。

