超高效液相色譜-四極桿-飛行時間質譜法定性分析奧利司他氫化液中的雜質
王 軍,李鐵健,曲喜龍,吳桂梅,張貴民*
(1.魯南制藥集團股份有限公司,山東 臨沂 276005;2.山東新時代藥業有限公司 國家手性制藥工程技術研究中心,山東 臨沂 273400)
奧利司他是全球唯一的非處方類減肥藥,目前有超過四千萬人使用并成功減肥[1]。該藥由瑞士Hoffmann-La Roche公司研發,1998年在新西蘭首次上市,1999年獲準在歐美國家上市,2001年獲準在中國上市。奧利司他為胃腸道脂肪酶抑制劑[2],通過減少脂肪吸收而達到減肥目的。
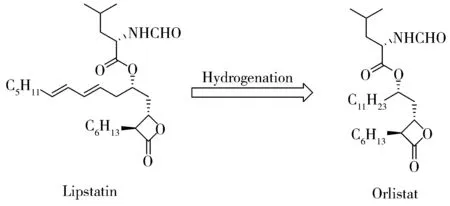
圖1 氫化反應過程Fig.1 Reaction formula of hydrogenation
奧利司他的療效得到了一致認可[2-5],但有一些不良反應逐漸被報道[6],從而促進對該藥物雜質的研究更加深入。目前對奧利司他的雜質研究主要在制劑方面,分析方法包括高效液相色譜(HPLC)法[7-10]、高效液相色譜-串聯質譜(HPLC-MS/MS)法[1,11-12],在原料檢測與生物代謝方面亦有研究[13-15],但對奧利司他氫化液的雜質研究尚未見報道。奧利司他氫化液由利普司他汀發酵液氫化而得,其反應過程見圖1。本文首次對奧利司他氫化液的雜質進行研究,利用超高效液相色譜-四極桿-飛行時間質譜法(UPLC-Q-TOF-MS)對其中的雜質進行了定性分析,可為下一步工藝純化與質量研究提供依據。
1 實驗部分
1.1 儀器、試劑與材料
1290 Infinity Ⅱ型超高效液相色譜儀、6540B四極桿-飛行時間質譜儀(美國Agilent公司),配有電噴霧離子源(ESI)以及MassHunter B.06.00數據處理系統。
奧利司他氫化液(山東新時代藥業有限公司,批號:19020100);乙腈(色譜純,Merck公司);乙酸(色譜純,Fluka公司);實驗用水為自制超純水。
1.2 色譜與質譜條件
色譜條件:色譜柱為Thermo Hypersil gold aq C18柱(2.1 mm×150 mm,1.9 μm);流動相為0.1%乙酸水-0.1%乙酸乙腈(25∶75);柱溫為40 ℃;流速為0.3 mL/min;進樣量為5 μL。
質譜條件:ESI源,正離子模式;掃描范圍m/z50~600;霧化氣溫度為300 ℃;毛細管電壓為4 kV,干燥氣流速為10 L/min;裂解電壓為60 V;錐孔電壓為45 V。
1.3 溶液配制
取奧利司他氫化液1 mL,置于10 mL容量瓶中,用流動相稀釋定容,取適量過0.22 μm濾膜,濾液作為供試品溶液。
1.4 實驗過程
將“1.3”的供試品溶液進樣,按照“1.2”條件進行分析,獲得各成分的精確分子量與二級質譜碎片信息。
2 結果與討論
2.1 UPLC-Q-TOF-MS方法的優化
美國藥典中檢測奧利司他原料藥的HPLC流動相為磷酸水與乙腈[16],但由于磷酸難揮發,故無法直接進入質譜進行樣品分析,而乙酸可在質譜離子源內揮發,因此本實驗分別向水與乙腈中添加0.1%乙酸作為流動相。進一步優化洗脫比例后發現,當0.1%乙酸水-0.1%乙酸乙腈的比例為25∶75時,總離子流圖(TIC)中各雜質在35 min內可有效分離,且具有較好的質譜響應,有利于下一步雜質的定性分析。
目前UPLC-MS儀常用的離子源主要包括ESI源與大氣壓化學電離源(APCI)兩種類型。ESI源的原理為液滴在運行中,溶劑不斷快速蒸發,液滴逐漸變小,表面電荷密度不斷增大,當電荷排斥的靜電力超過液滴表面張力,即引起庫侖爆炸,使帶電液滴排出溶劑和樣品離子;APCI源的原理為樣品溶液在電暈針作用下先帶電,再將電荷轉移給化合物形成離子[17]。因此ESI源適合分析極性與中等極性的樣品,而APCI源適合分析弱極性的樣品。結合上述離子源性質與奧利司他結構特點,并參考文獻報道[1,11],本研究最終采用ESI源,在正離子模式下進行樣品分析。
奧利司他的分子量小于500 Da,由于其雜質結構與奧利司他結構相似,因此最終選定質譜采集范圍為m/z50~600。獲得雜質的一級質譜圖后,分別對各母離子優化碰撞能量,在碰撞池內進行碰撞誘導解離(CID),最終獲得各雜質的二級質譜碎片離子,并據此對各雜質的可能結構進行推導。

圖2 供試品溶液的TIC圖Fig.2 TIC spectrum of sample solution

圖3 奧利司他的二級質譜圖Fig.3 MS/MS spectrum of orlistat
2.2 供試品溶液的總離子流圖
供試品溶液的TIC見圖2,對其中較大的雜質依次編號1~16。采集TIC圖時,將2.5 min前的蛋白類與無機鹽類雜質切入廢液管路,可有效防止污染質譜。雜質6與雜質7雖未能實現基線分離,但在質譜中不影響雜質的定性分析。
2.3 奧利司他的質譜信息
主成分奧利司他的二級質譜圖見圖3,母離子峰m/z496.400 8為[M+H]+峰。其裂解途徑如圖4所示:奧利司他在質譜中由C—O鍵斷裂,碎裂為Ⅰ與Ⅱ部分。其中Ⅰ部分通過ⅰ途徑裂解,生成碎片離子m/z160.096 8,該離子通過脫水生成m/z142.086 3,再脫去羰基,生成碎片離子m/z114.091 5。Ⅱ部分通過ⅱ途徑裂解成碎片離子m/z337.311 3,該離子可通過脫去C10H21基團后繼續脫氫生成m/z193.195 4;碎片離子m/z337.311 3還可脫水生成m/z319.300 6,再進一步脫水生成m/z301.289 7,這與文獻報道的斷裂機理基本一致[1]。Ⅰ與Ⅱ部分的特征碎片離子對雜質結構解析具有重要意義。
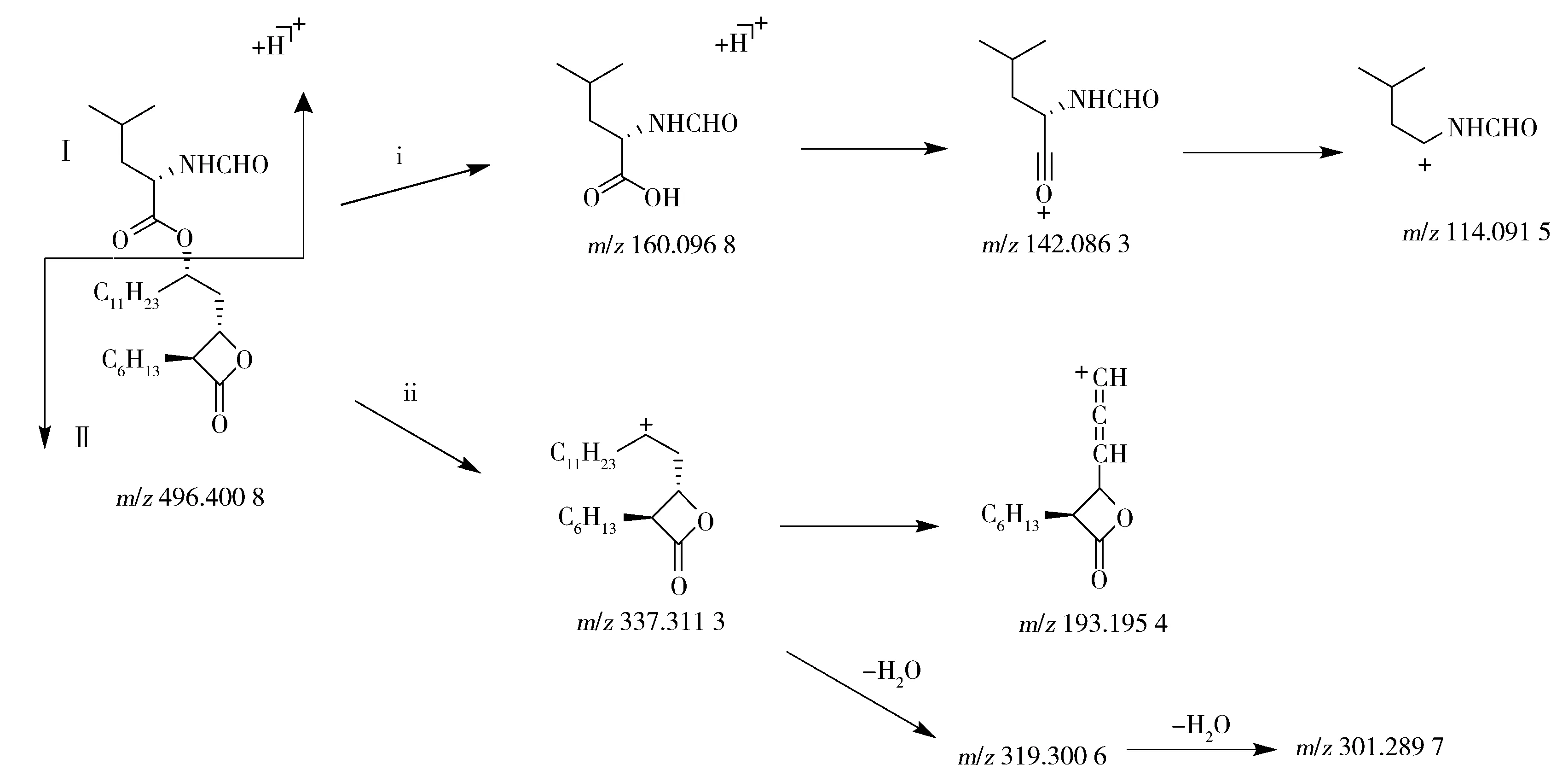
圖4 奧利司他的裂解途徑Fig.4 Fragmentation pathway of orlistat
2.4 雜質結構解析
2.4.1 雜質的質譜信息經UPLC-Q-TOF-MS分析后,獲得16個雜質的精確分子量與二級質譜碎片,具體質譜信息見表1。通過精確分子量,利用MassHunter軟件計算出分子式,各精確分子量與理論值的誤差均小于1×10-5;根據二級質譜碎片可對雜質結構進行解析。

表1 奧利司他氫化液中雜質的質譜信息Table 1 MS information of impurities in orlistat hydrogenation solution
(續表1)

No.Parent ion(m/z)Molecular formulaCollision energy(eV)Fragment ions(m/z)Chemical structure9468.369 1[M+H]+C27H49NO58309.279 1,291.268 7,273.256 9,193.195 2,160.096 6,142.086 1,114.091 410513.426 9[M+NH4]+C29H53NO510496.400 2,337.310 6,319.300 1,193.195 2,160.096 7,142.086 2,114.091 311482.385 1[M+H]+C28H51NO59337.311 1,319.300 2,301.289 5,193.195 1,146.081 1,128.070 7,100.076 112530.384 1[M+H]+C32H51NO512337.310 1,319.300 1,301.288 6,211.205 4,194.081 2,193.195 1,176.070 3,166.085 9,148.075 413513.426 1[M+NH4]+C29H53NO510496.400 5,337.310 6,319.300 3,193.195 2,160.096 8,142.086 2,114.091 4Isomeric with impurity 1014510.415 7[M+H]+C30H55NO510351.326 1,333.315 7,193.194 9,160.096 7,142.088 3,114.091 315524.430 6[M+H]+C31H57NO512365.341 9,347.331 1,193.195 3,160.096 7,142.086 2,114.091 316524.431 6[M+H]+C31H57NO512365.342 1,347.331 5,193.195 1,160.096 9,142.086 4,114.091 5Isomeric with impurity 15
2.4.2 雜質結構推導結合表1中的雜質信息對其結構推導如下。
雜質1的母離子m/z542.404 9為[M+H]+峰,雜質2的母離子m/z542.406 1為[M+H]+峰,經軟件計算分子式均為C30H55NO7,二者互為同分異構體,均比奧利司他多1個CH2與2個O原子。由于雜質1的Ⅰ部分特征碎片離子均保留,說明該部分的裂解機理與奧利司他ⅰ途徑一致;Ⅱ部分通過ⅱ途徑生成碎片離子m/z383.316 5后,該離子脫去C10H21O2基團后脫氫生成m/z207.174 1,繼續脫水生成m/z189.168 5;碎片離子m/z383.316 5還可脫水生成m/z365.305 5,繼續脫甲基后生成m/z351.290 2,進一步脫水生成m/z333.279 3。由于Ⅱ部分的特征碎片離子m/z337.311 3消失,m/z383.316 5存在,因而可判定在Ⅱ部分上引入了1個CH2與2個O原子;而且Ⅱ部分的特征碎片離子m/z193.195 4消失,m/z207.174 1仍存在,因此可判斷在C6H13基團上引入了1個CH2,即成為C7H15;而2個O原子則可能連接在C11H23鏈上;2個O原子的位置不同導致了2個異構體的產生。另外,雜質1還可通過途徑ⅲ發生脫水反應生成碎片m/z524.395 1。其具體斷裂途徑如圖5所示。通過雜質2的碎片離子可知,雜質2的裂解途徑與雜質1一致。
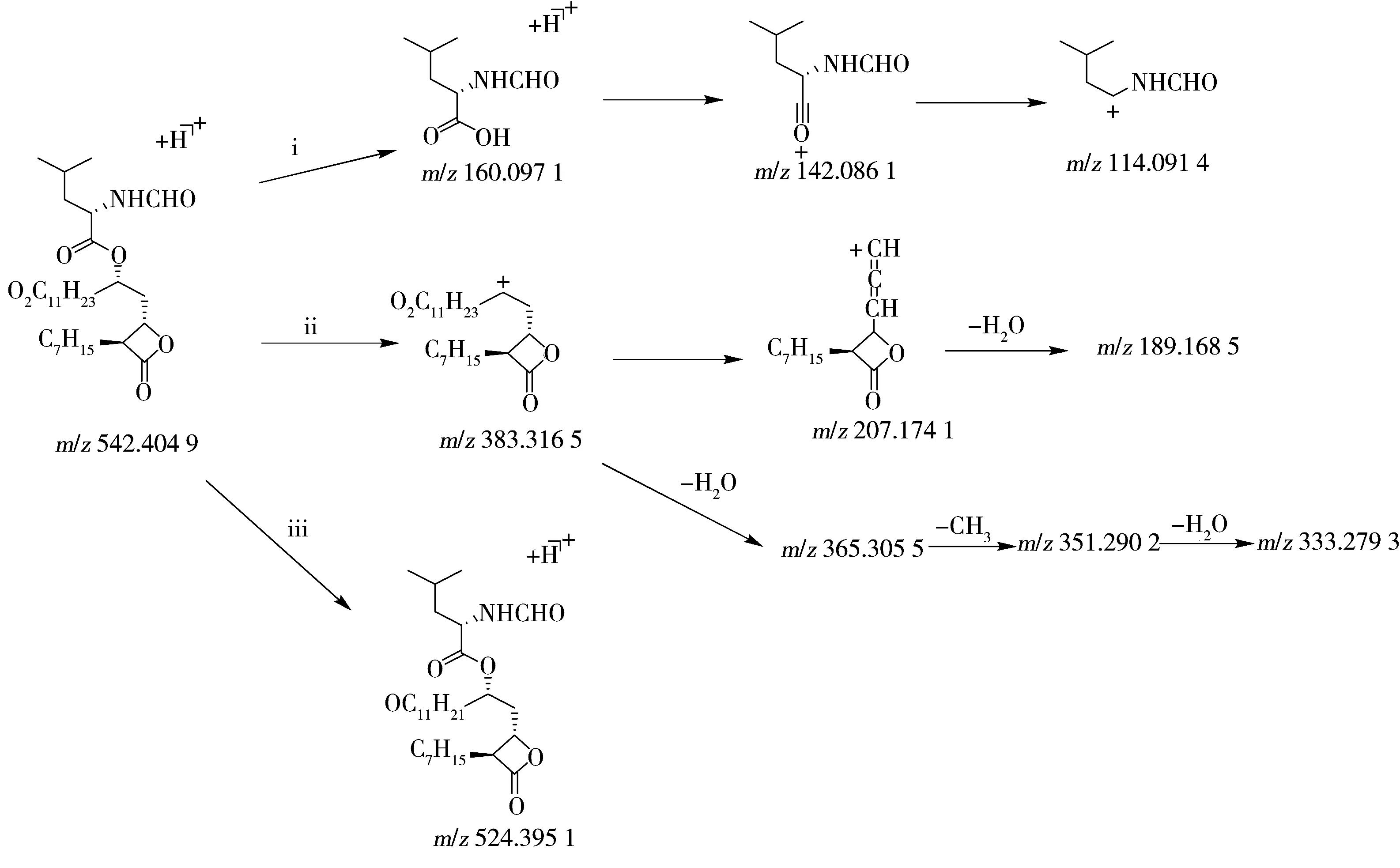
圖5 雜質1的可能裂解途徑Fig.5 Fragmentation pathway of impurity 1
雜質3的母離子m/z512.395 4為[M+H]+峰,雜質7的母離子m/z512.396 9為[M+H]+峰,經軟件計算分子式均為C29H53NO6,二者互為同分異構體。由于雜質3中存在碎片離子峰m/z494.384 6,說明發生了脫水反應,結合分子式可判斷這兩個雜質比奧利司他多1個OH。由于Ⅰ部分的特征碎片離子保留,說明該部分的裂解機理與奧利司他的ⅰ途徑一致;Ⅱ部分通過ⅱ途徑生成碎片離子m/z353.306 1后,該離子脫去C10H21基團后脫氫生成碎片m/z209.189 9,再失去1分子水,生成m/z191.179 5;碎片離子m/z353.306 1還可脫水生成m/z335.295 2,進一步脫水生成m/z317.284 4。由于Ⅱ部分的特征碎片離子m/z193.195 4消失,且存在m/z209.189 9碎片,可以判定在C6H13上引入了OH;由于OH位置不同形成了2個異構體。另外,雜質3還可通過途徑ⅲ發生脫水反應,生成碎片離子m/z494.384 6。雜質3的可能裂解途徑如圖6,通過雜質7的碎片可知,其裂解途徑與雜質3一致。
其余雜質的裂解機理與上述雜質裂解機理類似。最終雜質結構匯總見表1。
2.5 討 論
2.5.1 雜質來源推測本工藝為毒三素鏈霉菌發酵過程中生物合成利普司他汀,再將利普司他汀還原獲得奧利司他。利普司他汀的生物合成機理[18]如圖7所示:化合物1(3-羥基十四烷-5,8-二烯酰基-輔酶A)與化合物2(辛酰-輔酶A)通過Claisen縮合反應合成利普司他汀的碳骨架化合物 3,化合物3上的酮基被進一步還原為羥基后生成化合物4,進而縮合為β-內酯環生成化合物5,化合物5再結合L-亮氨酸,最后形成化合物6(利普司他汀)。
上述化合物1由發酵物料油脂中的亞油酸與輔酶A反應生成,而化合物2由油脂中的辛酸與輔酶A反應生成[18]。結合圖7生物合成反應與各個雜質結構,對雜質來源推測如下:雜質4為亞油酸在生物合成過程中被氧化產生;其它含酮基或羥基的雜質(3、6、7)主要為辛酸被氧化產生的雜質;雜質10與13為奧利司他的異構體,判斷為發酵過程中生成了利普司他汀的同分異構體,在下一步的還原加氫反應后,生成了奧利司他的同分異構體;雜質5為甲硫氨酸替代L-亮氨酸參與了生物合成過程,且硫原子被氧化后生成;而雜質11為纈氨酸替代L-亮氨酸參與生物合成過程生成;雜質12為苯丙氨酸替代L-亮氨酸參與發酵過程后形成;甲硫氨酸、纈氨酸、苯丙氨酸均來源于發酵過程中的原料。其余雜質均為利普司他汀碳鏈引入或減少了(CH2)n所致,初步判斷為亞油酸與辛酸的同系物參與了生物合成過程,從而帶入到下一步的還原過程中。
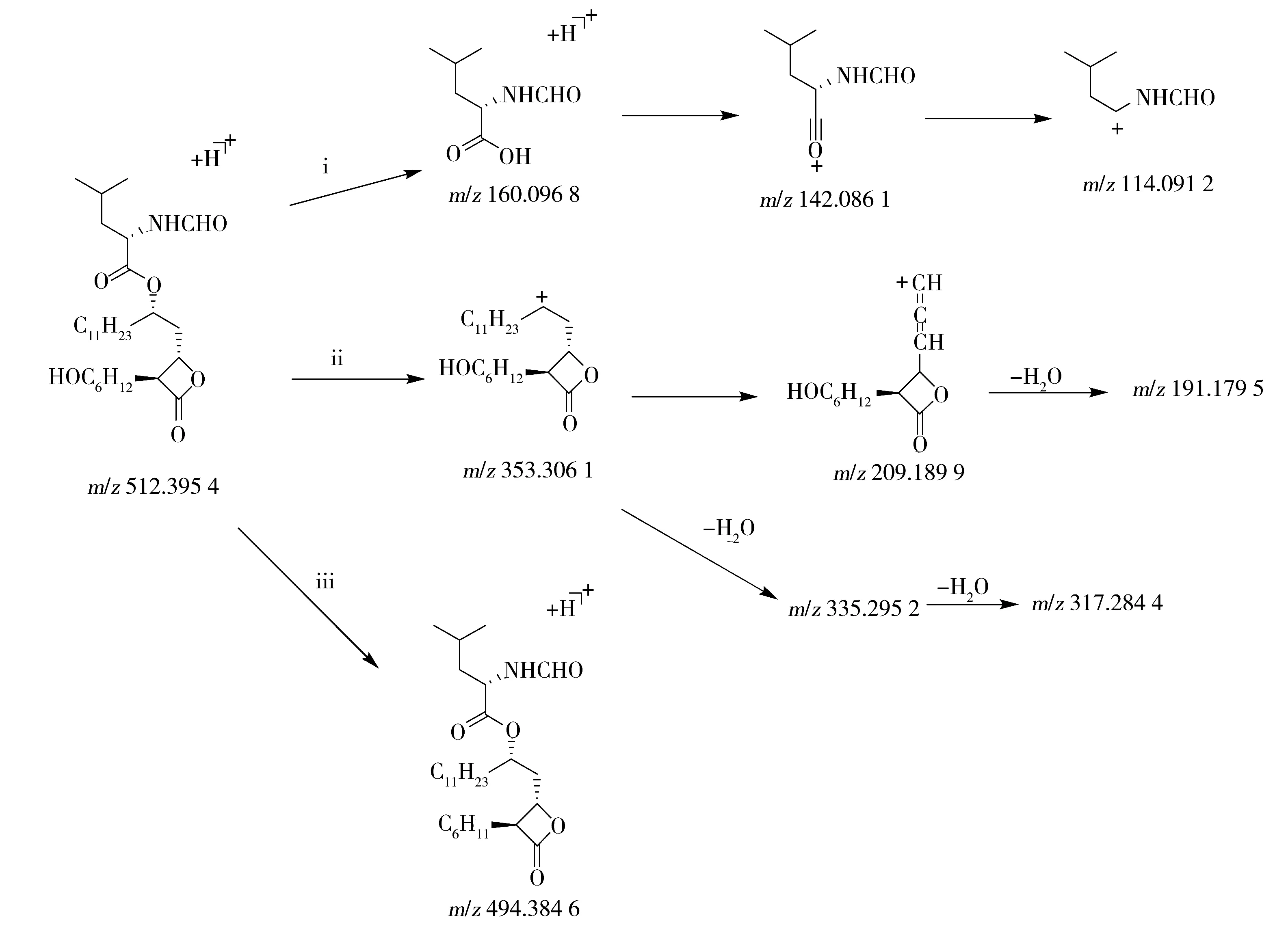
圖6 雜質3的可能裂解途徑Fig.6 Fragmentation pathway of impurity 3
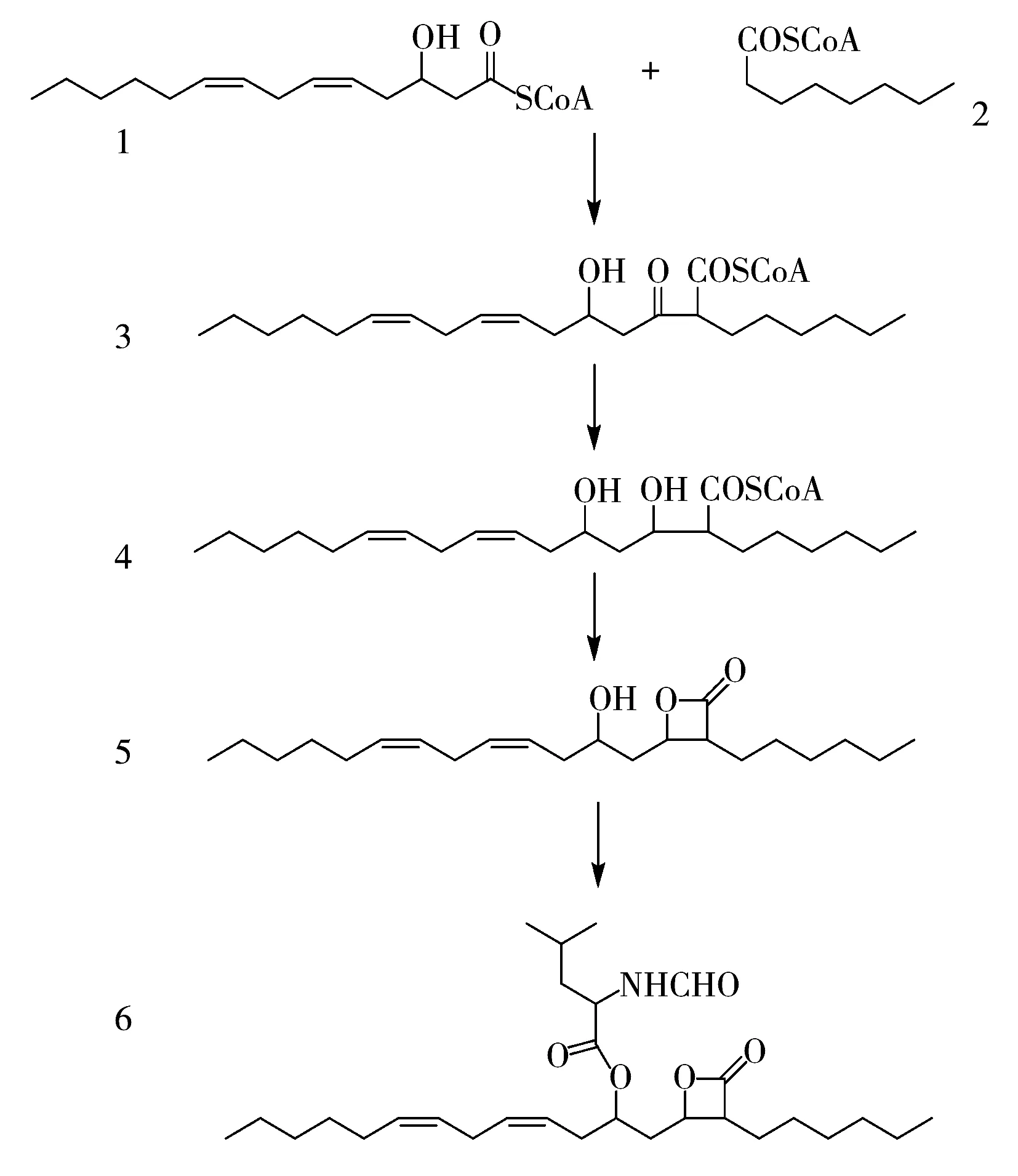
圖7 利普司他汀的生物合成途徑[18]Fig.7 Proposed mechanism of lipstatin biosynthesis[18]
2.5.2 分離與純化奧利司他氫化液圖譜經面積歸一化后,該16個雜質的含量均占0.1%以上,最高值接近于1%。由于美國、歐盟的藥品注冊管理部門對藥品純度與雜質鑒定有嚴格要求,尤其是超過0.1%的未知單一雜質,要求提供分子結構或鑒定分析資料[19],且雜質影響奧利司他的用藥安全性[20],因此必須對奧利司他進行純化。目前奧利司他的分離純化主要有兩種方法:①在氫化反應前對利普司他汀進行純化[21-22],主要包括浸提、脫色、結晶、制備高效液相色譜等手段,再對純化后的利普司他汀進行還原反應;②在氫化反應后對奧利司他進行純化,主要包括層析[23]、結晶[24]、制備高效液相色譜[19]等方法。以上方法可將單一雜質含量控制在0.1%以下,達到奧利司他的質量要求。
3 結 論
本文采用UPLC-Q-TOF-MS法首次對奧利司他氫化液中的16個雜質進行了研究,根據質譜裂解規律推導了其結構,由于表1中部分雜質互為異構體,其二級質譜碎片基本一致,故無法對其進行準確定性,需使用核磁等其他手段進一步研究。對16個雜質的來源進行推測,發現主要由發酵過程引入。由于氫化液中雜質較多,且含量均在0.1%以上,因此需對氫化液進行分離純化。本研究可為奧利司他的工藝優化與質量控制提供參考。

