肌內注射骨折合并腦外傷大鼠血清治療單純骨折的放射學及組織形態學觀察
楊博元,馬勇,郭楊,朱亞亮,黃浩,朱愛洪,方瑩
作者單位:1南京中醫藥大學第一臨床醫學院中醫骨傷科,江蘇 南京210023;2常州市金壇區中醫醫院,江蘇 常州213200
骨折是骨科臨床最常見的疾病之一,很多促進骨折愈合的制劑也應運而生,如骨形態蛋白[1]、成骨生長肽[2]等,但在縮短骨折愈合時間方面,一直未能取得突破性進展。大量臨床和實驗發現合并腦外傷的骨折愈合速度明顯加快[3-4],這就為加速骨折愈合提供了一種新思路,腦外傷后是否有大量促骨折愈合因子通過腦屏障進入血液[5],或者顱腦損傷后釋放激素有助于產生大量局部骨骼因素[6],因而加速了骨折愈合。
類比于抗蛇毒血清,骨折合并腦外傷后是否會產生大量“促骨折愈合血清”?是否有可能生產類似于抗蛇毒血清的促骨折愈合血清?本研究起止時間為2017年3月至2018年3月,采用骨折結合創傷性腦損傷大鼠的血清,注入股骨骨折大鼠肌肉,模擬大鼠顱腦損傷后身體的微觀環境,運用放射學及組織形態學方法,觀察骨折愈合過程,為“促骨折愈合血清”應用臨床提供理論依據。
1 材料與方法
1.1 實驗動物及分組 SD大鼠是由南京中醫藥大學動物中心提供的,重量(314±27)g,分籠飼養,實驗室溫度14℃~16℃,實驗過程中自由攝食,自由飲用純凈水。96只大鼠應用隨機數字表進行完全隨機化的分為三組,每組32只,實驗組采用肌內注射治療血清,對照組采用肌內注射陰性對照血清,空白組采用肌內注射生理鹽水。本研究符合一般動物實驗倫理學相關要求。
1.2 主要儀器及試劑 X射線成像系統DR(General Electric Company美國),雙能X線全身骨密度測量儀(MEDILINK法國),HE染色試劑盒(南京凱基生物科技發展有限公司),Image Pro Plus6.0圖像分析系統(Media Cybernetics美國)
1.3 大鼠股骨骨折及骨折合并腦外傷模型的制作
1.3.1 制作大鼠股骨干骨折模型 大鼠股骨骨折模型改良的Einhorn[7]:大鼠腹腔注射麻醉采用2.5%戊巴比妥鈉(60 mg/kg),仰臥姿勢,備皮、消毒、鋪巾,膝關節伸直,在髕骨內側縱切2 cm,依次切開皮膚、脂肪組織,暴露關節囊并切開,往外側推擠髕骨,使之脫位,然后膝關節屈曲90°,直視下采用直徑1 mm克氏針,經股骨髁間凹處進針至股骨大粗隆頂點穿出,大腿肌肉沿著骨膜向上剝離,暴露在股骨的中部。用超薄砂輪切割約1/3的股骨后,股骨沿薄弱部位徒手折斷。用生理鹽水和過氧化氫反復清洗切口。最后,膝關節伸直,髕骨脫位復位,切口逐層縫合。
1.3.2 骨折合并腦外傷模型的制作 參照Marmarou法[8]及自行改良的股骨中段骨折模型,制備骨折合并腦外傷模鼠20只。麻醉妥后,取俯臥位,頭部固定,切口取頭正中,左側頂骨暴露在冠狀縫后面1.5 mm和矢狀縫旁邊2.5 mm處。直徑為5 mm的空心鉆頭用于鉆直徑約為5 mm的圓形骨窗。注意,雙側皮質骨沒有完全穿透。一小部分骨質仍然相連。輕輕翹起用鑷子,取下骨瓣,露出大腦皮層,需輕柔動作操作,對硬腦膜及腦組織不要造成損傷。把直徑4 mm,厚度約2 mm的圓形墊片放置在骨窗處,高30 cm處。用20 g重物沿外周導管垂直下落,直接沖擊墊圈,并進行打擊(沖擊能量為600 g/cm2)導致左側大腦皮層的挫傷和撕裂。出現局部出血和水腫。傷口用雙氧水和生理鹽水反復沖洗,切口要逐層縫合。麻醉清醒后,放回籠中。術后第2天清晨,按照改良的股骨骨折模型行右股骨骨折髓內克氏針固定。
1.3.3 納入及剔除標準 術后2~3 h,大鼠清醒建立腦損傷模型。神經功能缺損評分[9]根據ZeaLonga[9]:沒有任何神經缺損征象為0分;不能完全伸展對側前爪為1分;向對側轉圈為2分;向對側傾倒3分;不能自發行走,意識水平下降為4分。小于1分或死亡的動物剔除;大于等于1分視為顱腦損傷造模成功。
股骨干骨折模型于術后立即進行X線透視,確定克氏針位于髓內,骨折為橫斷或短斜型骨折。剔除長傾斜、粉碎性骨折和死亡動物。可以隨機補充去除標本,最終必須保證分析中包含的動物數量。
1.4 采集標本和指標觀察 手術后第2、第5、第8、第12、第15、第19、第22和第26天,分別取骨折合并腦損傷大鼠4、4、3、3、2、2、1和1只,取腹部主動脈的血,靜置于室溫下2~3 h,離心6 min 4 ℃(1 500 r/min),制備血清并冷藏,供不同時期使用。20只健康大鼠腹主動脈采血,靜置、離心制備陰性對照血清。實驗組在術后第2、5、8、12、15、19、22、26天相應時間點肌內注射治療血清。相應時間點,對照組肌內注射陰性對照血清,空白組肌內注射生理鹽水。
每組術后第1周、2周、3周、4周各處死8只大鼠,采集三組骨折的股骨標本,進行DR攝片,測量骨痂體積;雙能X線全身骨密度測量儀測定骨折端骨密度;HE染色觀察各組骨折端骨組織形態學差異。
1.5 統計學方法 使用SPSS 22.0來分析統計數據,使用的是s。使用完全隨機的設計差異分析進行了多組比較,兩組比較使用SNK測試。P<0.05表示差異有統計學意義。
2 結果
2.1 放射學觀察
2.1.1 骨折端X線對比 術后1周各組均未見明顯骨痂形成,各組骨折線均清晰。術后2周,實驗組骨折線稍微模糊,對照組、空白組骨折線尚清晰。術后3周,對照組、空白組骨折線略模糊,實驗組骨折線進一步模糊。術后4周,對照組、空白組骨折線模糊,實驗組骨折線基本消失。見圖1~3。
2.1.2 骨折端骨痂體積比較 術后2周,三組間骨痂體積比較差異有統計學意義(P<0.05),實驗組骨痂體積明顯大于對照組、空白組。術后3周,三組間骨痂體積對比大致相仿,差異無統計學意義(P>0.05)。術后4周,對照組、空白組骨痂體積明顯大于實驗組(P<0.05)。見表1。
表1 單純股骨干骨折大鼠不同治療方法術后第2、3、4周骨痂體積的比較/(mm3,s)
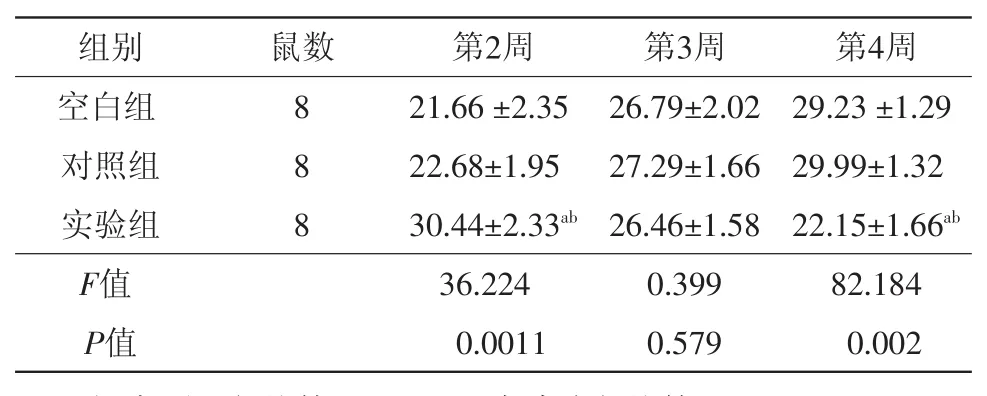
表1 單純股骨干骨折大鼠不同治療方法術后第2、3、4周骨痂體積的比較/(mm3,s)
注:與對照組比較,aP<0.05;與空白組比較,bP<0.05
?
2.1.3 骨折端骨密度比較 術后1周,三組間比較差異無統計學意義(P>0.05)。術后第2、3、4周,同期三組間骨密度差異有統計學意義(P<0.05);在同一時期,實驗組中的骨骼密度比對照組高,差異有統計學意義(P<0.05)。見表2。
表2 單純股骨干骨折大鼠不同治療方法術后第1、2、3、4周骨密度BMD值的比較(mg/cm3, s)
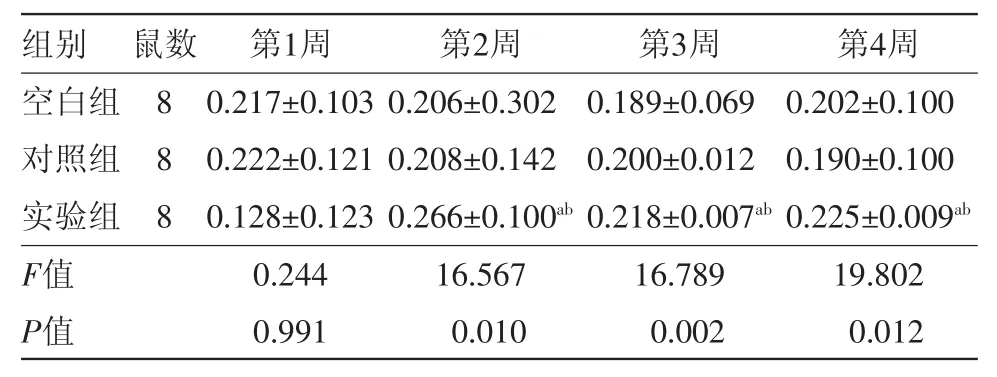
表2 單純股骨干骨折大鼠不同治療方法術后第1、2、3、4周骨密度BMD值的比較(mg/cm3, s)
注:與對照組比較,aP<0.05;與空白組比較,bP<0.05
?
2.2 骨折端組織形態 術后第2周,實驗組形成軟骨骨痂和鈣化組織,骨小梁排列不規則。同時,對照組和空白組愈傷組織生長稀疏,形成典型的小梁結構。軟骨骨痂和肥大軟骨細胞在骨折端大量呈現。手術后3周,實驗組中長了很多堅硬的骨痂,骨小梁增加,排列方法形成了明顯的平板骨結構。對照組,空白組大部分是未成熟的編織骨骼,骨小梁增加,序列逐漸變得越來越規律。
術后4周,實驗組的外骨痂基本上修復為板骨,可以看到一些軟骨存在于外骨痂中。對照組,空白組骨折端編織骨與板層骨融合開始。見圖4~6。
3 討論
1960年Gibson[10]第一次確認了一名骨折病人,其臨床合并顱腦損傷,骨折端有大量骨形成;Kim等[11]其他實驗表明,大鼠股骨骨折的平均愈合時間為4周,顱腦損傷合并后骨折的平均愈合時間縮短為2周。這一現象引起了許多學者的注意。目前,大多數學者認為骨折愈合的加速是一個復雜的過程,涉及多種因素,如骨形態發生蛋白[12]、神經生長因子[13]、胰島素樣生長因子[14]、血小板衍生生長因子[15]、血管內皮生長因子[16]等,其中任何一種因子都不能單獨解釋這一現象,因此對包含眾多因子血清進行研究就顯得尤為重要。本實驗將血清作為一個不可分割的整體,觀察其對骨折愈合的影響,探討其臨床應用的可行性。
本研究進一步證明了在臨床上血清加快治療腦損傷骨折的愈合。X線顯示,實驗組的骨小梁過骨折線的時間較早,骨折線消失的時間早于對照組和空組。實驗組骨痂體積早期的數量迅速增加,隨后迅速減少,這可能是因為實驗組在第2~3周的某個時間點已經處于骨痂塑形期。根據沃爾夫定律,骨細胞吸收大量無效骨痂并縮小其大小,這并不直接反映骨折愈合速度,但間接表明治療性血清可以促進早期骨痂形成、后期骨痂塑形和加快骨折愈合。手術后第1周三組骨痂體積差異無統計學意義(P>0.05),從第2周開始,對照組和空白組的骨密度明顯低于同期實驗組的骨密度,手術后第3、4周,實驗組的外骨痂基本上變成板層骨痂,進入骨痂塑形期,骨痂數量開始減少。然而,對照組和空白組僅發現少量板層骨,大部分仍然是硬骨痂,這表明合并腦損傷可以促進骨痂盡早變成板層骨痂。
在本研究中,血清分幾個階段處理,不同骨折愈合因子在骨折愈合的不同階段可能發揮的作用不盡相同;在不同時間收集血清,盡可能模擬骨折合并腦外傷大鼠身體的微環境,就可以在不同時間而不是在同一時間使用治療血清。我們對傳統大鼠股骨骨折模型的操作方法作出了一些改良,采取單一的膝關節內側切口,取消了骨折端為中心的傳統切口,減少了手術操作對肌肉及骨膜的損傷,也就避免了肌肉及骨膜損傷對骨折愈合的影響。
實驗結果有力地證明了這樣一種假設,也就是說,大量的骨折愈合血清會產生于骨折與腦損傷同時發生的大鼠體內。從臨床應用的角度來看,這為“促骨折愈合血清”治療骨折延愈合、骨質疏松癥等骨病的臨床應用提供了理論支持,社會經濟效益潛力較大。
盡管有證據表明骨折和腦損傷的血液結合可以促進骨骼的修復和重建,但尚不清楚這種結合是如何工作的。研究的下一步可以是利用蛋白質組學技術[17]檢測血清中的特定蛋白質,研究這些蛋白質的作用及機制。
(本文圖1~6見插圖1-2)

