迷迭香酸對人肝癌Huh7細胞增殖凋亡的影響及其分子機制
趙沙沙 , 程彬彬
1.上海中醫藥大學,上海 200433;2.海軍軍醫大學中醫系,上海 200433;3.海軍軍醫大學附屬長海醫院中醫腫瘤科,上海 200433
肝癌的發病率和死亡率分別居全球癌癥發病率和死亡率的第7位和第3位,其預后較差,只有少數患者有機會接受手術切除或肝移植治療[1-4],而靶向療法存在花費高、出現耐藥性及毒副作用等問題,限制了臨床應用。中醫藥在治療肝癌上發揮著重大作用[5-6]。
近年來,應用天然產物及其活性成分成為腫瘤新藥物的研究熱點[7]。迷迭香酸(Rosmarinic acid,RA)分布廣泛,存在于多種唇形科、紫草科等物種中,如迷迭香、鼠尾草和紫蘇等[8]。迷迭香酸是迷迭香的主要提取物之一[9-10]。RA具有多種活性,如抗炎[11]、免疫抑制[12]等,對結腸癌[13]、乳腺癌[14]等惡性腫瘤具有良好的抗腫瘤作用。本研究探究RA對肝癌Huh7細胞增殖、凋亡的影響,以期為迷迭香在肝癌治療中的應用提供部分依據。
1 材料與方法
1.1 主要試劑與細胞
肝癌Huh7細胞來自海軍軍醫大學附屬長海醫院中醫科實驗室培養并保存。胎牛血清(杭州四季青生物公司);改良杜氏伊格爾培養基(DMEM,美國Gibco公司);CCK-8檢測試劑盒、Annexin V-FITC細胞凋亡檢測試劑盒均購自上海碧云天生物技術有限公司;在500 ml DMEM液體培養基中加入55.5 ml滅活胎牛血清,混勻制成完全培養基,于4℃儲存。將細胞培養于完全培養基中,在含5%CO2的37℃培養箱中培養。迷迭香酸購自Sigma-Aldrich公司,將其溶解在二甲基亞砜(DMSO;Sigma-Aldrich)中,在-20℃下保存。
1.2 CCK8法測定細胞活力
每組設5個平行復孔,將細胞按每孔100 μL,濃度約為6×104·ml-1接種于96孔培養板中,放置恒溫培養箱中培養24 h。空白對照組每孔加入100 μL完全培養基,樣品組每孔加入100 μL不同濃度的迷迭香酸溶液(25,50,100 μmol·L-1),并孵育24 h、48 h、72 h。每孔加入20 μL CCK-8 染料,繼續孵育0.5 h,使用酶標儀在450 nm處測定光密度(optical density,OD)值,并計算細胞抑制率。細胞抑制率(%)=(空白對照組A值-樣品組A值)/空白對照組A值×100%。
1.3 細胞凋亡率的測定
取對數生長期的細胞,按每孔5×105個細胞接種于6孔培養板。37℃溫箱培養24 h后換液,再分別用 0,25,50,100 μmol·L-1濃度的迷迭香酸溶液處理24 h。將孔中舊培養液移入相應流式管,800 μLPBS洗,移入相應流式管,每孔加200 μL不含EDTA的胰酶,消化2 min后,加800 μL完全培養基,輕吹下細胞,移入流式管。2 000 r×5min離心,棄上清。加PBS1ml/管,渦旋,2000r×5min,棄上清。重復一次。棄上清時用1 ml槍頭套10 μL小槍頭,棄上清。1~4號樣品管加Binding Buffer 875 μL/管,渦旋混勻,1 ~ 3號管分別吸375 μL液體移入AV、PI、空白管,4號分別向AV、PI、空白管移入125 μL液體。1~4號及AV管每管加5 μL AV,渦旋。1 ~ 4號及PI管,每管加5 μL PI,渦旋。避光靜置15 min,流式細胞儀檢測,通過儀器軟件對數據進行分析。
1.4 Western blot檢測相關蛋白的表達
將處于對數生長期的Huh7細胞,按每孔2×106個接種于6孔板中,完全培養基培養24 h后換液。分別用 0,25,50,100 μmol·L-1的迷迭香酸處理24 h。預冷的PBS洗兩遍后,加預冷的細胞裂解液(Lysis裂解液∶蛋白酶抑制劑/磷酸酶抑制劑=100∶1),每孔加入100 μL細胞裂解液,冰上裂解15 min,將細胞刮下移入EP管中,置于冰上繼續裂解15 min,每5 min振搖1次,13 000 g離心15 min,收集上清。通過BCA測定試劑盒測定蛋白質濃度。使用10%SDS-PAGE分離20 μg蛋白質,轉移至PVDF膜,將膜置于含脫脂奶粉的封閉液中封閉1 h后,用TBST洗滌6 min重復3次,與相關的一抗(1∶1 000)在4℃孵育過夜。室溫下將膜用TBST洗滌10 min重復3次,并與二抗(山羊抗兔,1∶2 000)在室溫下孵育2 h。使用增強的化學發光檢測試劑盒檢測免疫反應條帶。
1.5 統計學處理
采用SPSS 13.0軟件進行統計學分析,所有細胞實驗均獨立重復3次,數據結果用-x±s表示,多組比較用方差分析,組間比較如方差齊,則采用LSD檢驗,方差不齊則用DunnettT3檢驗,以P<0.05表示差異具有統計學意義。
2 結果
2.1 RA對肝癌Huh7細胞增殖活力的影響
迷迭香酸(25 ~ 100 μmol·L-1)均對Huh7肝癌細胞增殖有明顯的抑制作用,如圖1A、B所示,不同濃度的迷迭香酸與空白對照組相比差異均有統計學意義(P<0.05)。隨著迷迭香酸作用時間的延長及濃度的升高對肝癌細胞增殖抑制能力明顯增強,表現出時間-劑量依賴性。
2.2 RA對肝癌Huh7細胞凋亡的影響
如圖2A、B顯示,用RA作用于Huh7細胞24 h后,隨著RA濃度(0、25、50、100 μmol/L)的增加,凋亡率顯著增加。
2.3 RA調節凋亡相關蛋白質表達
Western Blot實驗結果顯示,隨著RA濃度的增加,Cleaved caspase-3及Bax的表達水平逐漸增高,而Bcl-2水平下降,見圖3。
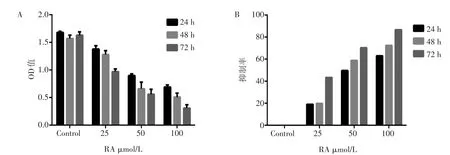
圖1 迷迭香酸對Huh7細胞增殖活性的影響Figure 1 Effect of RA on cell ciability of Huh7 cells

圖2 RA對Huh7細胞凋亡的影響Figure 2 Effect of RA on Huh7 cell apoptosis

圖3 RA對凋亡相關蛋白表達的影響Figure 2 Effect of RA on the expression of apoptotic molecules
3 討論
肝癌是高發病率、高死亡率的惡性腫瘤。肝癌患者的死因主要為腫瘤細胞不斷增殖擴散導致遠處轉移、復發,因此抑制腫瘤細胞的增殖,誘導其凋亡可以抑制肝癌的發生發展。
近年RA作為一種天然的中草藥活性成分,其抗腫瘤作用得到越來越多的重視。早期報道迷迭香酸對多種腫瘤有抑制作用,可以誘導白血病HL-60細胞凋亡,使細胞周期阻滯在G0/G1期[15],還可通過Traf6/TAK1信號通路調控胃癌細胞的增殖及凋亡[16],但針對肝癌的研究尚較為缺乏[17-19]。本研究表明,RA可以通過時間劑量依賴性的方式抑制人肝癌Huh7細胞的增殖,用不同濃度RA處理24 h后,發現與對照組相比,細胞早期凋亡率明顯增加。通過WB檢測凋亡相關蛋白,發現RA可以調節Bax、Bcl-2及Cleaved caspase-3來促進凋亡。細胞的凋亡是細胞維持內環境穩態的重要機制之一,Bcl-2和Bax分別是抑制和促進細胞凋亡的調控基因[20],Bax與Bcl-2為同源的水溶性相關蛋白。當細胞中的Bcl-2過多,則Bcl-2和Bax的異源二聚體相應增多,減弱細胞凋亡;如果Bax表達增加,則Bax的同源二聚體占主要地位,促進凋亡的發生。Bax/Bcl-2的比值是細胞凋亡作用強弱的關鍵因素。已有部分實驗證實,在多種腫瘤細胞中,RA能調節Bax、Bcl-2基因的表達以抑制腫瘤細胞增殖。Caspase-3在Bax與Bcl-2調節細胞凋亡中發揮重要作用,是Bcl-2調節細胞凋亡的上游調節機制之一。當Bax的高表達,或Bcl-2低表達,線粒體會釋放細胞色素c,從而導致Caspase-9的激活,Caspase-9刺激Caspase-3活化為Cleaved caspase-3,最終導致細胞凋亡[21-23]。本研究用不同濃度RA干預人肝癌Huh7細胞,結果發現RA可以調節Bax、Bcl-2及Cleaved caspase-3來促進凋亡。
迷迭香酸可能成為治療肝癌的參考藥物,本研究結果為此提供了部分理論依據,后續將通過體內外實驗進一步研究。

