超量共表達NSAKT1和ATDWF4煙草抗滲透脅迫能力研究
韋春 秦利軍



摘要:為了解鉀和油菜素內酯(BRs)在調控植物抗逆境脅迫中的作用,以超量表達K吸收基因NSAKT及BRs合成基因AIDF4的轉基因煙草為材料,分析PEG滲透脅迫對其形態及抗性指標等的影響。結果表明,PEG脅迫3d時,轉基因煙草SOD活性即達到極值且顯著高于非轉基因煙草(Wt),其中以共轉AKTI/DWE4植株中SOD活性最高;而PG脅迫1d時,3種轉基因植株的POD活性均顯著(《005)高于Wt植株,且共轉AKTIDWF4植株中POD活性分別是單轉AKT植株的1.28倍、單轉DF4植株的1.40倍和W植株的1.90倍PEG脅迫第3天時,共轉AKTDF4植株中CAT活性增幅最大,達59.18%,顯著高于其他2種轉基因煙草。同時,H2O2和MDA含量定表明,PEG處理后Wt中MDA和HO2含量均在第5天時達極值,分別為58.52nong和38.21gg,均顯著高于轉基因煙草。另外,特征基因表達分析表明,NsAK和ATDWFE4可能協同調控共轉1KTI/DWF4煙株對PEG滲透脅迫的抗性。本研究為進一步揭示K和BRs協同介導的煙草抗逆境脅迫應答機制以及創制優良的煙草新種質奠定理論依據。
關鍵詞:煙草;AKT:DF4;抗旱性
鉀不僅能維持植物細胞內穩態平衡和控制氣孔開閉,還能改善煙草制品的安全性。環境中K主要是通過質膜上的K通道(potassium channel,PC)進入植物體內4。PC根據結構和功能不同,又可分為Shaker家族通道、KCO家族通道和其他通道。鉀轉運蛋白1(Arabidopsis-ike e potassium transporter,AKT)是Shaker家族中的K鉀離子通道,能在低K環境(10 umol/L)中促進植物吸收K79。在水稻(Oryza sativa)中,OSAKTI既能調節水稻在鹽脅迫下對K的吸收,又能提高水稻對干旱脅迫的抗性。
近年來,植物激素(plant hormones)介導的非生物脅迫抗性也被廣泛報道。其中,油菜素內酯(brassinosteroids,BRs)作為一種重要的甾醇類激素,參與了細胞分化、維管束發育及植物抗逆等過程1。蕓苔素內酯(brassinolide,BL)作為BRs的活性形式,其生物合成已被證明至少需要經由3條途徑,而DF4是催化這3條途徑的關鍵限速酶718。在擬南芥(Arabidopsis thaliana)中,該酶與擬南芥類固醇羥化酶(Constitutive photomorphogenesis and dwarfism,CPD)具有43%的同源性。研究發現,超量表達DIF4不僅能增加油菜(Brassica napus)種子產量和對小球腔菌(Leptosphaeria maculans)和菌核病(Sclerotinia sclerotiorum)的抗性,還能有效改善擬南芥和番茄(Solanum lycopersicum)的營養生理狀態盡管OSAKT1和DF4兩者單獨調控植物發育及抗性較多,但鮮有對兩者協同介導的非生物脅迫應答進行報道,本試驗立足于提高煙葉中鉀素含量和改善煙葉品質,研究兩者間協同促進轉基因植株對滲透脅迫的抗性,以期為培育鉀含量高、抗旱能力強的煙草新種質提供理論依據。
1材料與方法
1.1材料
普通煙草(Nicotiana tabacum)品種K326,植物表達載體pRI201-35SAKTI、pRI201-rdDw4和pRI201-35SAKTI/rddwfa4均由貴州大學農業生物工程研究院保存、構建并提供。植物激素及抗生素購于Sigma-Aldrich公司;植物表達載體pRI201-AN購于Takara公司;普通質粒小提試劑盒及新型植物DNA提取試劑盒均購于TIANGEN BIOTECH公司;Multiscribe M Reverse Transcriptase Kit n POWERSYBRGreen PCR Master MixKit均購自Applied Biosystems公司物對F-35Sakt/R-Akthsp和F-IddwfR-Dwfhsp及Real-timePCR分析相關引物均由生工生物工程(上海)股份有限公司合成。
1.2方法
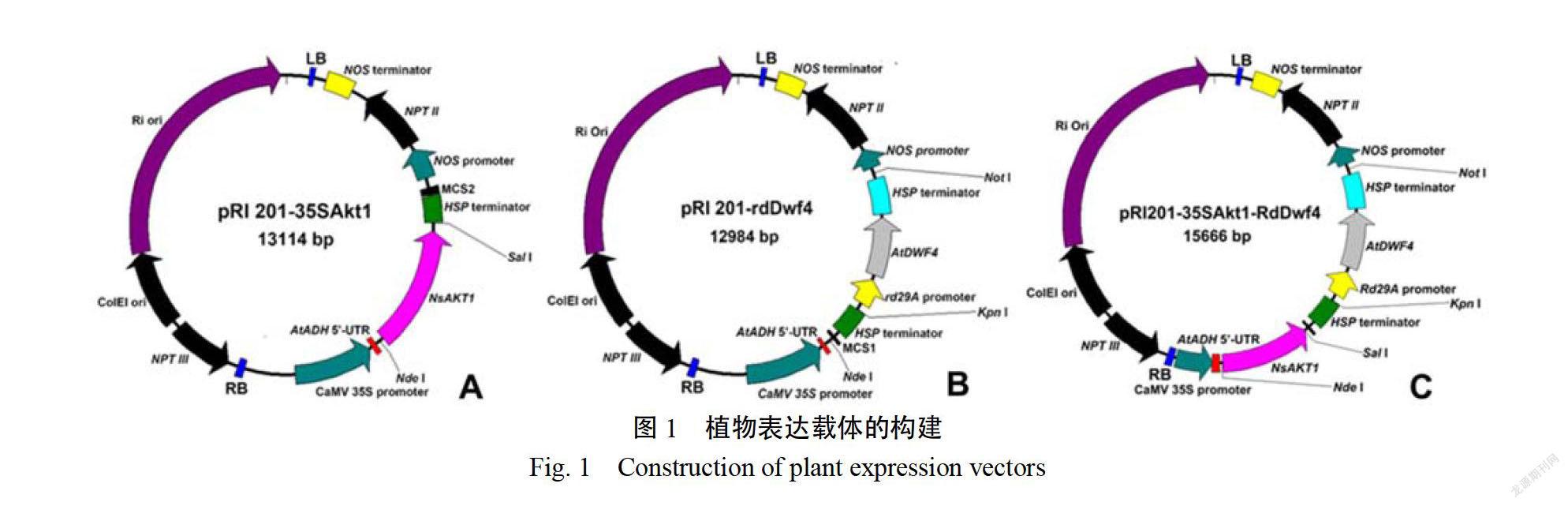
1.2.1載體構建以購自Takara公司的植物表達載體pRI201-AN(Code No.3264)為起始載體,利用Ne和SalI對其進行雙酶切,同時以這2個酶雙酶切人工合成的、兩端含有NeI和SalI酶切位點的NSAKTI基因序列。分別膠回收上述兩種酶切產物,酶切產物依次經T4DNA連接酶連接和酶切驗證后,構建植物表達載體pRI201-35 Saktl(圖1A)。利用KpI和Nor對植物表達載體pRI201-35Aktl進行雙酶切:利用KpI和NorI對植物表達載體pRI20-AN(Code No.3264)進行雙酶切,同時以這2個酶雙酶切人工合成的、兩端含有KpnI和NorI酶切位點的ATDWF4基因表達元件。ADF4基因表達元件由A.thaliana rd29A基因啟動子、A.thaliana DWF4基因及A.Thaliana HSP基因終止序列3部分組成。分別膠回收上述兩種酶切產物,酶切產物依次經T4DNA連接酶連接和酶切驗證后,構建植物表達體pRI201-rddwf(圖1B)。以構建的pRI201-35 SAKTI為中間載體,利用KmI和NoI將ADWF4基因表達元件從植物表達載體pRI201-rdDw4切下并連接入pRI201-35Aktl中并最終構建構建植物表達載體pRI201-35 SAKTI/rddw4(圖1C)。
1.2.2煙草轉化及轉基因植株鑒定參照農杄菌轉化法2,以含3個質粒的工程農杄菌分別對栽培煙草K326進行遺傳轉化,按照譚穎等2的方法對侵染的葉塊進行后續培養。提取抗性煙株總基因組并以其為模板,用特異性引物F-201(-GACGGCCAGTGCCAAGCTTG-3)/R-AKT(5'-CCACACATAGAAACTCCTAAAACTCC-3)FAF-rd(5_GGGCCAATAGACATGGACCGACTAC-3R-DWF(5-CCGAGTGTTGTGGCGGTGTAC-3)對抗性植株進行PCR鑒定。F-201R-Akt引物擴條件為4℃2min:94C,30s,58C,40s,72C,1min,30個循環:72℃,5min:4℃維持。F-Rd/R-Dwf引物擴增條件為:94℃,2min94℃,20s,60℃0s,72℃,1min,28個循環:72℃,5min:4℃維持。
1.2.3轉基因煙草PEG滲透脅迫處理以穩定遺傳的T1代轉基因煙草和同批繁殖的非轉基因煙草(K326)為材料,在16h光照/28℃,8h黑暗/23℃條件下萌發生長,待煙苗長至6~8葉期時,移栽至花盆(盆高18cm,直徑15cm,每盆裝培養基質5kg),置于溫度為(252)℃,濕度70%,光照為1800x,光周期為16h光照/8h黑暗的人工培養箱中恢復培養5d。參照張祎等2的方法以20%PEG-6000溶液處理K326及轉基因煙苗,分別取PEG-6000處理前(0d)及處理1、3和5d的相同部位(自下向上第4葉)煙葉1g,液氮速凍后置于-80℃冰箱保存,用于測定煙葉中的抗氧化酶antioxidant enzymes,AOEs)活性;同時取PEG-6000脅迫處理前(0d)及處理6、12和24h的相同部位(自下向上第5葉)葉片1g,液氮速凍后置于-80℃冰箱保存,用于煙葉中K吸收及BRs合成相關基因表達分析。設3個生物學重復。
1.2.4MDA及H2O2含量測定以PEG-6000處理前(0d)及處理1、3和5d的葉片為材料,參照南京建成生物工程研究所丙二醛(MDA)測定試劑盒(TBA法,A003-1-2)及H2O2測定試劑盒(比色法,A064-1-1)方法制備待測樣,分別于532和405mm波長下測定吸光值,計算MDA和H2O2含量。每組設3個生物學重復。
1.2.5AOEs活性測定參照南京建成生物工程研究所POD(比色法,A084-3-1)、SOD(WST-1法,A001-3-2)和CAT(可見光法,A007-1-1)酶活力測定試劑盒說明書操作制備待測樣,待測樣分別在420、550和405m波長下吸光值,計算POD、SOD和CAT酶活力。每組設3個生物學重復。
1.2.6K吸收及BR合成相關基因表達分析分別取PEG脅迫處理前(0h)和脅迫6、12和24h的轉基因與非轉基因煙草相同部位葉片組織0.1g,按照OMEGA Plant RNA Kit試劑盒說明提取總RNA,并按Applied Biosystems,反轉錄操作將RNA反轉錄為cDNA。使用美國ABI7500實時熒光定量PCR儀檢測轉基因煙株葉片中K吸收相關基因,如HAK1、AKT1、NP1和TORKI以及BRs合成相關基因(DF4、DET2、CPD和RO73)的相對表達量,以煙草B-Acin作為內參基因(表1),每個樣品設3個重復。
1.2.7數據處理采用SPSS18.0軟件進行數據處理,Duncan法分析其差異顯著性。
2結果
2.1植物表達載體的構建及酶切驗證
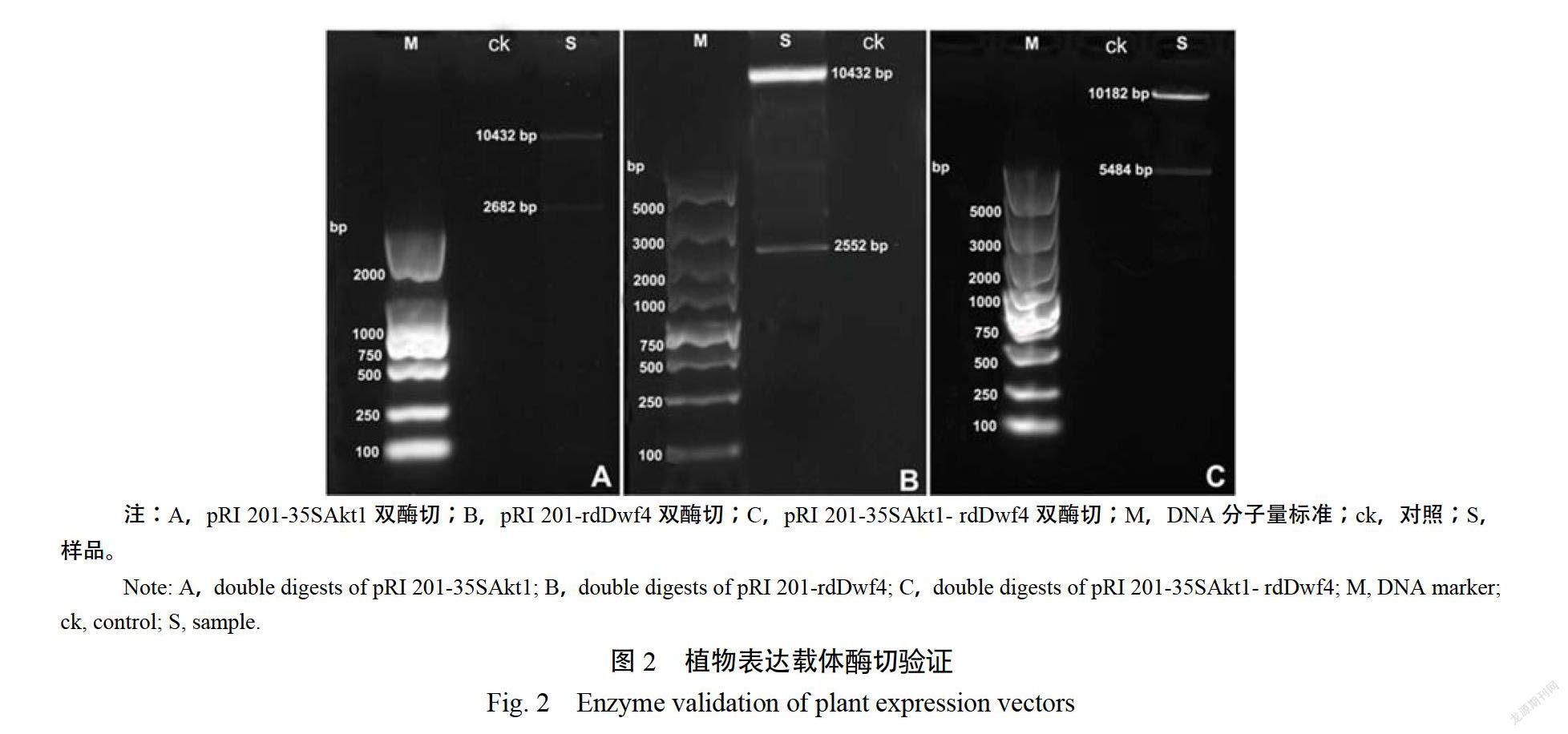
構建了以CaMV35S啟動子驅動N.sylvestrisAKT表達(CaM35:NSAKT)的植物表達載體pRI201-35 SAKTI,以A.haliana rd294基因啟動子啟動A.thaliana DWF4基因(ATDWF4)表達(r29A:AIDF4)的植物表達載體pRI201-rddwfe4和同時含有上述兩個表達元件(CaM/:NSAKT1和r29A:ATDWF4)的植物表達載體pRI201-35SAKTI/Rddwft4。pR201-35SAkt1經NleI/SaI雙酶切可產生2682bp和10432bp兩條帶(圖2A);pRI201-rdidwf4經Kpn I/NotI雙酶切可產生2552bp和10432bp兩條帶(圖2B)pRI201-35SAkt-rddwf4經NdeNotI雙酶切后可產生5484bp和10182bp兩條帶(圖2C)。說明目標片段已經整合到質粒載體中。
2.2轉基因煙株獲得及PCR鑒定
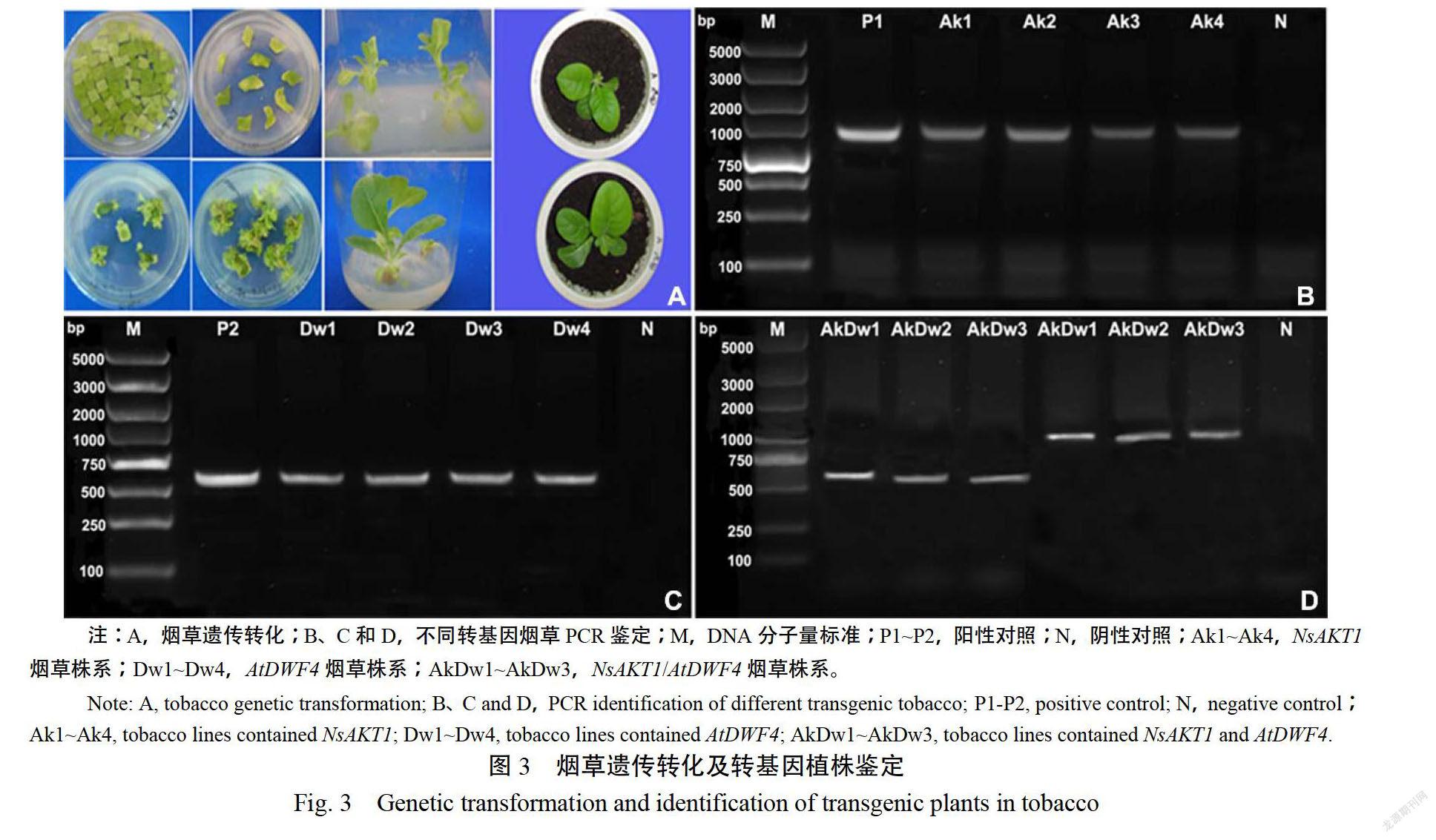
分別以含有pRI201-35SAkl、pRI201-rddwf4以及pRI201-35SAKTI-rddwfe4質粒的工程農桿菌對K326葉片進行遺傳轉化,經一系列培養后獲得抗性植株(圖3A)。剪取抗性煙株葉片0.1g提取總DNA,以特異性引物F-201R-Akt對轉pRI201-35SAk載體的煙株進行鑒定,可擴增產生993bp大小的特異性條帶(圖3B):以引物F-RdR-Dwf對轉pRI201-rddwf載體的煙株進行鑒定,可擴增產生554bp大小的特異性條帶(圖3C)而共轉植株可同時擴增到993bp和54bp兩條特異帶(圖3D)。最終,鑒定到單轉NSAKT植株56株,單轉ADF4植株42株,共轉NSAKTIATDWF4植株38株。
2.3PEG脅迫對轉基因煙草生長的影響
PEG脅迫試驗表明,3~5葉期轉基因和非轉基因(W)植株經PG脅迫3d后,單轉ATDWF4植株(Dw)和單轉NSAKT7植株(Ak)均出現了不同程度的萎蔫,而共轉NSAKTILATDWF4的煙株(AkDw)僅少數葉片出現萎蔫,Wt葉片完全萎蔫、變黃(圖4A):68葉期的轉基因煙苗對PG脅迫均表現出一定的抗性,但在脅迫處理10d時,單轉植株(Ak和Dw)的萎蔫程度顯著高于AkDw植株,而W植株在處理10d時葉片(完展葉和心葉)完全萎蔫,且下部葉片為焦枯色(圖4B),說明無論是3~5葉期的小煙苗,還是68葉期的大煙苗,AkDw植株都表現出較強的耐旱性。可見共轉NSAKTIATDWF4植株耐旱性高于單轉AIDF4植株,高于單轉NSAKT植株。
2.4PEG脅迫對不同煙株理化指標的影響
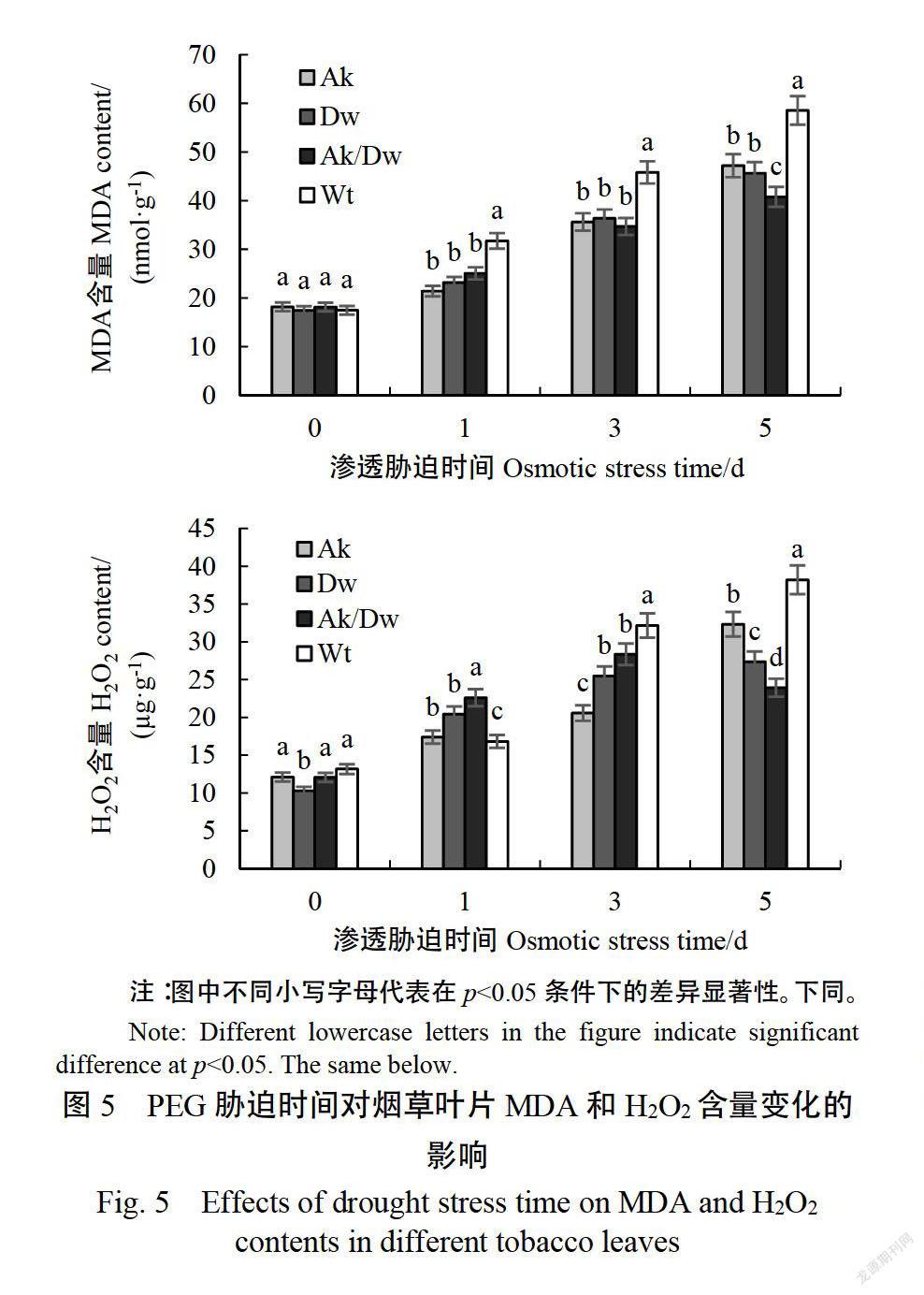
2.4.1PEG脅迫對MDA及H2O2含量的影響由圖5可以看出,PEG脅迫處理前,轉基因和非轉基因煙株MDA含量差異不顯著。在脅迫1~5d時,非轉基因煙草MDA含量始終顯著高于轉基因煙草說明PEG脅迫可引起非轉基因煙株MDA的顯著積累。在PEG處理第5天時,AkDw植株MDA含量顯著低于Ak植株、Dw植株和W植株,表明其在應答PEG滲透脅迫時,AkDw植株能更有效地降低脂膜氧化產物MDA的積累,進而保護植物細胞。在PEG脅迫處理前,Dw植株H2O2含量顯著低于其他3種植株,但PEG滲透脅迫1d時,Dw煙草中的H2O2迅速積累且幅僅次于Ak/D植株。在PEG滲透脅迫1d時,轉基因植株中H2O2含量增幅均顯著高于非轉基因植株。脅迫處理3d和5d,非轉基因煙草中H2O2含量始終顯著(《005)高于轉基因植株。在PEG滲透脅迫5d時,除Ak/Dw植株H2O2含量降低外,Ak和W植株H2O2含量增幅均高于D植株。這一現象說明,不同轉基因植株應答PEG滲透脅迫時引起植物體積累H2O2的能力不同,進而反映出植株所受H2O2氧化程度也各異。
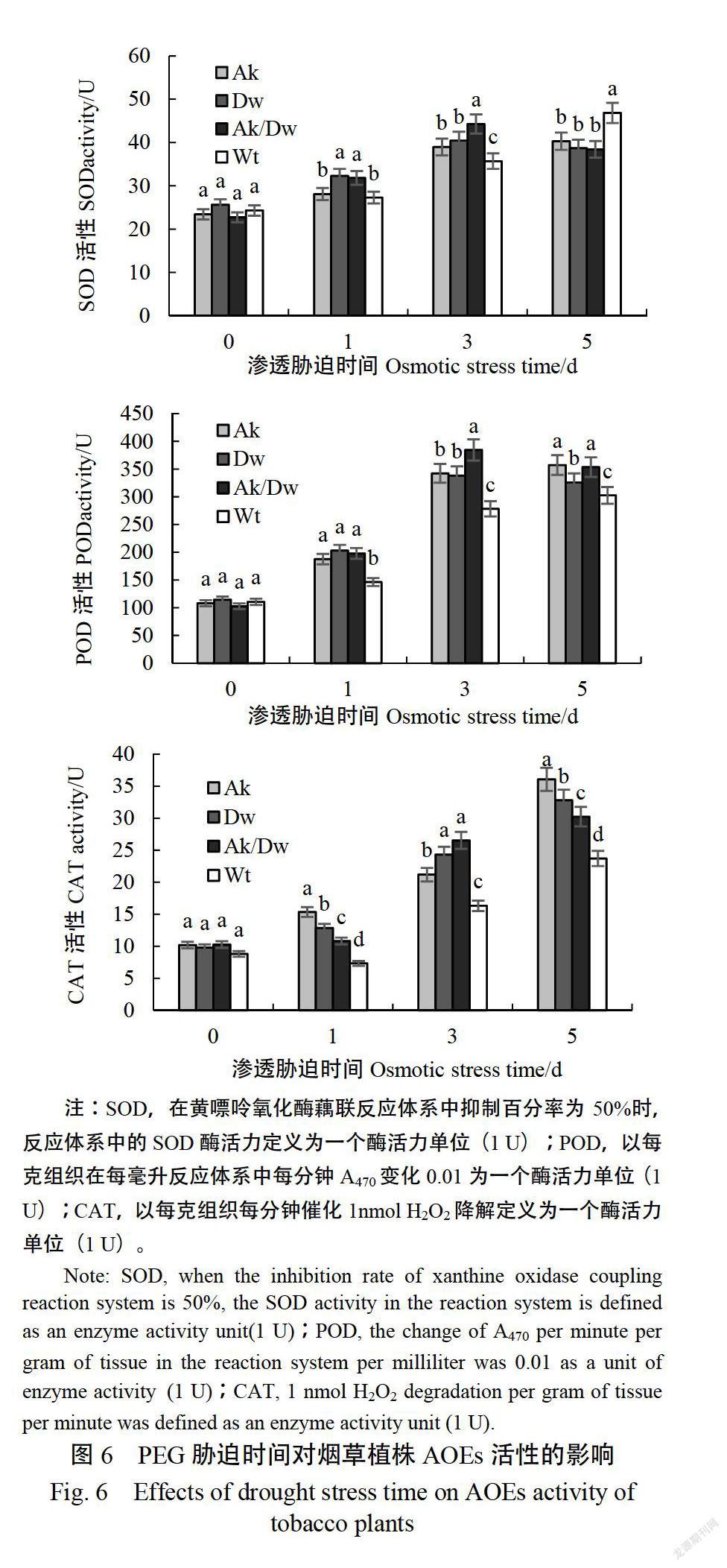
2.4.2PEG脅迫對AOEs活性的影響脅迫處理前,轉基因與非轉基因植株AOEs活性無顯著差異(圖6)。在脅迫3d時,轉基因煙草的SOD活性均顯著高于非轉基因煙草,其中以共轉AKT/DF4煙株的最高,達44.28U,其次是單轉DWF4植株,為40.45U。同時,在PEG處理第3天時,單轉DWF4和共轉AKTI/DF4煙株的POD活性達到極值,分別為338.16和384.37U。4種煙草株系CAT活性總體上表現為持續加的變化趨勢,但幅有一定差異。在PEG脅迫處理第3天時,共轉AKTIDWF4植株CAT活性増幅最大,較脅迫處理1d時增加59.18%,其余2種轉基因植株CAT活性增幅也較非轉基因植株顯著。以上結果表明,轉基因植株能有效并迅速地提高AOEs的活性來消除由于PEG滲透脅迫引起的H2O2、O2·等超氧化物的積累,且不同轉基因植株表現出調動AOEs活性存在一定差異。
2.5PEG脅迫煙草植株K吸收及BR合成基因表的影響
2.5.1K吸收相關基因表達由圖7可見,在PEG滲透脅迫24h內,Ak、Dw和AkDw植株HAK基因表達量不斷增加,但以Dw植株增幅最為顯著。AKT基因在Ak和AkDw植株也呈逐步上升趨勢,且ー直顯著高于Dw和Wt植株,這可能與AKT在Ak和AkDw植株中的超量表達有關。在PEG滲透脅迫6h時,轉基因煙株中P表達量顯著高于W植株,隨著脅迫時間的增加,僅AkDw植株中的NPl表達量始終顯著高于W植株。TROKI在轉基因植株中表達変化與HAK基本相似,但表達量增幅有一定差異,以Ak植株最高,Ak/Dw其次,Dw植株最低。進一步分析發現,PEG滲透脅迫不僅誘導Dw植株AK基因的表達上調,同時也引起Ak和Ak/Dw植株中AKT的表達量加而AK和AKT在調控植物應答低鉀等非生物脅迫抗性中具重要作用;另外,PEG滲透脅迫還使Ak和AkDw植株中TROK基因顯著上調表達推測轉基因植株在應答PEG介導的滲透脅迫時,一方面通過調節K富集相關基因的表達實現對K的吸收以提高K介導的抗旱應答脅迫能力;另一方面為了維持植物內K含量穩定,K外排通道隨即啟動以平衡機體內的鉀含量。
2.5.2BRs合成相關基因表達由圖8可以看出,PEG滲透脅迫24h內,DWF4基因在Dw和AkDw植株中的表達量始終顯著高于Ak和W植株,且在脅迫12h時Dw植株中DF4基因的表達量最高顯著高于其他煙草植株。在PEG脅迫6~12h內,Dw和AkDw植株中的DET2基因表達量均顯著高于Ak和Wt植株,且二者間也存在顯著差異,而在PEG脅迫24h時DE72在AkDw和Dw植株中的表達差異不顯著。滲透脅迫后,CPD在轉基因煙草中表達趨勢一致,即隨著脅迫時間增加,CPD表達量逐強増,但不同轉基因植株中的增幅有一定差異,始終以在AkDw植株中的表達量最高。除Dw植株外,在PEG脅迫6~12h內,RO73在Ak、Ak/Dw和W植株中的表達量無顯著差異,但在脅迫處理24h時,AkDw中ROT3表達量迅速上調,顯著高于Dw、Ak和Wt植株。DWF4作為BRs生物合成中的關鍵限速基因,其表達量的高低直接影向下游基因的表達。本研究中PEG滲透脅迫引起了Dw和AkDw植株中DF4在6h時即出現顯著表達,暗示這兩類轉基因植株可通過迅速調控BRs的合成以啟動BRs介導的抗性信號通路的表達。同時,在脅迫處理后期(24h)AkDw植株中BRs合成中下游基因DET2、CPD和RO73的高表達也表明,在應答PEG滲透脅迫時AkDw植株內積累更多的BRS。
3討論
在植物中,K作為重要的滲調物質和電荷載體不僅參與了細胞生長、氣孔開閉以及內穩態平衡等多種生命活動,而且在多種生物脅迫(biotic stress與非生物脅迫(abiotic stress)抗性中具有十分重要的作用。植物從外界吸收K主要依賴于K通道蛋白和K轉運體兩類系統3,AKT1是從Ahaliana突變體中鑒定到的一種耐低鉀(10 umol/L)及非生物脅迫的重要K通道蛋白。此外,BRs是從油菜(Bra.ssica napus)花粉中分離的一種植物類固醇激素(steroid he ormone)3,在調節植物生長發育和逆境脅迫中也具有重要作用143。DF4可編碼A.thaliana細胞色素P450(cytochrome P450),該蛋白是BRs生物合成中的關鍵限速酶,介導BRs生物合成過程中的多個22-羥基化(22 alpha-hydroxylation)步驟339。本文結果表明,無論是3~5葉期的共轉NSAKT和AIDF4的小煙苗,還是68葉期的大煙苗都表現出對PG滲透脅迫一定的抗性,說明NSAKT1和Atw4的共同導入能明顯增強轉基因煙草的耐旱能力。產生這一現象原因可能包括2個方面,其一是NSAKT的超量表達引起了K含量的迅速積累,同時激活了由K介導的抗非生物脅迫應答;其二是ADHF4的過表達也可能引起了轉基因煙草中BRs含量增加,故轉基因植株在應答滲透脅迫時能迅速調動BRs介導的抗逆境通路基因的表達來提高作物的耐旱能力。
PEG滲透脅迫引起了各煙草植株中H2O2不同程度的積累,但在脅迫處理3d和5d時,非轉基因煙草中H1O2含量始終顯著(p《0.05)高于轉基因植株,且在脅迫處理第5天時H2O2含量比共轉NSAKT1和ATDWF4植株高37.4%;另外,H2O2的逐漸積累引起了植株細胞脂膜不斷氧化產生MDA,但非轉基因植株中MDA的積累量卻顯著(p《0.05高于轉基因植株。說明轉基因植株能有效降低PEG滲透脅迫所引起的過氧化物(H2O2)及其氧化產物(MDA)的積累,從而減少植物細胞損害。YU等報道了轉細菌冷休克蛋白(bacterial cold shock protein)基因Secspa的小麥可通過降低MDA含量、失水率等指標提高抗旱能力;張袆等2研究超量表達NTHAKI煙草時也發現其應答干旱脅迫時MDA含量顯著低于非轉基因植株。AOES活性測定結果表明,在PEG脅迫前3d,轉基因煙草的SOD、POD和CAT活性始終高于非轉基因植株,但不同煙草株系抗氧化酶活性有一定差異。在PEG脅迫第5天時,除SOD外,轉基因植株中其余兩種酶活性仍顯著(p《0.05)高于非轉基因植株,這與GAO等的研究結果一致。說明轉基因植株應答PEG滲透脅迫時,能夠迅速調動機體的抗氧化酶系統(antioxidase system)對過量積累的O2、H2O2等進行有效的清除。同時,在轉基因植株中較低的H2O2含量證明高AOEs活性實現了H2O2的還原,從而起到保護植物的作用。
在PEG脅迫的單轉NSAKT1和共轉NSAKTIATDWF4植株中同時檢測到了較高的AKT1和TORK1表達,推測AKT基因的高表達可能會引起植物中K的大量積累,植物體通過調節TORK的表達增強過剩K的外排,以穩定細胞內正常的鉀素平衡,這一結果與譚穎等研究MHAK超量表達引起TORK基因上調的結果類似。同時,PGE滲脅迫還引起了BRs合成相關基因DWF4、DET2、CPD和ROT3的差異表達。這些基因在單轉ADWF4煙草和共轉NSAKTI和ATDWE4煙草中的高表達引起了BRs的迅速積累,從而提高植物的抗旱性。這是由于BRs一方面可通過促進可溶性蛋白和滲透調劑物的積累及水分和氣體交換提高作物對干的耐受性454,另方面可以通過與其他植物激素(如ABA和ET)或信號通路(如SApathway)互作來影響植物的抗旱性。與單轉NSAKT1和ATDWE4煙草相比,PEG滲透脅迫引起了共轉NSAKT1和ATDWF4煙草中4個BRs合成關鍵基因DWF4、DE72、ROT3和CPD顯著上調,表明共轉煙株應答滲透脅迫時引起了BRs積累。
4結論
超量共表達N.sylvestris AKT1和A.thalianeDWF4能顯著增強轉基因植株對PEG滲透脅迫的抗性,共轉NSAKTATDWF4煙株比單轉NsAK、單轉ADF4以及非轉基因植株(W)表現出高AOEs(SOD、POD和CAT)酶活性以及MDA和H2O2含量的降低,且可通過協同調控K吸收及BRs合成相關基因的表達實現轉基因植株對滲透脅迫的應答。本研究可為培育富鉀、耐旱煙草新種質提供理想的親本材料。
參考文獻
[1] MARON L. Phospholipids: novel players in the complex regulation of potassium channels in plants. The Plant Journal, 2020, 102(4)
[2] WHITE, PHILIP J, KARLEY, ALISON J Potassium[J]. Plant Cell Monographs,2010,17:199-224.
[3] YAMAMOTO T, UMEMURA S, KANEKO H Effect of exogenous potassium on the reduction in tar, nicotine and carbon monoxide deliveries in the mainstream smoke of cigarettes [J]. Beitrage zur Tabakforschung International/Contributions to Tobacco Research,2013,14(6):379-385.
[4]曲平治,劉貫山,劉好寶,等.煙草鉀離子通道研究展[J].中國煙草科學,2009,30(2):74-80
[5] SZCZERBA M W, BRITTO D T, KRONZUCKER H[J]. K”transport in plants: physiology and molecular biology [J]. Journal of Plant Physiology,2009,166(5):447-466.
[6] VERY AA, SENTENAC H Molecular mechanisms and regulation of K transport in higher plants [J]. Annual Review of Plant Biology,2003,54(1):575-603
[7] SANCHEZ-BARRENA M J, CHAVES-SANJUAN A, RADDATZ N, et al. Recognition and activation of the plant AK7/ potassium channel by the kinase CIPK23[J]. Plant physiology, 2020, 182(4) 19.01084.
[8] GAMBALE F, UOZUMI N. Properties of shaker-type potassium channels in higher plants [J]. The Journal of Membrane Biology2006,210(1):1-19
[9] LI J, WU W, WANG Y Potassium channel AK7/ is involved in the auxin-mediated root growth inhibition in Arabidopsis response to low K "stress [J]. Journal of Integrative Plant Biology, 2017, 59(12)895-909.
[10] FUCHS I, STOLZLE S, IVASHIKINA N, et al. Rice K”uptake channel OSAKTI is sensitive to salt stress. Planta, 2004, 221(2212-221
[11]AHMAD I, MIAN A, MAATHUIS F [J]. Overexpression of the rice AKTI potassium channel affects potassium nutrition and rice drought tolerance [J]. Journal of Experimental Botany, 2016, 67(92689-2698.
[12] PELEG Z, BLUMWALD E. Hormone balance and abiotic stress tolerance in crop plants [J]. Current Opinion in Plant Biology, 201114(3)290-295
[13] KUMAR PP. Regulation of biotic and abiotic stress responses by plant hormones [J]. Plant Cell Reports, 2013, 32(7): 943
[14] VERMA V, RAVINDRAN P, KUMAR P P. Plant hormone-mediated regulation of stress responses [J]. BMC Plant Biology,2016,16(1):86-96
[15] LIAQAT S, UMAR S, SAFFEULLAH P, et al. Protective effect of 24-epibrassinolide on barley plants growing under combined stress of salinity and potassium deficiency]. Journal of Plant Growth Regulation, 2020: 1-16
[16] NOLAN T, VUKASINOVIC N, LIU D, et al. Brassinosteroids multidimensional regulators of plant growth, development, and stress responses [J]. The Plant Cell, 2020, 32(2): 295-318
[17] SAKAGUCHI J, MATSUSHITA T, WATANABE Y. DWARF4 accumulation in root tips is enhanced via blue light perception by 418) cryptochromes[J]. Plant, Cell&Environment, 2019, 42(5): 1615-1629
[18]ZHAO B L, L [J]. Regulation of brassinosteroid biosynthesis and inactivation [J]. Journal of Integrative Plant Biology, 2012, 54(10746-759
[19] SI J, SUN Y, WANG L, et al. Functional analyses of Populus euphratica brassinosteroid biosynthesis enzyme genes DWF4 PEDWF4 )and CPD(PECPD )in the regulation of growth and development of Arabidopsis thaliana [J]. Journal of Biosciences,2016,41(4):727-742
[20] SAHNI S, PRASAD B D, LIU Q, et al. Overexpression of the brassinosteroid biosynthetic gene DWF4 in Brassica napus simultaneously increases seed yield and stress tolerance [J]. Scientific Reports,2016,6(1):28298.
[21] REN C, HAN C, PENG W, et al. A leaky mutation in DIARF4 reveals an antagonistic role of brassinosteroid in the inhibition of root growth by jasmonate in Arabidopsis [J]. Plant physiology, 2009151(3):1412-1420
[22] LI X J, CHEN X J, GUO X, et al. DWARF overexpression induces alteration in phytohormone homeostasis, development, architecture and carotenoid accumulation in tomato[J]. Plant Biotechnology Journal,2016,14(3)1021-1033
[23] HUDZIECZEKA V, CEGANA R, CERMAK T, et al Agrobacterium rhizogenes-mediated transformation of a dioecious plant model Silene latifolia [J]. New Biotechnology, 2019, 48: 20-28
[24]譚穎,秦利軍,趙丹,等.共轉化法獲得HAK基因高表達煙草提高植株鉀吸收能力[J].植物生理學報,2013,49(7):689-699
[25]張,秦利軍,趙丹,等超量表達NTHK1基因提高煙草干旱脅迫能力[J].植物生理學報,2017,53(8):14441452
[26]郭兆奎,楊謙,姚泉洪,等轉擬南芥ATNHT基因促進煙草對鉀吸收的研究[J].高技術通訊,2007(17):1174-1179
[27] WANG M, ZHENG Q, SHEN Q, et al. The critical role of potassium in plant stress response [J]. International Journal of Molecular Sciences,2013,14:7370-7390
[28] SONG W, LIU S, MENG L, et al. Potassium deficiency inhibits lateral root development in tobacco seedlings by changing auxin distribution [J]. Plant and Soil, 2015, 396(1): 163-173
[29] SHABALA S, CUIN T A. Potassium transport and plant salt tolerance[J]. Physiologia Plantarum, 2008, 133(4): 651-669
[30]庫文珍,趙運林,董萌.植物ShakerK通道的研究進展中國生物工程雜志,2012,32(10):112-11
[31] HIRSCH R E, LEWIS B D, SPALDING E P, et al. A role for the AKTI potassium channel in plant nutrition. Science, 1998280(5365):918-921
[32] PILOT G, GAYMARD F, MOULINE K, et al. Regulated expression of Arabidopsis Shaker K channel genes involved in K"uptake and distribution in the plant [J]. Plant Molecular Biology, 2003, 51773-787
[33] GROVE M D, SPENCER G F, ROHWEDDER W K, et al Brassinolide, a plant growth-promoting steroid isolated from Brassica napus pollen]. Nature, 1979, 281(5728): 216-217
[34] CLOUSE S D, SASSE [J]. Brassionsteroids: essential regulators of plant growth and development. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49: 427-451
[35] TANVEER M, SHAHZAD B, SHARMA A 24-epibrassinolide; an active brassinolide and its role in salt stress tolerance in plants: a review [J]. Plant Physiology and Biochemistry, 2018, 130: 69-79
[36] DENG X, ZHU T, ZHANG D, et al. The alternative respiratory athway is involved in brassinosteroid-induced environmental stress tolerance in Nicotiana benthamiana [J]. Journal of Experimental Botany,60(20):6219-6232.
[37] FARIDUDDIN Q, YUSUF M, AHMAD I, et al. Brassinosteroids nd their role in response of plants to abiotic stresses. Biologia Antrum,2014,58(1)9-17
[38] CHOE S, DILKES B P, FUJIOKA S The DIF4 gene ofarabidopsis encodes a cytochrome P450 that mediates 22alpha-hydroxylation steps in brassinosteroid biosynthesis [J]. The lant Cel,198,10(2):231-243
[39] KVASNICA M, OKLESTKOVA J, BAZGIER V, et al. Biological activities of new monohydroxylated brassinosteroid analogues with a carboxylic group in the side chain [J]. Steroids, 2014, 85: 58-64
[40] HASANUZZAMAN M, BORHANNUDDIN BHUYAN M HM NAHAR K, et al. Potassium: a vital regulator of plant responses and tolerance to abiotic stresses [J]. Agronomy, 2018, 8: 31-60
[41] NOLAN T, CHEN J, YIN Y Cross-talk of Brassinosteroid signaling in controlling growth and stress responses [J]. Biochemical Journal2017,474(16):2641-266
[42] YU T F, XU Z S, GUO J K, et al. Improved drought tolerance in wheat plants overexpressing a synthetic bacterial cold shock protein gene SEC'SP.]. Scientific Reports, 2017, 7: 1-14
[43] GAO S, WANG Y, YU S, et al. Effects of drought stress on growth, physiology and secondary metabolites of two Adonis species in Northeast China]. Scientia Horticulurae, 2020, 259(3): 259-269
[44] IVASHIKINA N, BECKER D, ACHE P, et al. K"channel profile and electrical properties of Arabidopsis root hairs. FEBS Letters001,508(3):463-469
[45] TALAAT N B, ABDALLAH A M. Effect of 28-homobrassinolide and 24-epibrassinolide on the growth, productivity and nutritional value of two faba bean ( Vicia faba L. )cultivars. Archives of Agronomy and Soil Science, 2010, 56(6): 649-669
[46] FAROOQ M, WAHID A, BASRA S M A, et al. Improving water relations and gas exchange with brassinosteroids drought stress [J]. Journal of Agronomy and Cre5(4):262-269
[47] DIVI U K, RAHMAN T, KRISHNA P. Brassinosteroid-mediated stress tolerance in Arabidopsis shows interactions with abscisic acid, ethylene and salicylic acid pathways [J]. BMC Plant Biology, 201010:151-156

