茶樹己糖激酶基因CsHXK1的克隆與表達分析
陳江飛,楊建坤,黃慧宇,余有本,王偉東
(西北農林科技大學 園藝學院,陜西楊凌 712100)
茶樹[Camelliasinensis(L.)O.Kuntze]作為一種葉用經濟作物,在中國乃至世界范圍具有廣泛的栽培種植。然而,茶樹在其生長發育過程中經常面臨著各種環境脅迫的影響,如冬季和早春的低溫脅迫、夏季的高溫和干旱脅迫,以及土壤鹽漬化引起的高鹽脅迫等。因此,明確茶樹脅迫響應機制,篩選和鑒定抗性基因對培育抗性茶樹優良品種具有重要意義。
眾所周知,己糖(六碳糖,如葡萄糖和果糖)是植物中大多數代謝途徑和有機物質合成的原始底物,其在參與糖酵解、呼吸作用、物質合成和分解代謝前需進行磷酸化,而己糖激酶(Hexokinase,HXK)是催化己糖磷酸化的關鍵酶之一[1]。目前,越來越多的研究證實HKX不僅具有催化己糖磷酸化的作用,其還參與植物糖感受和糖信號轉導過程[2]。例如,擬南芥AtHXK1和AtHXK2反義轉基因植株對外源葡萄糖的敏感性顯著降低,而過表達轉基因植株對外源葡萄糖高度敏感[3];進一步的研究表明,擬南芥AtHXK1通過感知葡萄糖水平,從而參與細胞增殖、根和花序生長、葉片膨脹和衰老以及葉片蒸騰等植物生長發育過程[4-6]。另外,植物HXK可以把葉綠體生成的糖信號傳導到細胞核中,調節光合作用有關基因的表達,進而調控植物的光合作用,同時己糖激酶在質體-細胞核的信號傳導中也有著至關重要的用途[7]。此外,許多研究證實HXK參與了植物對各種生物和非生物脅迫的響應過程。例如,NbHXK1、 AtHXK1和AtHXK2參與了甲基紫精和病原體感染誘導的氧化應激[8];低溫、滲透和鹽脅迫能夠顯著誘導擬南芥AtHXK2的表達,而抑制情況AtHXK3的表達[9-10];過表達的水稻OsHXK5或OsHXK6能夠顯著抑制植株生長,其可能依賴于對光合基因RBCS的抑制作用[11];類似地,AtHXK1在保衛細胞中的過表達促進了氣孔的關閉,進而降低了糖處理下植株的蒸騰作用[6];HXK1通過氧化磷酸化調控水稻OsCIPK15基因的表達參與缺氧信號途徑[12]。然而,茶樹中有關NXK的研究相對滯后,其參與茶樹脅迫響應的功能機制尚不清楚。
本試驗從茶樹中克隆獲得了CsHXK1基因cDNA序列,利用生物信息學技術分析了該基因及其編碼蛋白的結構特征,并利用實時熒光定量 PCR(qRT-PCR)分析了CsHXK1在高溫、干旱、低溫及鹽脅迫下的表達模式,以期為探討該基因逆境脅迫下的生物學功能奠定基礎,為茶樹抗逆分子遺傳育種提供理論依據。
1 材料與方法
1.1 植物材料及處理
以長勢一致的‘龍井長葉’品種茶樹穴盤扦插苗為試驗材料,于人工氣候箱中進行預培養。2周后,分別對茶苗進行高溫(40 ℃)、低溫(4 ℃)、鹽脅迫(200 mmol/L NaCl)和干旱脅迫(20% PEG 6000)處理,其他條件保持不變。每個處理設置3次重復,并于處理后0、2、6、12、24和48 h分別取0.1 g嫩葉;此外,取未處理茶苗的根、嫩莖、嫩葉以及花器官用于組織表達分析,所有樣品用液氮速凍并置于-80 ℃保存,備用。
1.2 茶樹總RNA提取和cDNA合成
茶樹葉片材料的總RNA采用CTAB法進行提取,用NanoDrop 2000c(Thermo Scientific,美國)對RNA的濃度和質量進行檢測,再經質量分數為1%變性瓊脂糖凝膠電泳檢測RNA的完整性。利用反轉錄試劑盒(ABM,加拿大)合成cDNA用于基因的克隆及熒光定量PCR反應。
1.3 茶樹 CsHXK1基因的克隆
根據茶樹基因組[13]中CsHXK1基因序列設計特異性全長引物(F:GAATCGATCTCTGAGCCTGTGATGG,R:CTGAATACTTGGCCTTTGACCAT),以‘龍井長葉’品種茶樹cDNA為模板進行PCR擴增,PCR反應程序為:94 ℃ 預變性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,32 個循環;72 ℃ 延伸10 min。PCR產物經質量分數為1.25%瓊脂糖凝膠電泳檢測并回收目的條帶,回收產物連接至pMD19-T 載體(TaKaRa,大連)進行測序。
1.4 生物信息學分析
利用ProtParam tool在線軟件(https://web.expasy.org/protparam/)預測蛋白理化性質;ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)進行親/疏水性分析;Netphos 3.0 Serve(http://www.cbs.dtu.dk/services/NetPhos)預測蛋白質磷酸化位點;用軟件DNAMAN8 進行多序列比對,用MEGA 6.0構建系統進化樹;用在線軟件WoLF PSORT(https://wolfpsort.hgc.jp/)預測蛋白亞細胞定位,采用SignaIP(http://www.cbs.dtu.dk/services/SignalP/)在線軟件進行信號肽預測。
1.5 實時熒光定量PCR(qRT-PCR)分析
根據基因序列設計定量引物(F:CAGAATATGATCAAGCATTGGAT,R:TATGAGGGGTCCTTAAAATAAATGG),以茶樹CsPTB基因為內參基因(F:TGACCAAGCACACTCCACACTATCG,R:TGCCCCCTTATCATCATCCACAA),參照SYBR○RPremix ExTaqⅡ(TaKaRa,大連)試劑盒說明進行qRT-PCR分析,反應程序為:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 1 min 30 s,循環 40次;60 ℃ 30 s,71 個循環,每次上升0.5 ℃。每個樣品設3次技術重復,數據采用2-ΔΔCT算法分析[14]。
1.6 數據處理
利用Excel 2010和SPSS 22軟件對試驗數據進行處理和統計分析。
2 結果與分析
2.1 茶樹 CsHXK1基因的克隆
以茶樹‘龍井長葉’葉片的cDNA為模板,通過RT-PCR擴增獲得特異性單一條帶(圖1),測序結果顯示該條帶序列全長1 534 bp,包含一個1 488 bp的開放閱讀框,編碼495個氨基酸,與茶樹基因組中序列一致為茶樹CsHXK1基因cDNA序列。此外,基因結構分析結果顯示茶樹CsHXK1基因由9個外顯子和8個內含子組成(圖2)。

M. DL2000; 1-2:PCR產物 PCR amplification product
圖1 茶樹CsHXK1基因cDNA全長序列RT-PCR擴增
Fig.1 RT-PCR amplification of the full-length cDNAofCsHXK1gene in tea plant
2.2 茶樹CsHXK1蛋白多序列比對與進化分析
多序列比對結果顯示,茶樹CsHXK1蛋白與其他物種的HXK1蛋白具有較高的相似性,且均包含2個磷酸化作用位點:phosphate 1和phosphate 2、一個底物結合位點sugar binding和一個ATP結合位點(圖3)。進化分析顯示,茶樹CsHXK1蛋白與擬南芥AtHXK1、蘋果MdHXK1和甘藍BoHXK1的進化關系較近,而與單子葉植物水稻的親緣關系較遠(圖4)。

圖2 茶樹 CsHXK1基因的結構分析Fig.2 Structural analysis of CsHXK1 gene in tea plant
2.3 茶樹CsHXK1蛋白生物信息學分析
2.3.1 茶樹CsHXK1蛋白理化性質分析 蛋白理化性質預測顯示,茶樹CsHXK1蛋白分子式為C2379H3816N652O709S23,其蛋白分子質量為53.63 ku,理論等電點為5.96,含有負電荷殘基(Asp+Glu)62個,正電荷殘基(Arg+Lys)54個。疏水性分析結果顯示CsHXK1蛋白的親水區域大于疏水區域,且GRAVY指數為-0.002,表明其屬于親水性蛋白(圖5)。

實線框為磷酸化位點 The solid line frame is the phosphorylation site;虛線框為ATP結合位點 The dotted line frame is the ATP binding site;下劃線為底物結合位點 The underline is the substrate binding site
圖3 茶樹與其他植物HXK1蛋白的多序列比對
Fig.3 Multiple sequence alignment of HXK1 from tea plant and other plants
2.3.2 茶樹CsHXK1蛋白磷酸化分析 磷酸化位點預測分析顯示,CsHXK1蛋白包含多個磷酸化位點,其中以絲氨酸位點居多,推測其可能受到磷酸化的調控作用(圖6)。亞細胞定位預測結果顯示CsHXK1蛋白主要定位與葉綠體和細胞核中;此外,SignalP軟件預測顯示在CsHXK蛋白的第54~55位氨基酸處存在信號肽。

圖4 不同物種的HXK1蛋白進化分析Fig.4 Phylogenetic analysis of HXK1 protein sequences from different species
圖5 茶樹CsHXK1蛋白疏水性分析Fig.5 Hydrophobicity analysis of CsHXK1 protein
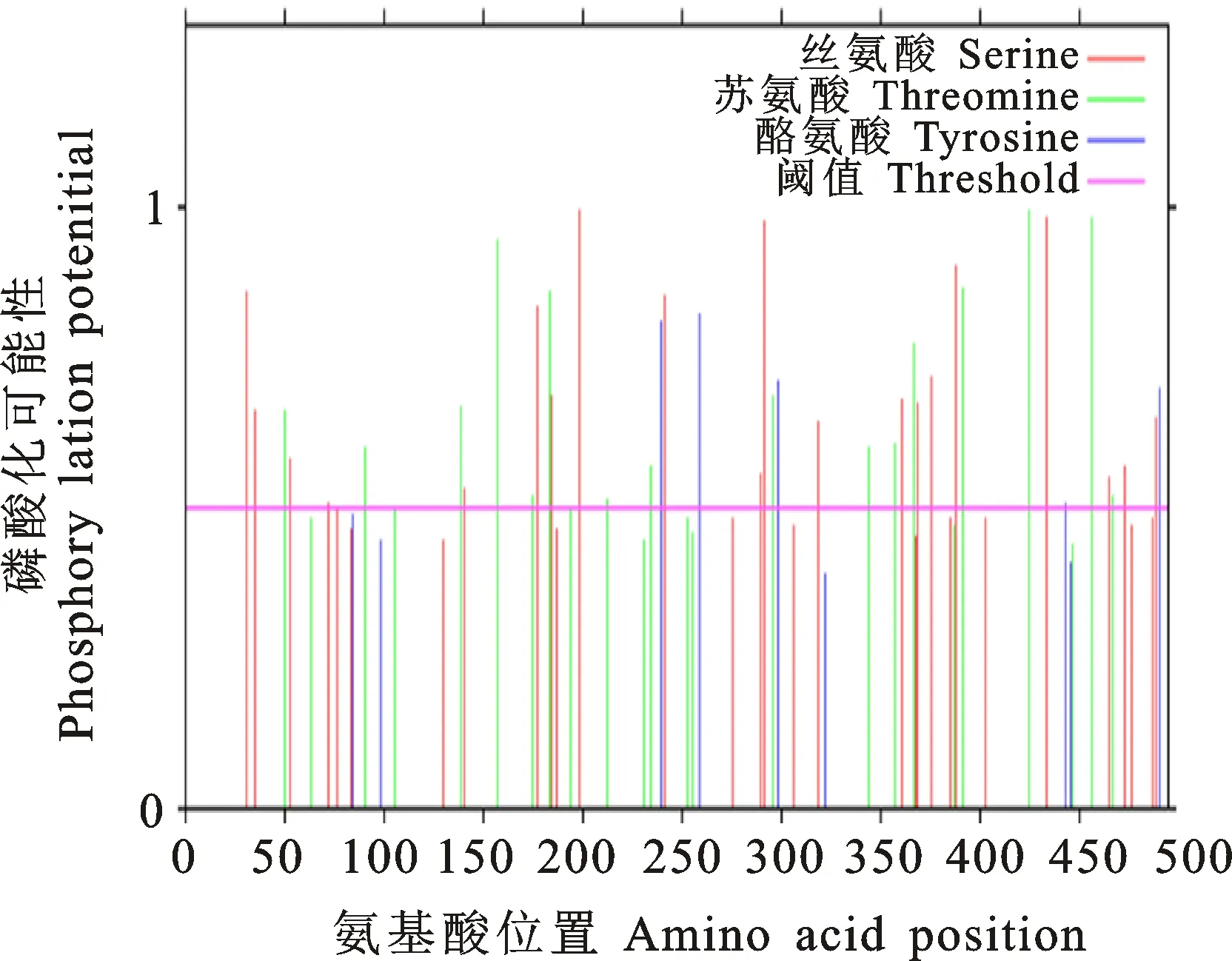
圖6 茶樹CsHXK1蛋白磷酸化位點分析Fig.6 Analysis of phosphorylation site of CsHXK1 protein
2.4 茶樹 CsHXK1基因啟動子順式作用元件 分析
利用PLACE軟件對CsHXK1基因上游啟動子區域的順式作用元件進行預測,結果發現CsHXK1基因啟動子區域含有與逆境脅迫響應相關的元件,如脫落酸響應元件ABRE、機械損傷響應元件Wun-motif、脫水響應元件ACGTATERD1和低溫響應元件MYBCORE等,還包含多個與激素信號轉導和糖信號轉運等相關的順式作用元件,如TGACG-motif和MYCCONSENSUSAT等 (表1)。
2.5 茶樹 CsHXK1在不同組織中的表達分析
如圖7所示,CsHXK1基因在各個組織中都能被檢測,且呈現出一定的組織表達特異性,其在茶樹的花器官中表達量最高,其次是葉片,根和莖中最低。
2.6 非生物脅迫下茶樹 CsHXK1基因表達模式分析
qRT-PCR結果顯示,在不同脅迫處理下茶樹CsHXK1基因均被誘導表達,但其表達趨勢存在明顯差異(圖8)。其中,CsHXK1的表達水平在高溫處理的前12 h快速升高,且在第12 h達到峰值,約為對照的10倍左右,之后其表達量急速回落到對照水平;而20% PEG 6000模擬干旱處理下,CsHXK1基因表達水平逐步上升,在第 48 h達到對照的6~7倍,但在12 h時有輕微的降低;在低溫處理下,CsHXK1在第2 h受誘導上調表達,并在第12 h達到表達峰值,后期逐漸回落;CsHXK1在鹽處理下一直維持較高的表達水平。

表1 茶樹 CsHXK1基因啟動子區域重要順式作用元件分析Table 1 Analysis of important cis-acting regulatory elements in the upstream regulatory sequence of CsHXK1

圖7 茶樹 CsHXK1基因在不同 組織中的表達分析Fig.7 Analysis of expression of CsHXK1 gene in different tissues
3 討 論
HXK蛋白不僅能夠催化己糖磷酸化,為植物的生命活動提供能量保證,而且在糖信號轉導以及逆境響應方面也具有重要的生物學功能。目前,有關于HXK蛋白的研究已經成為廣泛關注的熱點[15-16]。
目前,擬南芥中鑒定有6個HXK成員,其中AtHXK1.2、AtHXK1.3、AtHXL1和AtHXL2基因包含9個外顯子和8個內含子[2];Cho等[17]發現除了水稻OsHXK1之外,絕大多數的OsHXK含有相同數量的外顯子和內含子。同時, Guo等[18]證實基因的內含子數目與長度對基因的表達具有重要影響。本研究中筆者也發現茶樹CsHXK1基因由9個外顯子和8個內含子組成,這與小立碗蘚[19]和蘋果[20]HXK的研究結果一致,表明單、雙子葉植物的HXK1基因的結構均高度保守,推測其發揮著類似的生物學功能。另外,信號肽預測顯示茶樹CsHXK1蛋白在N端具有信號肽,這暗示CsHXK1可能是分泌性蛋白,其在信號肽的作用下,運輸到指點地點后對其目標底物進行磷酸化作用[20]。前人的研究指出,植物HXK蛋白在細胞中的定位具有明顯的不同,如擬南芥AtHXL2和AtHXL3定位于線粒體膜上[2],煙草HXK蛋白則定位于葉綠體[21],還有一些單子葉植物如水稻玉米的HXK蛋白定位于細胞質內[21],且不同的亞細胞定位也導致其功能上的差異[22]。筆者預測發現茶樹CsHXK1蛋白主要定位于葉綠體和細胞核中,結合Cho等[11]研究認為細胞核內的HXK蛋白能夠與VHA-B1和RPT5B結合成復合體,并作用于葡萄糖信號調節基因的啟動子,以此調控目的基因的表達;而定位于葉綠體中的HXK在功能上主要是對葉綠體中的己糖進行磷酸化[19,23],推測茶樹CsHXK1蛋白可能在葉綠體和細胞核中也具有相類似的功能,然而這需要進一步試驗驗證。

圖8 茶樹 CsHXK1基因的表達模式分析Fig.8 Analysis of expression pattern of CsHXK1 gene in tea plant
許多研究表明,HXK基因在植物不同組織間的表達水平有較大差異,對植物的生長發育起到不同的調控作用[2,17]。例如,甘薯IbHXK1在成熟的塊莖中表達較高,參與對淀粉的酵解過程[24];水稻多數HXK在水稻的未成熟的種子、莖、葉片、花中均有表達,而OsHXK10僅在花中被檢測到[2];蘋果MdHXK1則主要在花中表達,并與花瓣中花青素的積累密切相關[20]。本研究發現茶樹CsHXK1也在葉片和花中有較高的表達,表明其可能在上述組織器官中發揮重要作用。此外,大量研究已證實HXK廣泛參與植物非生物脅迫響應過程,例如過表達擬南芥AtHXK1和AtHXK2能夠明顯增強轉基因植株對氧化脅迫的耐受性[8];擬南芥AtHXK2受到干旱、鹽和低溫的顯著誘導,而高溫、干旱等逆境也會提升AtHXKL3的轉錄水平[9];在水稻和向日葵中,一些HXK的同源基因也不同程度的受非生物脅迫的誘導[25-26]。最近,趙錦等[20]發現蘋果MdHXK1除了受到鹽、低溫及外源ABA的顯著誘導,還發現其啟動子區域包含多個與逆境響應的相關元件。本研究亦發現茶樹CsHXK1基因啟動子區域含有多個逆境響應元件,如ABA響應元件、脫水響應元件及低溫響應元件,這可能與其響應逆境脅迫具有密切的聯系。同時,qRT-PCR結果也表明茶樹CsHXK1受到高溫、干旱、低溫及鹽脅迫的顯著誘導,這與Li等[27]的結果高度一致,意味著CsHXK1參與到多種非生物脅迫響應過程中。本研究為進一步探究茶樹CsHXK1在非生物脅迫響應過程中的功能提供了重要的前期參考。

