玉米大斑病菌和小斑病菌交配型多重PCR檢測方法的建立與應用
代玉立,甘林,滕振勇,楊靜民,祁月月,石妞妞,陳福如,楊秀娟
玉米大斑病菌和小斑病菌交配型多重PCR檢測方法的建立與應用
代玉立1,甘林1,滕振勇2,楊靜民3,祁月月4,石妞妞1,陳福如1,楊秀娟1
(1福建省農業科學院植物保護研究所/福建省作物有害生物監測與治理重點實驗室,福州 350013;2福建省種子管理總站,福州 350001;3建甌市農業農村局,福建建甌 353100;4浙江天豐生物科學有限公司,浙江金華 321000)
【目的】由大斑突臍蠕孢()和玉蜀黍平臍蠕孢()引起的玉米大斑病和小斑病是玉米生產上重要的葉部真菌病害,本研究旨在建立玉米大斑病菌和小斑病菌交配型多重PCR檢測方法,為玉米大斑病菌和小斑病菌的交配型田間分布和有性生殖研究提供技術方法。【方法】根據GenBank中已登錄的玉米大斑病菌(登錄號MAT1-1:GU997138和MAT1-2:GU997137)和小斑病菌(登錄號MAT1-1:X68399和MAT1-2:X68398)交配型基因序列,利用Primer Premier 5.0軟件設計2種病原菌交配型多重PCR檢測特異性引物,采用單因素法對引物的退火溫度以及擴增程序中延伸時間和循環數等重要參數進行優化,建立玉米大斑病菌和小斑病菌交配型多重PCR檢測方法,并對2種病原菌的交配型多重PCR檢測靈敏度和特異性進行檢驗。同時,對田間采集的129株玉米大斑病菌和194株玉米小斑病菌單孢菌株的交配型進行多重PCR檢測,以明確建立的交配型多重PCR檢測方法的適用性。【結果】建立的多重PCR方法和設計的交配型特異引物StMAT01-2F/R、StMAT02-3F/R、ChMAT01-3F/R和ChMAT02-2F/R可分別擴增出MAT1-1、MAT1-2型菌株大小為816、132 bp(大病斑菌)與490、136 bp(小病斑菌)的特異性目的條帶。25 μL多重PCR擴增體系:2×Multiplex PCR Mix 12.5 μL,引物各10 pmol,DNA模板100 ng,退火溫度為57.2℃(大病斑菌)和55.0℃(小斑病菌),35個循環。該多重PCR對玉米大斑病菌MAT1-1、MAT1-2型單孢菌株的檢測靈敏度分別為0.1、0.01 ng基因組DNA,而對玉米小斑病菌MAT1-1、MAT1-2交配型的檢測靈敏度均為0.1 ng基因組DNA。該交配型多重PCR檢測方法對玉米大斑病菌和小斑病菌特異性很強,能夠很好地區分玉米大斑病菌和小斑病菌相應的近緣種和14株其他真菌菌株。不同地理來源的玉米大斑病菌和小斑病菌交配型檢測結果表明,該多重PCR能夠準確地檢出129株玉米大斑病菌和194株玉米小斑病菌的交配型,且檢測結果與隨機抽取的菌株雜交驗證結果完全吻合。【結論】構建的玉米大斑病菌和小斑病菌交配型多重PCR檢測方法靈敏度高、特異性好、操作簡便,能夠準確、快速地檢測出玉米大斑病菌和小斑病菌的交配型,為玉米大斑病菌和小斑病菌的交配型田間分布和監測及有性生殖研究提供了可靠的技術方法。
玉米大斑病菌;玉米小斑病菌;交配型;多重PCR;靈敏度;特異性
0 引言
【研究意義】由玉米大斑病菌()和小斑病菌()分別侵染玉米葉片引起的玉米大斑病(northern corn leaf blight,NCLB)和小斑病(southern corn leaf blight,SCLB)是世界各玉米產區普遍發生的重要葉部真菌病害[1-3]。玉米大斑病和小斑病在中國東北地區、黃淮海地區以及南方山地等玉米主產區發生嚴重,一般減產10%—30%,大暴發年份減產50%—100%,嚴重損害了玉米的產量和品質[4-5]。玉米大斑病和小斑病均為典型的流行性病害,隨氣流傳播的分生孢子可在田間循環侵染,造成病害在短時間內流行暴發[6-8]。此外,這兩種病原菌均可在玉米生長后期進行有性生殖,造成病原菌種群內遺傳變異頻繁、生理分化明顯以及高寄主適合度菌株不斷出現[9-11],從而致使玉米新品種的抗性迅速喪失,這為我國玉米大斑病和小斑病的長期可持續控制帶來了困擾。明確植物病原微生物的交配型是進行病害有性生殖研究的基本前提,因此,建立玉米大斑病菌和小斑病菌交配型快速、準確和操作簡便的檢測方法具有重要的實踐意義。【前人研究進展】研究玉米大斑病菌和小斑病菌的交配型、有性生殖及其有性后代的寄主適合度,揭示病原菌的遺傳變異機制[5,9,12],可為制定病害的綜合防控措施提供理論參考。然而,植物病原菌不同交配型菌株間無明顯的形態學差異,研究者無法通過肉眼或顯微觀察來準確判斷病原菌的交配型。傳統的交配型檢測方法是將待測菌株與交配型已知菌株進行室內雜交,通過有性子實體的形成與否,來判斷待測菌株的交配型,該方法檢測周期長,易受外界因素的影響,而且往往由于菌株間交配親和能力弱而導致檢測失敗[13-15]。隨著分子生物學技術的發展,通過設計特異引物用PCR方法檢測子囊菌的交配型已成為國內外研究的熱點[16-17]。TAKAN等[18]根據稻瘟病菌()MAT1-1和MAT1-2基因序列設計交配型特異引物,采用常規PCR方法檢測稻瘟病菌交配型及其在東非的地理分布;DE MICCOLIS ANGELINI等[19]設計了葡萄灰霉病菌()交配型RT-PCR檢測特異引物,用于檢測葡萄灰霉病菌菌絲、菌核以及子囊盤時期的交配型;BREWER等[17]在研究葡萄白粉病菌()交配型基因座結構的基礎上,建立了葡萄白粉病菌交配型的多重PCR檢測方法。此外,交配型的PCR快速檢測方法還被成功應用于蕓薹葉斑病菌()[20]、大麥云紋病菌()[21]、小扁豆殼二孢疫病菌()[15]、小麥殼針孢葉枯病菌()[22]和除蟲菊褐斑病菌()[23]等重要植物病原菌的交配型檢測中。玉米大斑病菌和小斑病菌均屬典型的異宗配合的子囊菌[24]。目前,玉米大斑病菌和小斑病菌的交配型基因序列已被克隆,兩種病原菌均具有一對在核苷酸序列上高度異源的交配型基因座,即MAT1-1和MAT1-2[25-26]。MAT1-1和MAT1-2基因在結構上分別至少含一個-1結構域和高泳動蛋白家族(high mobility group,HMG)結構域[25-26]。通過檢測-1和HMG結構域即可準確鑒定異宗配合子囊菌的交配型[16-17]。【本研究切入點】在前人已完成玉米大斑病菌和小斑病菌交配型基因克隆的基礎上,根據各自交配型基因序列的保守區設計交配型檢測特異引物,構建玉米大斑病菌和小斑病菌交配型多重PCR檢測體系,提高交配型檢測的效率。【擬解決的關鍵問題】根據玉米大斑病菌和小斑病菌的交配型基因序列,設計其交配型檢測特異引物,單因素法優化多重PCR反應條件,建立快速、準確以及可分別同時檢測玉米大斑病菌和小斑病菌交配型的多重PCR檢測方法,為玉米大斑病菌和小斑病菌的交配型田間分布和監測以及有性生殖研究提供可靠的技術手段。
1 材料與方法
試驗于2018年6月至2019年7月在福建省農業科學院植物保護研究所完成。
1.1 供試菌株
供試玉米大斑病菌近緣種參子凸臍蠕孢(;CGMCC編號:3.13861)、小柄凸臍蠕孢(;3.13862)和蘆葦凸臍蠕孢(;3.13863)菌株購自中國科學院微生物研究所中國普通微生物菌種保藏管理中心(CGMCC);玉米圓斑病菌()和小麥根腐病菌()菌株分別由四川農業大學農學院龔國淑教授和安徽省農業科學院植物保護與農產品質量安全研究所汪濤助理研究員惠贈;供試的其他真菌菌株均由福建省農業科學院植物保護研究所植物病害研究室分離保存。玉米大斑病菌和小斑病菌標準菌株的編號和交配型以及其他真菌菌株見表1。
1.2 供試菌株基因組DNA的提取
將稻瘟病菌和其他供試菌株分別在淀粉瓊脂培養基和馬鈴薯葡萄糖瓊脂培養基(PDA)平板上28℃黑暗培養5—7 d,用無菌手術刀輕輕刮取培養基表面菌絲置于2 mL無菌離心管中,供試菌株基因組DNA的提取采用改良的CTAB法[27]。DNA樣品用30 μL TE緩沖液(10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA,pH 8.0)溶解,核酸定量儀測定各菌株DNA的濃度并用TE緩沖液調節至100 ng·μL-1,DNA樣品于-80℃冰箱中保存。
1.3 多重PCR特異性引物的設計
從GenBank網站(https://www.ncbi.nlm.nih.gov/)下載玉米大斑病菌交配型MAT1-1和MAT1-2(登錄號:GU997138和GU997137)以及玉米小斑病菌交配型MAT1-1和MAT1-2(登錄號X68399和X68398)的基因序列[25-26]。利用DNAMAN 5.0軟件進行多重序列比對,尋找各交配型基因的保守序列。通過Primer Premier 5.0軟件設計交配型多重PCR檢測的特異引物,利用Primer-BLAST(https://www.ncbi.nlm.nih.gov/ tools/primer-blast/)在線工具對設計的引物進行特異性檢驗[28]。引物委托上海英濰捷基生物技術有限公司合成。
1.4 多重PCR反應體系的建立
由于多重PCR使用的是大連寶生物工程有限公司生產的2×Multiplex PCR試劑盒(V2.0),因此,重點對影響多重PCR反應體系的引物退火溫度以及擴增程序中延伸時間和循環數等重要參數分別進行單因素優化,其余試劑用量和擴增條件嚴格按照試劑盒推薦劑量和擴增條件。玉米大斑病菌和小斑病菌交配型的多重PCR檢測特異引物的退火溫度分別設置為62.0、61.6、60.7、59.1、57.2、55.6、54.5、54.0℃和56.0、55.6、54.7、53.1、51.2、49.6、48.5、48.0℃;多重PCR反應體系的延伸時間分別設置為30、45和60 s;循環數分別設為30、35和40次。擴增反應在Bio-Rad C1000TM型梯度PCR儀中進行。擴增結束后取7 μL擴增產物于120 v恒定電壓下用含EB的1.5%瓊脂糖電泳20 min,UVP BioDoc-ItTM凝膠成像系統檢測并拍照。
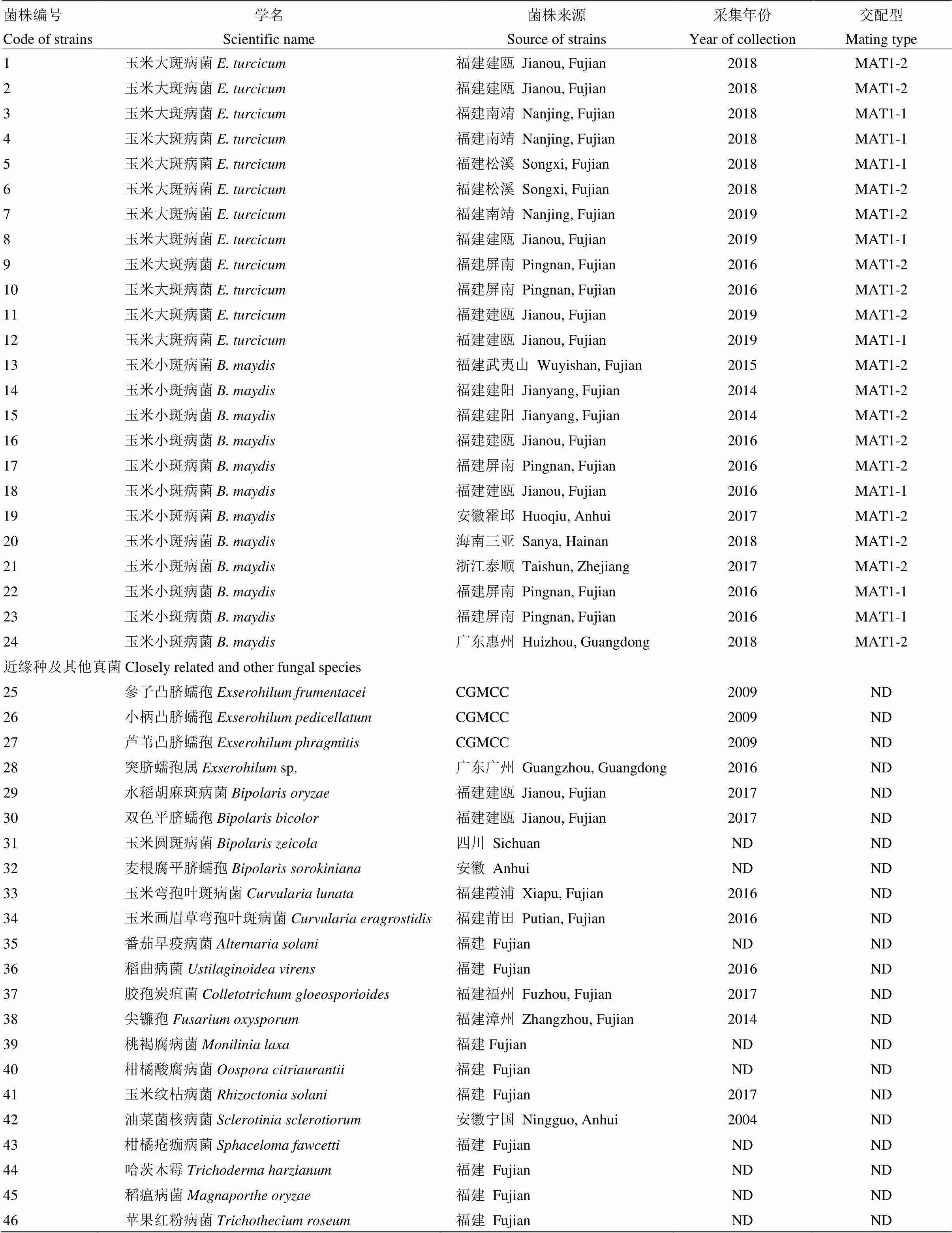
表1 供試菌株信息
CGMCC:中國普通微生物菌種保藏管理中心China General Microbiological Culture Collection Center;ND:不確定not determined
1.5 交配型多重PCR檢測的驗證
分別以12株玉米大斑病菌和小斑病菌交配型已知菌株的基因組DNA為模板(表1),利用優化的多重PCR反應體系進行擴增,以不加模板DNA為空白對照。每菌株5個重復,試驗重復3次。檢驗設計的玉米大斑病菌和小斑病菌交配型多重PCR檢測的準確性。
1.6 多重PCR靈敏度檢測
取交配型為MAT1-1和MAT1-2型玉米大斑病菌菌株的基因組DNA各1份,將DNA模板按10倍梯度稀釋,獲得濃度梯度為100、10、1、10-1、10-2、10-3和10-4ng·μL-1;玉米小斑病菌MAT1-1和MAT1-2型菌株的DNA濃度梯度設置為10、1、10-1、10-2、10-3、10-4和10-5ng·μL-1,利用優化的多重PCR反應體系進行擴增,每25 μL PCR體系取上述各濃度DNA模板1 μL,以不加模板DNA為空白對照。每濃度梯度5個重復,試驗重復3次。檢驗玉米大斑病菌和小斑病菌交配型多重PCR檢測的靈敏度。
1.7 多重PCR特異性檢測
選取玉米大斑病菌和小斑病菌MAT1-1和MAT1-2型菌株的基因組DNA各3份,分別以和近緣種以及其他14個屬(種)真菌基因組DNA為陽性對照(表1),以不加模板DNA為空白對照。每菌株設置5個重復,試驗重復3次。檢驗玉米大斑病菌和小斑病菌交配型多重PCR檢測的特異性。
1.8 多重PCR檢測體系的應用
從福建、安徽、海南、浙江和廣東省采集田間感染玉米大斑病和小斑病的病葉標本,采用單孢分離純化法獲得田間玉米大斑病菌和小斑病菌菌株分別為129和194株[29-30],按上述方法提取各菌株的基因組DNA,利用本研究設計的交配型特異性引物和優化的多重PCR反應體系進行玉米大斑病菌和小斑病菌交配型檢測。分別從福建省不同地區以及安徽、海南、浙江和廣東省隨機選取玉米大斑病菌或小斑病菌菌株5—10株。分別參考郭麗媛等[9]和OIDE等[31]方法與交配型已知的標準菌株進行室內雜交,以驗證該多重PCR檢測結果的準確性。
2 結果
2.1 多重PCR特異性引物的設計
通過DNAMAN 5.0軟件的多重序列比對,利用Primer Premier 5.0軟件篩選出4對較為理想的多重PCR引物用于玉米大斑病菌和小斑病菌交配型的檢測。引物StMAT01-2F/R和StMAT02-3F/R分別用于檢測玉米大斑病菌MAT1-1和MAT1-2交配型,預期PCR產物大小分別為816和132 bp;引物ChMAT01- 3F/R和ChMAT02-2F/R分別用于檢測玉米小斑病菌MAT1-1和MAT1-2交配型,預期產物大小分別為490和136 bp(圖1、表2)。Primer-BLAST檢驗結果表明,這4對引物的特異性較好,可用于后續試驗。
2.2 多重PCR反應體系的建立
通過對引物的退火溫度以及擴增程序中延伸時間和循環數的單因素優化,最終明確玉米大斑病菌交配型多重PCR檢測體系(25 μL)為2×Multiplex PCR Mix 12.5 μL,引物各10 pmol,DNA模板100 ng,補充ddH2O至25 μL。反應程序:94℃ 5 min;94℃ 45 s,57.2℃ 45 s,72℃ 60 s,35個循環;最后72℃延伸10 min(表2)。
玉米小斑病菌交配型多重PCR檢測體系(25 μL)為2×Multiplex PCR Mix 12.5 μL,引物各10 pmol,DNA模板100 ng,補充ddH2O至25 μL。反應程序:94℃ 5 min;94℃ 45 s,55℃ 45 s,72℃ 45 s,35個循環;最后72℃延伸10 min(表2)。
2.3 交配型多重PCR檢測的驗證
利用本研究設計的交配型特異引物和優化的反應體系分別對12株已知交配型的玉米大斑病菌和小斑病菌進行多重PCR檢測,結果表明引物StMAT01- 2F/R對所有MAT1-1型的玉米大斑病菌菌株可擴增出一條816 bp的特異性條帶,對交配型為MAT1-2型的菌株則未擴增出條帶;相反,引物StMAT02-3F/R對所有MAT1-2型的玉米大斑病菌菌株可擴增出一條132 bp的特異性條帶,而對MAT1-1型的菌株則未擴增出任何條帶(圖2-A)。引物ChMAT01-3F/R和ChMAT02-2F/R分別僅對交配型為MAT1-1和MAT1-2的玉米小斑病菌菌株擴增出一條490和136 bp的特異性條帶(圖2-B)。玉米大斑病菌和小斑病菌交配型的多重PCR檢測結果與菌株的交配型完全一致,表明設計的交配型特異引物和建立的多重PCR反應體系準確性高,可用于玉米大斑病菌和小斑病菌交配型的快速檢測。

紅色和藍色的方框及箭頭分別表示玉米大斑病菌(A)和小斑病菌(B)交配型MAT1-1和MAT1-2型特異引物結合位點
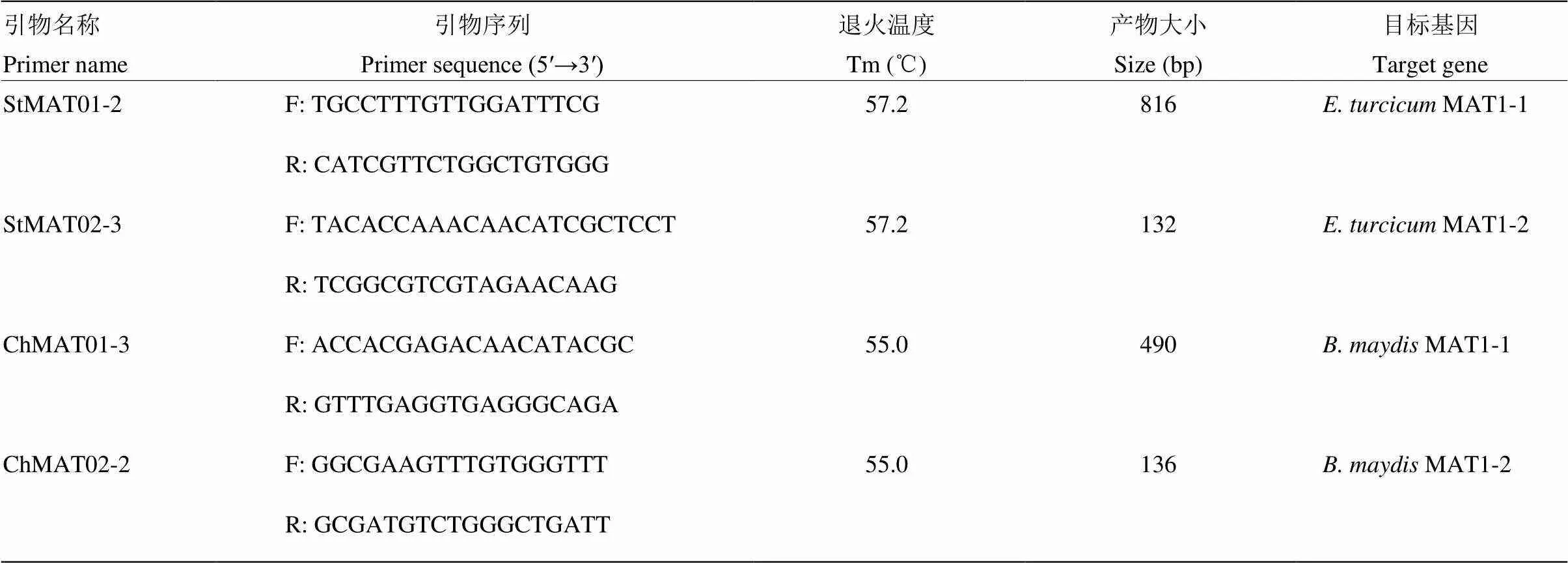
表2 玉米大斑病菌和小斑病菌交配型多重PCR檢測的特異引物
2.4 多重PCR靈敏度檢測
優化的多重PCR檢測體系對玉米大斑病菌MAT1-1交配型的檢測靈敏度為0.1 ng基因組DNA,而對MAT1-2交配型的檢測靈敏度達0.01 ng基因組DNA(圖3-A)。對玉米小斑病菌MAT1-1和MAT1-2交配型的檢測靈敏度均為0.1 ng基因組DNA(圖3-B)。
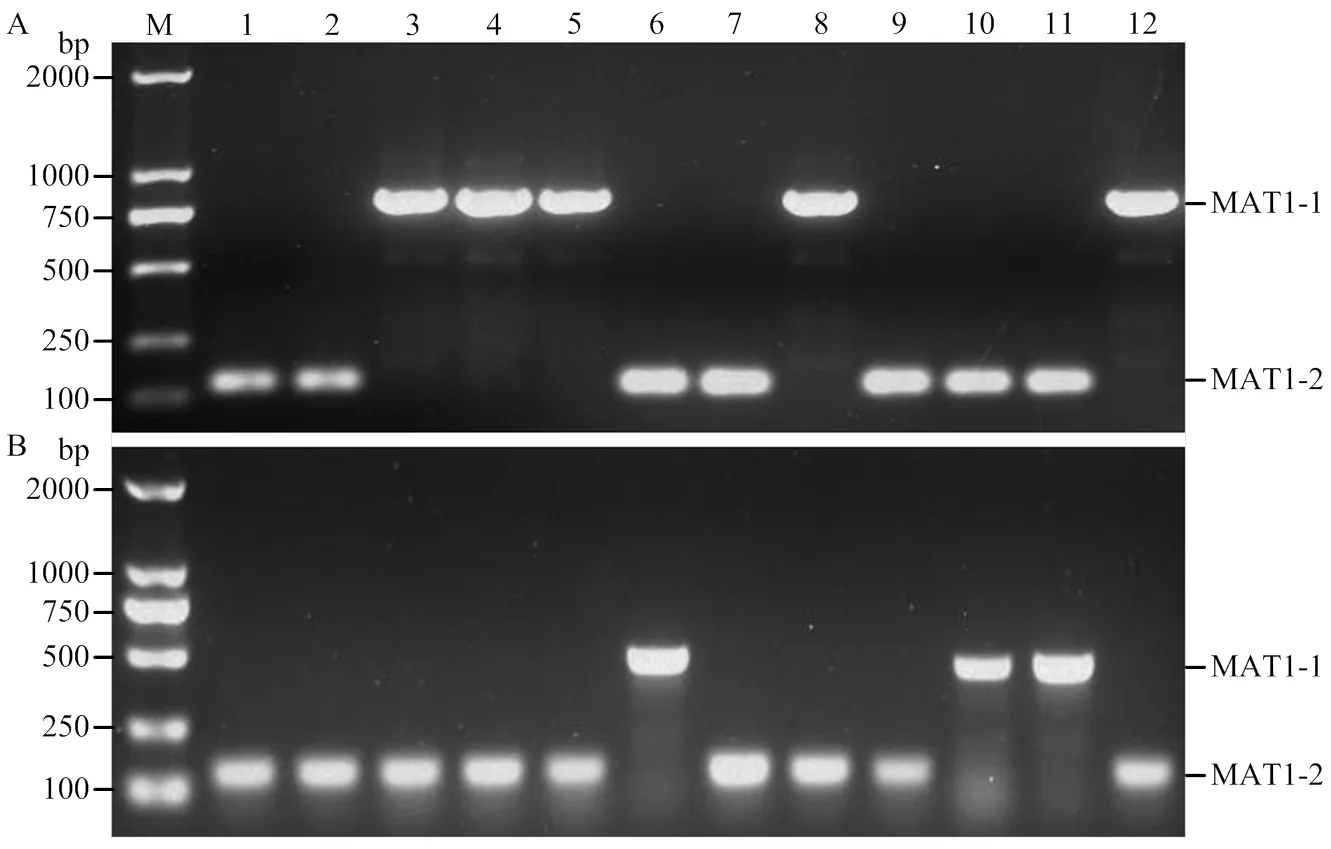
M:2 kb DNA ladder;1—12:表1中列舉的12株交配型已知的玉米大斑病菌(A)和小斑病菌(B)菌株
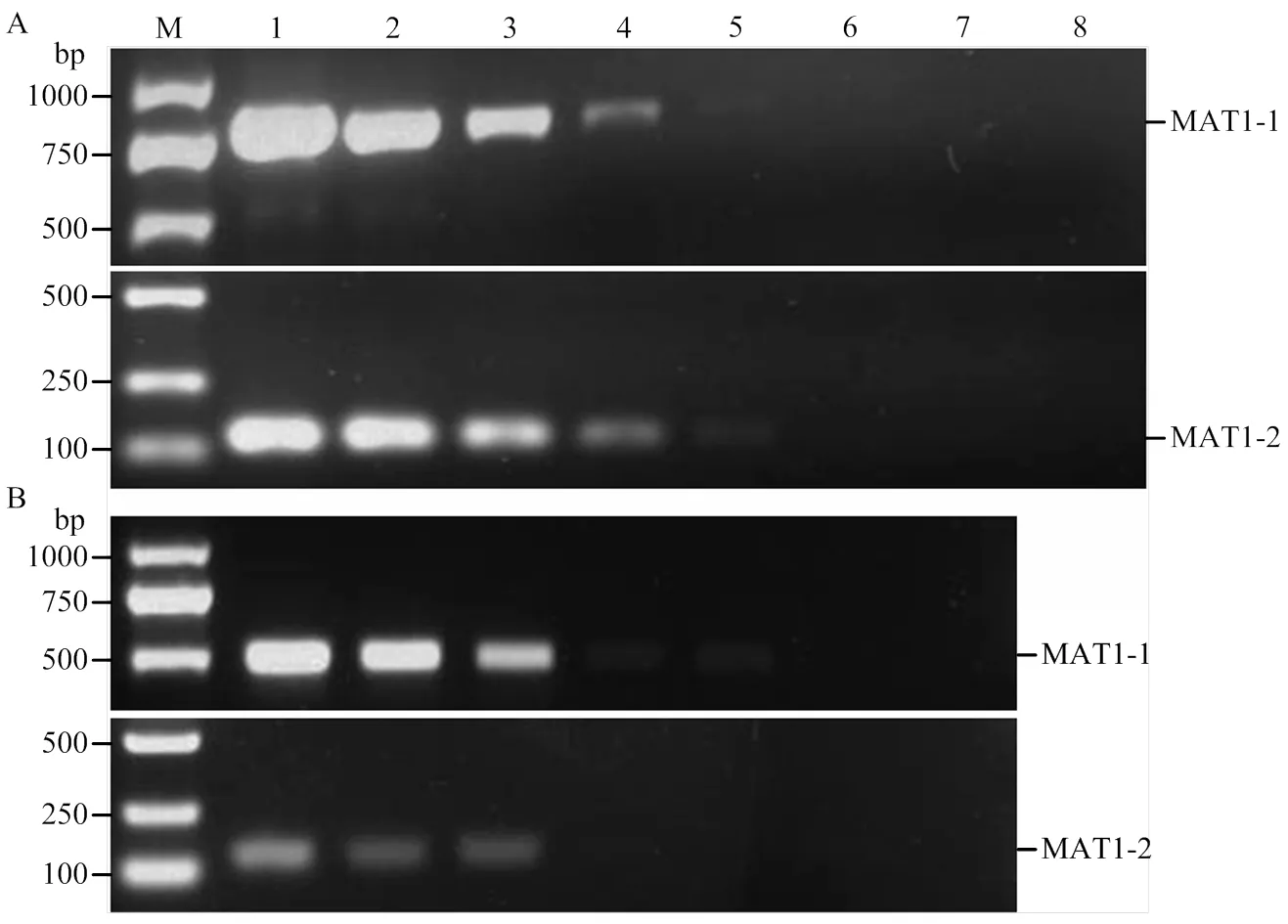
M:2 kb DNA ladder;1—7:(A)玉米大斑病菌MAT1-1和MAT1-2交配型菌株的基因組DNA的量為100、10、1、0.1、0.01、0.001和0.0001 ng Genomic DNA from MAT1-1 and MAT1-2 strains of E. turcicum at amounts of 100, 10, 1, 0.1, 0.01, 0.001 and 0.0001 ng, respectively;(B)玉米小斑病菌MAT1-1和MAT1-2交配型菌株的基因組DNA的量為10、1、0.1、0.01、0.001、0.0001和0.00001 ng Genomic DNA from MAT1-1 and MAT1-2 strains of B. maydis at amounts of 10, 1, 0.1, 0.01, 0.001, 0.0001 and 0.00001 ng, respectively;8:空白對照reagent only without DNA template
2.5 多重PCR特異性檢測
建立的多重PCR檢測體系中,引物StMAT01- 2F/R和StMAT02-3F/R分別僅對玉米大斑病菌MAT1-1和MAT1-2型菌株擴增出一條特異性條帶,而對4株近緣種和14株其他真菌菌株未擴增出任何條帶(圖4-A)。引物ChMAT01-3F/R和ChMAT02- 2F/R分別僅對交配型為MAT1-1和MAT1-2的玉米小斑病菌擴增出一條490和136 bp的特異性條帶,而對4株近緣種和14株其他真菌菌株未檢測出特異性條帶(圖4-B)。

M:2 kb DNA ladder;1—6:分別為3株MAT1-1和MAT1-2的玉米大斑病菌(A)和小斑病菌(B)菌株Three MAT1-1 and MAT1-2 strains of E. turcicum (A) and B. maydis (B), respectively;7—10:表1所示的4株玉米大斑病菌(A)和小斑病菌(B)近緣種菌株Four strains of closely related species of Exserohilum (A) and Bipolaris (B), respectively, listed in Table 1;11—24:表1所示的14株其他真菌菌株Fourteen strains of other fungal species listed in Table 1
2.6 多重PCR檢測體系的應用
分別從福建、安徽、浙江、廣東和海南省分離的129和194株玉米大斑病菌和小斑病菌單孢菌株中提取基因組DNA,進行玉米大斑病菌和小斑病菌交配型的多重PCR檢測。結果表明129和194株不同省份的玉米大斑病菌和小斑病菌均檢測到MAT1-1和MAT1-2兩種交配型,玉米大斑病菌和小斑病菌的交配型檢測成功率均為100%(表3)。所有菌株均為無性態菌株,未檢測到有性態菌株。室內雜交驗證結果表明,與標準菌株雜交也能夠成功檢測出隨機抽取菌株的交配型,且檢測結果與多重PCR檢測結果完全一致(表3)。上述結果表明,通過本研究設計的交配型特異引物和建立的多重PCR檢測體系可對玉米大斑病菌和小斑病菌MAT1-1和MAT1-2兩種交配型的菌株進行快速檢測。
3 討論
有性重組是植物病原菌遺傳變異的重要來源,是病原菌強致病力新小種的出現、抗藥性的產生以及高寄主適合度菌株形成的主要途徑[32-33]。玉米大斑病和小斑病均為典型的氣流傳播性病害,可在田間短期內流行暴發,且該病原菌具有寄主適應性強、生理分化明顯以及遺傳變異性等特點[9,11,34]。因此,檢測和監測玉米大斑病菌和小斑病菌的交配型,揭示其有性生殖和遺傳變異機制,對玉米大斑病和小斑病的長期可持續控制具有重要意義。室內雜交是玉米大斑病菌和小斑病菌交配型的傳統檢測方法,該方法需要具備交配親和性高和已知交配型的標準菌株,且從菌株分離純化到獲得理想的雜交檢測結果耗時較長,不利于變異較快的玉米大斑病菌和小斑病菌大樣本交配型的快速和及時檢測。盡管GAFUR等建立了玉米小斑病菌交配型的PCR檢測方法[35-36],但是,該方法或缺乏有效的靈敏性和特異性檢驗或操作步驟較為繁瑣。因此,本研究分別建立了玉米大斑病菌和小斑病菌交配型的多重PCR檢測方法,該方法具有更加快速、靈敏、準確、特異、可靠以及操作簡便等特點,適合大樣本交配型的快速、準確檢測。
多重PCR是在一個反應體系里加入2對及以上引物進行PCR擴增,反應體系較為復雜,受諸多內外因素的影響[37]。特異引物設計的成功與否直接決定了多重PCR檢測的成敗。本研究利用已報道的玉米大斑病菌和小斑病菌交配型基因進行序列多重比對,在各保守區設計和篩選出錯配率低、退火溫度一致、擴增產物大小合適的4對交配型檢測特異引物,引物經NCBI網站的Primer-BLAST在線工具進行特異性驗證,最終分別成功建立了玉米大斑病菌和小斑病菌交配型的多重PCR檢測方法。優化多重PCR反應體系和擴增條件是獲得理想擴增結果的前提。本研究針對影響多重PCR擴增結果的重要參數,如引物的退火溫度、擴增的延伸時間以及擴增循環數等分別進行單因素3—8個水平的系統優化,結果表明,引物的退火溫度、擴增的延伸時間以及擴增循環數均對多重PCR反應體系有明顯影響。其中特異引物的退火溫度是決定實驗成敗的關鍵因素,一般退火溫度越低,擴增的條帶模糊、特異性低;退火溫度越高,不利于大片段的擴增。因此,本研究通過梯度PCR擴增優化出玉米大斑病菌和小斑病菌交配型多重PCR檢測引物的最佳退火溫度分別為57.2℃和55.0℃。盡管本研究未對多重PCR反應體系中Taq聚合酶用量、dNTPs濃度、Mg2+濃度以及模板DNA濃度進行系統優化,但是根據預混液的推薦劑量進行多重PCR擴增也能獲得理想的結果,表明本研究建立的玉米大斑病菌和小斑病菌交配型多重PCR檢測方法的適用性較好。
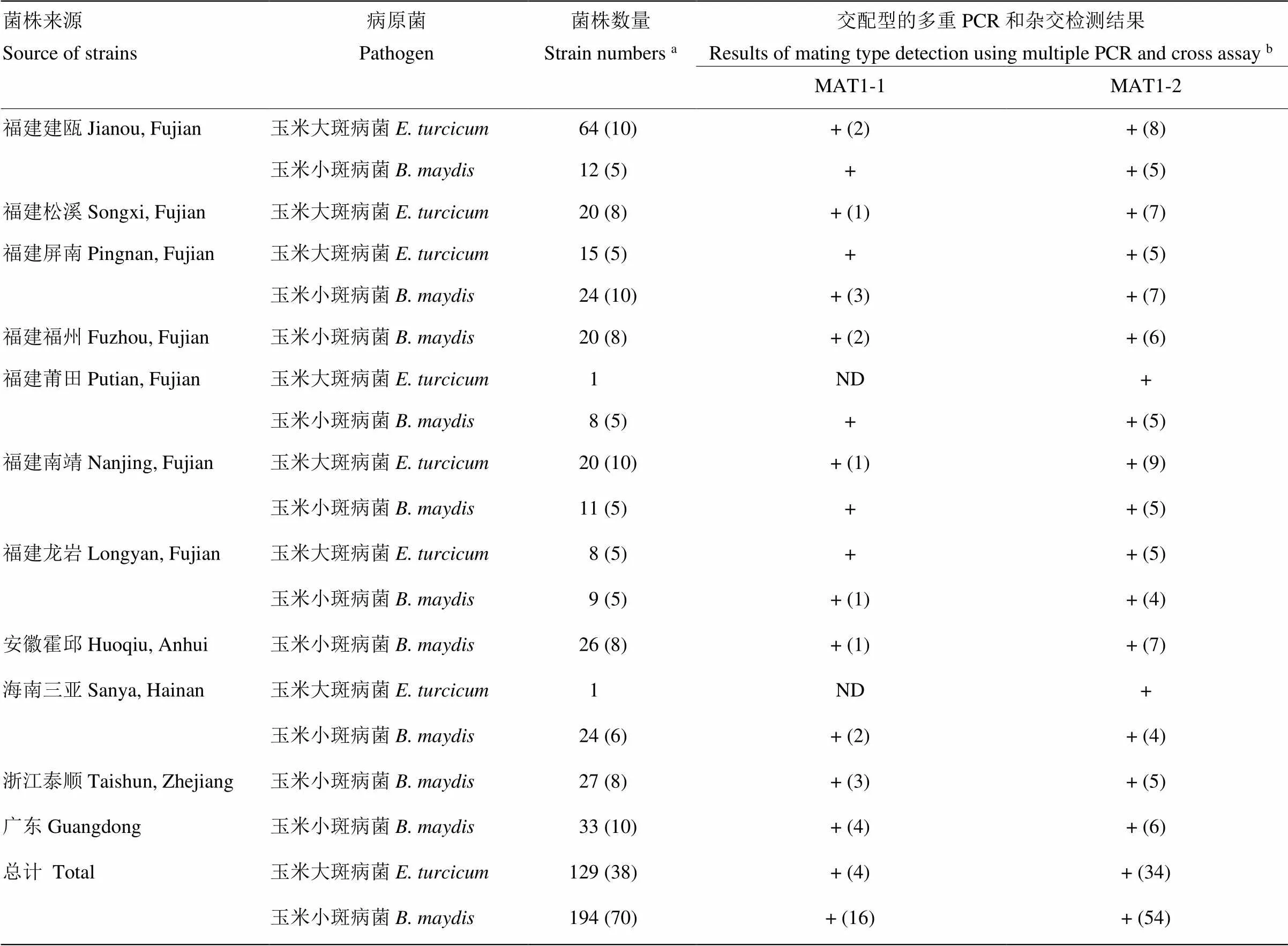
表3 不同地理來源的玉米大斑病菌和小斑病菌交配型的多重PCR和雜交檢測
a括號內數字表示隨機抽取用于雜交實驗的菌株數The number in parentheses represents the number of strains which were randomly selected for cross assays;b“+”:多重PCR方法成功檢測出所有待測菌株的交配型Mating types of all tested strains were successfully detected using multiple PCR method;小括號內數字表示雜交檢測出的菌株數,且與多重PCR檢測結果完全一致The number in parentheses indicates the number of strains detected by cross assays, which are completely consistent with the results of multiple PCR detection;ND:未檢測No detection
理想的交配型PCR檢測方法應具有較高的靈敏度和特異性[36]。多重PCR的靈敏度越高,模板DNA量的需求就越低。本研究建立的玉米大斑病菌和小斑病菌交配型多重PCR檢測最低靈敏度為0.1 ng基因組DNA,該劑量的模板濃度極易從病原菌的菌絲或分生孢子中通過DNA小劑量提取法獲得[38],從而降低了對模板DNA的要求,提高了多重PCR交配型檢測的成功率。引物的特異性是多重PCR的另一重要因素[36],本研究建立的玉米大斑病菌和小斑病菌交配型多重PCR檢測方法不僅能夠很好地區分玉米大斑病菌和小斑病菌的交配型,而且能夠分別從其相應的和近緣種和其他14個屬種間區分開來,避免了由于近緣種干擾而產生的假陽性,提高了多重PCR交配型檢測的準確性。此外,由于本研究建立的玉米大斑病菌和小斑病菌交配型多重PCR檢測方法具有較高的靈敏度和特異性,能夠分別將其從相應的近緣種和其他屬種區分來(圖4),因此,該多重PCR檢測體系還可以用于玉米大斑病和小斑病的田間早期快速診斷和病害的預測預報,為有效預防和控制玉米大斑病和小斑病,保障玉米安全優質生產提供了技術支持。
通過建立的玉米大斑病菌和小斑病菌交配型多重PCR檢測方法分別對來自福建、安徽、浙江、廣東和海南省的129和194株玉米大斑病菌和小斑病菌的交配型進行檢測,結果顯示兩種病原菌的交配型檢測成功率均為100%,且多重PCR檢測結果與雜交驗證結果吻合,表明該檢測方法準確性高、可靠性好。通過交配型檢測發現,不同省份或地區的玉米大斑病菌和小斑病菌均同時存在MAT1-1和MAT1-2兩種交配型,所有菌株均為無性態菌株,未檢測到有性態菌株。該研究結果與郭建國等均檢測到玉米大斑病菌田間有性態菌株的結果不一致[12,39-40]。本研究未檢測到有性態菌株,說明上述采集地田間菌株發生有性生殖的風險性較低。但是,不同交配型菌株的同時存在,增加了有性重組的可能性,暗示未來病菌群體的遺傳結構和遺傳多樣性可能發生更加復雜的變化。因此,將來工作的重點應該是加強對玉米大斑病菌和小斑病菌田間交配型、群體遺傳結構和遺傳多樣性的監測以及病原菌遺傳變異機制的深入研究。
4 結論
通過設計交配型檢測特異引物并對反應條件進行優化,分別建立了玉米大斑病菌和小斑病菌交配型的多重PCR檢測方法。該方法具有靈敏度高、特異性好和操作簡便的特點,能夠準確、快速地檢測出玉米大斑病菌和小斑病菌MAT1-1和MAT1-2兩種交配型,為玉米大斑病菌和小斑病菌交配型的田間分布和監測以及有性遺傳研究提供了可靠的技術方法。
[1] WEEMS J D, BRADLEY C A.race population distribution in the north central United States., 2018, 102(2): 292-299.
[2] DAI Y L, GAN L, RUAN H C, SHI N N, DU Y X, LIAO L, WEI Z X, TENG Z Y, CHEN F R, YANG X J. Sensitivity ofto three demethylation inhibitor fungicides, propiconazole, diniconazole and prochloraz, and their efficacy against southern corn leaf blight in Fujian Province, China., 2018, 152(2): 447-459.
[3] WANG M, WANG S Q, MA J, YU C J, GAO J X, CHEN J. Detection ofraces in South China., 2017, 165(10): 681-691.
[4] HUMAN M P, BARNES I, CRAVEN M, CRAMPTON B G. Lack of population structure and mixed reproduction modes infrom South Africa., 2016, 106(11): 1386-1392.
[5] 代玉立, 甘林, 阮宏椿, 石妞妞, 杜宜新, 陳福如, 楊秀娟. 福建省丙環唑不同敏感性玉米小斑病菌的遺傳多樣性和致病性. 植物病理學報, 2019, 49(1): 64-74.
DAI Y L, GAN L, RUAN H C, SHI N N, DU Y X, CHEN F R, YANG X J. Genetic diversity and pathogenicity of different propiconazole-sensitive isolates ofin Fujian Province., 2019, 49(1): 64-74. (in Chinese)
[6] 趙書文, 楊秀林, 郭東. 玉米大斑病的流行原因與綜合治理措施. 中國植保導刊, 2005, 25(3): 10-12.
ZHAO S W, YANG X L, GUO D. Epidemic causes ofand its integrated management measures., 2005, 25(3): 10-12. (in Chinese)
[7] 裴靜宇, 高鋒, 楊彥文, 張姼, 楊信東. 玉米小斑病重要流行環節的初步定量研究I. 孢子萌發侵入、病斑潛育顯癥及擴展. 吉林農業大學學報, 2007, 29(1): 28-32.
PEI J Y, GAO F, YANG Y W, ZHANG S, YANG X D. Preliminary quantitative studies on important epidemic links ofⅠ. The spores germination penetration, incubation and expand of lesion., 2007, 29(1): 28-32. (in Chinese)
[8] 陳利鋒, 徐敬友. 農業植物病理學. 3版. 北京: 中國農業出版社, 2007.
CHEN L F, XU J Y... Beijing: China Agriculture Press, 2007. (in Chinese)
[9] 郭麗媛, 賈慧, 曹志艷, 谷守芹, 孫淑琴, 董金皋. 玉米大斑病菌有性雜交后代的交配型與寄生適合度分化. 中國農業科學, 2013, 46(19): 4058-4065.
GUO L Y, JIA H, CAO Z Y, GU S Q, SUN S Q, DONG J G. Analysis on mating type and parasitic fitness diversity in sexual hybridization offsprings of., 2013, 46(19): 4058-4065. (in Chinese)
[10] 王玉萍, 王曉鳴, 馬青. 我國玉米大斑病菌生理小種組成變異研究. 玉米科學, 2007, 15(2): 123-126.
WANG Y P, WANG X M, MA Q. Races of, causal agent of northern leaf blight in China., 2007, 15(2): 123-126. (in Chinese)
[11] 馮為民. 黃淮海地區玉米小斑病菌變異研究[D]. 保定: 河北大學, 2012.
FENG W M. The study of differentiation ofin Huang-Huai-Hai region[D]. Baoding: Hebei University, 2012.(in Chinese)
[12] 郭建國, 楊鳳珍, 杜蕙, 金社林, 張新瑞. 甘肅省玉米大斑病菌生理小種結構組成與交配型測定. 植物保護, 2018, 44(6): 85-90.
GUO J G, YANG F Z, DU H, JIN S L, ZHANG X R. Structural composition of physiological races and mating types ofin Gansu., 2018, 44(6): 85-90. (in Chinese)
[13] CHAO C C T, ELLINGBOE A H. Selection for mating competence inpathogenic to rice., 1991, 69(10): 2130-2134.
[14] NOTTEGHEM J L, SILUé D. Distribution of the mating type inpopulations pathogenic on rice., 1992, 82(4): 421-424.
[15] CHéRIF M, CHILVERS M I, AKAMATSU H, PEEVER T L, KAISER W J. Cloning of the mating type locus from(teleomorph:) and development of a multiplex PCR mating assay forspecies., 2006, 50(3): 203-215.
[16] 史文琦, 龔雙軍, 曾凡松, 薛敏峰, 楊立軍, 喻大昭. 小麥白粉病菌有性生殖與自然群體交配型檢測. 植物病理學報, 2016, 46(5): 645-652.
SHI W Q, GONG S J, ZENG F S, XUE M F, YANG L J, YU D Z. Sexual reproduction and detection of mating-type off. sp.populations., 2016, 46(5): 645-652. (in Chinese)
[17] BREWER M T, CADLE-DAVIDSON L, CORTESI P, SPANU P D, MILGROOM M G. Identification and structure of the mating-type locus and development of PCR-based markers for mating type in powdery mildew fungi., 2011, 48(7): 704-713.
[18] TAKAN J P, CHIPILI J, MUTHUMEENAKSHI S, TALBOT N J, MANYASA E O, BANDYOPADHYAY R, SERE Y, NUTSUGAH S K, TALHINHAS P, HOSSAIN M, BROWN A E, SREENIVASAPRASAD S.populations adapted to finger millet and rice exhibit distinctive patterns of genetic diversity, sexuality and host interaction., 2012, 50(2): 145-158.
[19] DE MICCOLIS ANGELINI R M, ROTOLO C, POLLASTRO S, FARETRA F. Molecular analysis of the mating type () locus in strains of the heterothallic ascomycete., 2016, 65(8): 1321-1332.
[20] FOSTER S J, SINGH G, FITT B D L, ASHBY A M. Development of PCR based diagnostic techniques for the two mating types of(light leaf spot) on winter oilseed rape (ssp.)., 1999, 55(2): 111-119.
[21] LINDE C C, ZALA M, CECCARELLI S, MCDONALD B A. Further evidence for sexual reproduction inbased on distribution and frequency of mating-type alleles., 2003, 40(2): 115-125.
[22] ALLIOUI N, SIAH A, BRINIS L, REIGNAULT P, HALAMA P. Mating type distribution provides evidence for sexual reproduction ofin Algeria., 2014, 36(4): 475-481.
[23] PEARCE T L, SCOTT J B, HAY F S, PETHYBRIDGE S J. Mating-type gene structure and spatial distribution ofin pyrethrum fields., 2016, 106(12): 1521-1529.
[24] TURGEON B G, YODER O C. Proposed nomenclature for mating type genes of filamentous ascomycetes., 2000, 31(1): 1-5.
[25] RAMATHANI I, BIRUMA M, MARTIN T, DIXELIUS C, OKORI P. Disease severity, incidence and races ofon sorghum in Uganda., 2011, 131(3): 383-392.
[26] TURGEON B G, BOHLMANN H, CIUFFETTI L M, CHRISTIANSEN S K, YANG G, SCH?FER W, YODER O C. Cloning and analysis of the mating type genes from., 1993, 238(1/2): 270-284.
[27] 代玉立, 甘林, 阮宏椿, 石妞妞, 杜宜新, 陳福如, 楊秀娟. 福建省鮮食玉米小型葉斑病的病原菌鑒定. 福建農業學報, 2017, 32(12): 1341-1349.
DAI Y L, GAN L, RUAN H C, SHI N N, DU Y X, CHEN F R, YANG X J. Pathogen identification of small leaf spots on sweet corn plants in Fujian., 2017, 32(12): 1341-1349. (in Chinese)
[28] YE J, COULOURIS G, ZARETSKAYA I, CUTCUTACHE I, ROZEN S, MADDEN T L. Primer-blast: a tool to design target-specific primers for polymerase chain reaction., 2012, 13: 134.
[29] 高金欣, 高增貴, 張小飛, 張碩, 陳璐. 一種簡捷的玉米大斑病病菌單孢分離方法. 微生物學通報, 2010, 37(10): 1548-1550.
GAO J X, GAO Z G, ZHANG X F, ZHANG S, CHEN L. A simple and feasible method for single-spore isolation of., 2010, 37(10): 1548-1550. (in Chinese)
[30] DAI Y L, YANG X J, GAN L, CHEN F R, RUAN H C, DU Y X, SHI N N, GAO Z M. First report of southern leaf blight caused byon corn (L.) in Fujian Province, China., 2016, 100(8): 1781.
[31] OIDE S, KRASNOFF S B, GIBSON D M, TURGEON B G. Intracellular siderophores are essential for ascomycete sexual development in heterothallicand homothallic., 2007, 6(8): 1339-1353.
[32] GLASS L N, KULDAU G A. Mating type and vegetative incompatibility in filamentous ascomycetes., 1992, 30: 201-224.
[33] BI Y, HU J, CUI X, SHAO J, LU X, MENG Q, LIU X. Sexual reproduction increases the possibility thatwill develop resistance to dimethomorph in China., 2014, 63(6): 1365-1373.
[34] JINDAL K K, TENUTA A U, WOLDEMARIAM T, ZHU X Y, HOOKER D C, REID L M. Occurrence and distribution of physiological races ofin Ontario, Canada., 2019, 103(7): 1450-1457.
[35] GAFUR A, TANAKA C, OUCHI S, TSUDA M. A PCR-based method for mating type determination in., 1997, 38(4): 455-458.
[36] DAI Y L, GAN L, RUAN H C, SHI N N, DU Y X, CHEN F R, YANG X J. A PCR method to detect mating types of., 2018, 40(3): 358-367.
[37] 劉芮池, 程有普, 柴阿麗, 石延霞, 謝學文, 帕提古麗, 李寶聚. 蔬菜土傳病原菌三重PCR檢測體系的建立與應用. 中國農業科學, 2019, 52(12): 2069-2078.
LIU R C, CHENG Y P, CHAI A L, SHI Y X, XIE X W, PATIGULI, LI B J. Establishment and application of a triplex PCR detection system for vegetable soil-borne pathogens., 2019, 52(12): 2069-2078. (in Chinese)
[38] LU S W, PLATZ G J, EDWARDS M C, FRIESEN T L. Mating type locus-specific polymerase chain reaction markers for differentiation off.andf., the causal agents of barley net blotch., 2010, 100(12): 1298-1306.
[39] 孫淑琴, 溫雷蕾, 董金皋. 玉米大斑病菌的生理小種及交配型測定. 玉米科學, 2005, 13(4): 112-113, 123.
SUN S Q, WEN L L, DONG J G. Identification of physiological races and mating type of., 2005, 13(4): 112-113, 123. (in Chinese)
[40] 王利智, 康志鈺, 吳景芝, 吳毅歆, 毛自朝, 何月秋. 云南省玉米大斑病菌生理小種的鑒定及交配型分析. 華中農業大學學報, 2011, 30(2): 187-192.
WANG L Z, KANG Z Y, WU J Z, WU Y X, MAO Z C, HE Y Q. Identification of physiological races and analysis of mating type ofin Yunnan Province., 2011, 30(2): 187-192. (in Chinese)
Establishment and Application of a Multiple PCR Method to Detect Mating Types ofand
DAI YuLi1, GAN Lin1, TENG ZhenYong2, YANG JingMin3, QI YueYue4, SHI NiuNiu1, CHEN FuRu1, YANG XiuJuan1
(1Institute of Plant Protection, Fujian Academy of Agricultural Sciences/Fujian Key Laboratory for Monitoring and Integrated Management of Crop Pests, Fuzhou 350013;2Fujian Seed Management Station, Fuzhou 350001;3Jianou Municipal Bureau of Agriculture and Rural Affairs, Jianou 353100, Fujian;4Zhejiang Tianfeng Biological Science Co. Ltd, Jinhua 321000, Zhejiang)
【Objective】Northern corn leaf blight (NCLB) and southern corn leaf blight (SCLB), caused byand, respectively, are the most important foliar fungal diseases affecting maize production. The objective of this study is to establish a multiple PCR method to detect mating types ofand, and to provide a technical method for the study of mating type distribution in the field and sexual reproduction ofand.【Method】Mating type-specific primers for the two pathogens were designed on the basis of mating type gene sequences of(accession numbers: GU997138 for MAT1-1; GU997137 for MAT1-2) and(accession numbers: X68399 for MAT1-1; X68398 for MAT1-2) obtained from GenBank, and the important parameters of primer annealing temperatures, extension times and amplification cycles in the amplification program were optimized using the single factor method. A multiple PCR method was established to detect mating types ofand, and the sensitivity and specificity of the multiple PCR were also assessed. Meanwhile, the mating types of 129 strains ofand 194 strains offrom field-collections were detected by the multiple PCR to determine the adaptability of the established method.【Result】The expected 816, 132 bp (), and 490, 136 bp () target fragments were amplified specifically using the multiple PCR with mating type-specific primers of StMAT01-2F/R, StMAT02-3F/R, and ChMAT01-3F/R, ChMAT02-2F/R from MAT1-1 and MAT1-2 strains, respectively. A 25 μL PCR reaction system consisted of 12.5 μL 2×Multiplex PCR Mix, 10 pmol each primer, and 100 ng DNA template. The annealing temperatures forandwere 57.2℃ and 55.0℃, respectively, and the number of amplification cycles was 35. The multiple PCR method could reliably detect mating types ofat 0.1 ng genomic DNA for MAT1-1 or 0.01 ng DNA for MAT1-2 from single-spore strains, while the sensitivity of the multiple PCR to detect mating types ofwas 0.1 ng genomic DNA for both MAT1-1 and MAT1-2 from pure culture strains. The method exhibited specificity in differentiating mating types ofandfrom their closely-related species, as well as 14 other fungal genera. The results of mating types detection ofandstrains from different geographical origins indicated that the multiple PCR could reliably detect mating types of 129 and 194 strains ofand, respectively. These results were consistent with the verification results of laboratorial cross assays with random selected strains from different locations.【Conclusion】The established multiple PCR method for mating types detection ofandin this study was characterized as high sensitivity, specificity and user-friendly control, it could accurately and rapidly detect mating types ofand. This study provides a reliable technique and approach for the study of distribution and monitoring of mating types in the field and sexual reproduction ofand.
;; mating type; multiple PCR; sensitivity; specificity
2019-08-13;
2019-09-18
福建省屬公益類科研院所專項(2017R1025-3,2018R1025-1)、國家重點研發計劃(2018YFD0200706)、福建省農業科學院青年自由探索項目(AA2018-14)、福建省農業科學院青年科技英才百人計劃(YC2016-4)、福建省農業科學院植物保護創新團隊(STIT2017-1-8)
代玉立,E-mail:dai841225@126.com。通信作者楊秀娟,E-mail:yxjzb@126.com
(責任編輯 岳梅)

