雷公藤甲素對非小細胞肺癌細胞系A549增殖的抑制和凋亡的誘導
劉 倩,湯建華,張志華
(河北北方學院附屬第一醫院 1.藥學部; 2.呼吸內科, 河北 張家口 075000)
肺癌(lung cancer)是全球范圍內癌相關死亡的主要原因,且大多數肺癌患者預后不良[1]。目前基因治療已成為新的治療肺癌的發展方向[2]。趨化因子被認為是癌細胞生物過程中的特異性主要調節劑[3]。趨化因子受體4(chemokine receptor 4,CXCR4)是G蛋白耦聯受體超家族成員之一,參與多種生理病理過程[4-5]。雷公藤甲素(triptolide,TP)是從衛矛科植物雷公藤中提取的有效活性物質。多項體內外研究顯示,其在乳腺癌、肝細胞癌和卵巢癌等多種腫瘤中均具有良好的抗腫瘤活性[6-8]。最近報道,雷公藤甲素可廣泛抑制基因的轉錄,但其作用機制尚不明確[9]。有報道,雷公藤甲素可誘導急性髓系白血病干細胞凋亡,且蛋白質印跡結果顯示CXCR4蛋白表達水平降低,提示雷公藤甲素可能通過調控CXCR4的表達發揮功能[10]。因此本實驗觀察雷公藤甲素干預的非小細胞肺癌細胞A549中對CXCR4的表達的影響,并采用細胞轉染恢復CXCR4的表達,觀察對A549細胞增殖和凋亡的影響,以期探討雷公藤甲素在非小細胞肺癌細胞增殖的影響及可能的作用機制。
1 材料與方法
1.1 材料和主要試劑
非小細胞肺癌細胞系A549(ATCC);雷公藤甲素、MTT試劑(Sigma-Aldrich公司);RPMI-1640培養基、胎牛血清(Hyclon公司);青霉素、鏈霉素(杭州四季青生物工程材料有限公司);pcDNA-CXCR4過表達載體質粒和pcDNA空載體質粒(廣州市銳博生物科技有限公司);Lipofectamine 2000轉染試劑(Invitrogen公司);RNA提取試劑盒(北京康為世紀生物科技有限公司);反轉錄試劑盒(大連寶生物工程有限公司);SYBR Green熒光染料試劑盒(Roche公司);Annexin Ⅴ-FITC/PI細胞凋亡檢測試劑盒、RIPA細胞裂解液、BCA蛋白濃度檢測試劑盒、超敏ECL化學發光試劑盒(上海碧云天生物技術研究所);鼠抗人CXCR4單抗、鼠抗人PCNA單抗、鼠抗人Ki-67單抗、鼠抗人Bax單抗、鼠抗人Bcl-2單抗和辣根過氧化酶標記山羊抗鼠IgG(Abcam公司)。
1.2 方法
1.2 .1 細胞的培養及分組處理:將非小細胞肺癌細胞A549培養于含有10%滅活胎牛血清、100 U/mL青-鏈霉素的RPMI-1640培養基中,置體積分數為5% CO2、飽和濕度、37 ℃恒溫培養箱中常規培養,每天觀察細胞增殖狀態,及時換液,細胞匯合度達90%時進行傳代培養。將A549細胞分為4組,將未經雷公藤甲素處理未轉染的細胞設為對照組;將100 nmol/L的雷公藤甲素處理的細胞設為TP組;將轉染pcDNA-CXCR4質粒并施加100 nmol/L的雷公藤甲素的細胞設為CXCR4+TP組;將轉染pcDNA空載質粒并施加100 nmol/L的雷公藤甲素的細胞設為NC+TP組。轉染具體操作步驟參考Lipofectamine 2000轉染試劑說明書進行,轉染后各組細胞繼續培養。
1.2.2 RT-qPCR檢測A549細胞中CXCR4 mRNA:收集處理48 h后各組A549細胞,采用RNA提取試劑盒提取各組細胞中總RNA,采用反轉錄試劑盒合成cDNA,以SYBR Green熒光染料試劑盒進行實時熒光定量PCR擴增,反應條件設置為94 ℃預變性5 min;94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸15 s,共設置40個循環。CXCR4上游引物:5′-CCG TGGCAAACTGGTACTTT-3′;下游引物:5′-GACGC CAACATAGACCACCT-3′。β-actin上游引物:5′-C ACGATGGAGGGGCCGGACTCATC-3′;下游引物:5′-TAAAGACCTCTATGCCAACACAGT-3′。以β-actin為內參,通過2-ΔΔCt法計算各組A549細胞中CXCR4 mRNA表達水平。
1.2.3 MTT法檢測A549細胞增殖:取對數期A549細胞以胰蛋白酶消化成單個細胞,種植到96孔板中,種植密為1×104個/孔,細胞貼壁后按照上述1.3方法分組和處理,在24、48和72 h分別向每孔細胞中加入150 μL MTT溶液,37 ℃孵育4 h,再向細胞中國加入100 μL二甲基亞砜,振蕩反應10 min,待沉淀完全溶解后,使用全自動酶標儀檢測波長450 nm處各孔細胞吸光度值(A值),每組細胞各個時間點設置3個復孔,實驗重復3次。
1.2.4 Annexin Ⅴ-FITC/PI雙染色法檢測A549細胞凋亡:各組A549細胞48 h后,分別收集各組細胞,以預冷的PBS洗滌細胞后,分別向各組細胞中添加100 μL 結合緩沖液,再依次向細胞中加入annexin Ⅴ-FITC和5 μL PI染液各5 μL,輕輕混勻,在室溫下避光反應20 min,使用300目細胞篩去除雜質,立即上流式細胞儀檢測細胞凋亡。
1.2.5 Western blot檢測A549細胞中蛋白表達:各組A549細胞48 h后,分別收集細胞,加入適量RIPA細胞裂解液,在冰上裂解細胞,提取細胞中總蛋白,使用BCA蛋白濃度測定試劑盒檢測蛋白濃度,在蛋白中加入等體積的上樣緩沖液,加熱使蛋白樣品變性,取40 μg變性蛋白加入到上樣孔中,行12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,采用半干法將蛋白電轉至硝酸纖維素膜上,將膜放置在5%脫脂奶粉中封阻2 h,分別加入一抗進行孵育(PCNA一抗1∶500稀釋,Ki-67一抗1∶500稀釋,Bax一抗1∶800稀釋,Bcl-2一抗1∶800稀釋,CXCR4一抗1∶500稀釋),4 ℃孵育過夜,以TBST洗膜15 min×3次,加入1∶3 000稀釋的辣根過氧化物酶標記的IgG,室溫孵育1 h,以TBST洗膜15 min×3次,加入超敏ECL化學發光試劑,曝光,成像,拍照,以GAPDH為內參,使用Quantity One軟件分析各條帶吸光度值,計算各組細胞中目的蛋白相對表達水平。
1.3 統計學分析
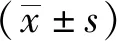
2 結果
2.1 雷公藤甲素抑制非小細胞肺癌細胞A549中CXCR4的表達
雷公藤甲素干預A549細胞后CXCR4 mRNA和蛋白表達水平均明顯降低(P<0.05)(表1,圖1)。

表1 雷公藤甲素對A549細胞中CXCR4的表達的影響Table 1 Effect of triptolide on the expression of CXCR4
*P<0.05 compared with the control group.

圖1 Western blot檢測各組細胞中CXCR4的表達水平Fig 1 Western blot analysis of CXCR4 expression levels in each group of cells
2.2 轉染pcNDA-CXCR4逆轉雷公藤甲素對CXCR4表達的抑制
轉染48 h后,與NC+TP組相比,CXCR4+TP組A549細胞中CXCR4 mRNA和蛋白表達水平明顯升高(P<0.05)(表2,圖2)。
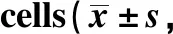
表2 轉染pcDNA-CXCR4對A549細胞中CXCR4的表達的影響Table 2 Effect of transfection of pcDNA-CXCR4 on the expression of CXCR4 in A549 n=9)
*P<0.05 compared with the NC+TP group.

圖2 Western blot檢測各組細胞中CXCR4的表達水平Fig 2 Western blot analysis of CXCR4 expression levels in each group of cells
2.3 CXCR4逆轉雷公藤甲素對A549細胞增殖抑制作用
與對照組相比,TP組細胞A值從48 h后顯著降低(P<0.05)。與NC+TP組相比,CXCR4+TP組細胞A值從48 h后明顯升高(P<0.05)。與TP組相比,NC+TP組細胞A值無明顯改變(表3)。

表3 各組A549細胞A值比較Table 3 Comparison of A values of A549 cells in each
*P<0.05 compared with control group;#P<0.05 compared with NC+TP group.
2.4 CXCR4逆轉雷公藤甲素對A549細胞凋亡誘導作用
與對照組相比,TP組細胞凋亡率明顯升高(P<0.05)。與NC+TP組相比,CXCR4+TP組細胞凋亡率顯著降低(P<0.05)。與TP組相比,NC+TP組細胞凋亡率無明顯改變(P>0.05)(圖3,表4)。表明恢復CXCR4的表達能夠降低雷公藤甲素誘導的A549細胞凋亡。

表4 各組A549細胞凋亡率比較Table 4 Comparison of apoptosis rates of A549 cells
*P<0.05 compared with control group;#P<0.05 compared with NC+TP group.
2.5 各組A549細胞中增殖和凋亡蛋白表達情況
與對照組相比,TP組細胞中PNCA、Ki-67和Bcl-2蛋白表達明顯下調,Bax蛋白表達明顯上調(P<0.05)。與NC+TP組相比, CXCR4+TP組細胞中PNCA、Ki-67和Bcl-2蛋白表達明顯上調, Bax蛋白表達明顯下調(P<0.05)。與TP組相比,NC+TP組細胞中PNCA、Ki-67、Bax和Bcl-2蛋白表達無明顯改變(P>0.05)(圖4,表5)。表明恢復CXCR4的表達能夠逆轉雷公藤甲素導致的PNCA、Ki-67和Bcl-2蛋白表達下調以及Bax蛋白表達的上調。

圖4 Western blot檢測各組A549細胞中PNCA、Ki-67、Bax和Bcl-2蛋白表達情況Fig 4 Western blot analysis of PNCA, Ki-67, Bax and Bcl-2 protein expression in A549 cells
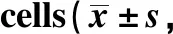
表5 各組A549細胞中PNCA、Ki-67、Bax和Bcl-2蛋白表達水平比較Table 5 comparison of PNCA, Ki-67, Bax and Bcl-2 protein expression levels in each group of A549 n=9)
*P<0.05 compared with control group;#P<0.05 compared with NC+TP group.
3 討論
RCXCR4基因在非小細胞肺癌細胞侵襲、侵襲及耐藥中扮演重要角色,提示CXCR4可能成為非小細胞肺癌的診斷和臨床治療的新的作用靶點[11-12]。
近年來,雷公藤甲素的抗腫瘤活性受到研究者的廣泛關注。多項研究發現雷公藤甲素可阻礙A549細胞侵襲和轉移,但迄今為止,其在非小細胞肺癌中的作用機制仍不完全清楚[13]。本實驗根據以往研究及前期試驗結果,使用100 nmol/L的雷公藤甲素處理A549細胞,發現細胞A值顯著降低,凋亡率明顯升高,提示雷公藤甲素可抑制A549細胞增殖,誘導細胞凋亡,該實驗結果與以往研究類似。此外,本實驗發現,雷公藤甲素干預的A549細胞中CXCR4 mRNA和蛋白表達水平均明顯下調。
此外本實驗通過在A549細胞中轉染CXCR4過表達載體質粒,恢復雷公藤甲素誘導的CXCR4的表達水平的降低,觀察對A549細胞增殖和凋亡的影響。結果顯示,恢復CXCR4表達能夠逆轉雷公藤甲素誘導的細胞增殖抑制作用,且降低雷公藤甲素誘導的細胞凋亡,表明雷公藤甲素通過抑制CXCR4的表達抑制A549細胞增殖,誘導細胞凋亡。
PCNA及Ki-67高表達與肺癌的發生、進展密切相關,是判斷肺癌預后及惡性程度的重要指標[14]。本實驗通過Western blot檢測增殖細胞核抗原PCNA和Ki-67表達情況發現,PCNA和Ki-67在雷公藤甲素干預后表達下調,回復CXCR4表達后PCNA和Ki-67蛋白表達上調。提示雷公藤甲素可通過調控CXCR4的表達下調PCNA和Ki-67的表達,來實現抑制細胞增殖的作用。Bax和Bcl-2均屬于Bcl-2家族成員,Bax屬于促凋亡基因,而Bcl-2為抗凋亡基因。當細胞受死亡信號刺激時,Bax發生構象改變,與Bcl-2相互作用,導致Bcl-2的保護效應喪失使細胞趨于凋亡[15]。本實驗檢測結果顯示,Bax蛋白的表達在雷公藤甲素干預后表達上調,恢復CXCR4表達后其表達下調,而Bcl-2蛋白表達與Bax蛋白表達呈相反趨勢。提示雷公藤甲素可通過調控CXCR4的表達上調Bax和下調Bcl-2蛋白表達,來實現誘導細胞凋亡的作用。
綜上,雷公藤甲素可能通過下調CXCR4基因的表達抑制A549細胞增殖,誘導細胞凋亡。但CXCR4基因通過何種信號通路參與細胞增殖和凋亡過程,具體作用機制仍需進一步的體外及體內實驗進行深入探究。

